短链脂肪酸通过激活GPR43上调AMPK信号通路抑制小鼠胰岛β细胞凋亡*
张春雪,王晨菲,靳 瑾△
新疆医科大学第五附属医院:1.体检与健康管理科;2.内分泌科,新疆乌鲁木齐 830000
据报道,糖尿病是全球范围内10大疾病相关死亡原因之一,2019年约有400万20~79岁的人死于糖尿病[1]。研究发现,胰岛β细胞凋亡进而导致胰岛的功能损害是1型糖尿病(T1D)发病的原因之一[2]。目前针对T1D及其并发症尚无理想的治疗方法[3],因此寻找更好的生物治疗靶点来控制T1D至关重要。
肠道微生物能够发酵难以消化的食物,如膳食纤维等,最终产生短链脂肪酸[4],短链脂肪酸是指低于6个碳原子的脂肪酸盐,如醋酸盐、丙酸盐和丁酸盐等[5]。研究表明,仅口服和膳食补充丁酸盐可以预防高脂肪饮食引起的肥胖和胰岛素抵抗[6],MOON等[7]研究发现,短链脂肪酸水平降低与T1D患者风险增加相关。同时有研究表明,增加短链脂肪酸的摄取可以缓解1型糖尿病患者的症状[8]。G蛋白偶联受体43(GPR43)是一种G蛋白偶联受体,主要在免疫细胞、肠内分泌细胞和脂肪细胞中表达,可识别短链脂肪酸[9]。胰岛β细胞凋亡是T1D的关键致病因素,PINGITORE等[10]研究发现,短链脂肪酸在体外刺激胰岛素分泌并减少小鼠和人类胰岛细胞凋亡。目前,短链脂肪酸抑制胰岛β细胞凋亡的分子机制仍缺乏进一步的研究。本研究通过对TID小鼠口服灌胃乙酸钠和丙酸钠治疗,探究短链脂肪酸对小鼠胰岛β细胞的调节作用及相关机制。
1 材料与方法
1.1材料来源 40只SPF级雄性C57BL/6J小鼠(6~8周龄,20~25 g)购自新疆医科大学实验动物中心,生产许可证号为SCXK(新)2018-0002。所有小鼠于室温25 ℃,自然光暗周期的环境中饲养,实验期间自由饮食、饮水。
1.2细胞与主要试剂 链脲佐菌素(STZ)购自美国SigmaAldrich公司,乙酸钠、丙酸钠购自上海谱振生物有限公司,胰岛素ELISA检测试剂盒购自上海酶联生物科技有限公司,胶原酶Ⅴ购自北京沃卡威生物技术有限公司,Ficoll分离液、Hanks平衡盐溶液购自上海士锋生物科技有限公司,min6细胞购于上海谷研生物科技有限公司,RPMI 1640培养基、胎牛血清、胰酶购自赛默飞世尔科技(中国)有限公司。si-NC、si-GPR43、LipofectamineTM2000购自美国Invitrogen公司,TRIzol、逆转录试剂盒和SYBR Green试剂购自上海翌圣公司,GPR43抗体、AMPK抗体、p-AMPK抗体、bcl-2抗体、caspase3抗体购自英国abcam公司,辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体购自广州硕谱生物科技有限公司,RIPA组织细胞快速裂解液购自北京索莱宝科技有限公司,ECL试剂盒购自美国Millipore公司,Annexin V FITC试剂盒购自武汉伊莱瑞特生物科技股份有限公司。GPR43、bcl-2、caspase3的PCR引物由上海生工生物工程有限公司合成。
1.3实验方法
1.3.1动物造模、分组与给药 将40只C57BL/6J小鼠随机分为4组:正常组、模型组、乙酸钠治疗组、丙酸钠治疗组,每组10只。其中模型组、乙酸钠治疗组、丙酸钠治疗组小鼠混于一起造模,给予一次性腹腔注射 STZ(120 mg/kg),于1周后小鼠尾静脉取血糖,空腹血糖>13.8 mmol/L,则确认模型成功,随后再随机将这些小鼠分为模型组、乙酸钠治疗组和丙酸钠治疗组。乙酸钠治疗组、丙酸钠治疗组分别每日灌胃乙酸钠(2 000 mg/kg)和丙酸钠(2 000 mg/kg),正常组、模型组灌胃同等剂量生理盐水。4组小鼠均每日灌胃给药,1周后检测各组小鼠体重和血糖水平。
1.3.2葡萄糖耐量试验 于干预1周后,将小鼠禁食8 h,取小鼠尾静脉血,用微量血糖仪检测空腹血糖,随后给予0.04 mL/kg 50%葡萄糖溶液灌胃,于灌胃后0.0、0.5、1.0、2.0 h取尾静脉血,检测血糖水平,并计算血糖曲线下面积(AUC)。
1.3.3血清胰岛素水平检测 将小鼠眼眶取血,离心,取上清液,按照酶联免疫吸附试验(ELISA)试剂盒说明书,用多功能酶标仪检测吸光度,计算血清胰岛素水平。
1.3.4胰岛的提取 麻醉后脱颈处死小鼠,打开腹腔,暴露术野。用丝线结扎胆总管汇入十二指肠处后,用胶原酶Ⅴ(1 mg/mL)2~3 mL充分灌注小鼠胰腺,37 ℃恒温静置消化15 min。然后,用含10%FBS的预冷Hanks平衡盐溶液终止消化。使用Ficoll密度梯度离心法纯化小鼠胰岛(密度1.108、1.096、1.069和1.037 g/mL)。
1.3.5细胞培养 min6细胞采用含10% FBS的RPMI 1640培养基培养,在5% CO2、37 ℃恒温培养箱培养。细胞达80%汇合时,胰酶消化细胞,显微镜下观察大部分细胞变圆时终止消化,加入新鲜培养基,每隔两天更换一次新鲜的培养基。待细胞生长密度达到80%时进行消化和传代,取对数生长期的细胞进行实验。
1.3.6细胞转染和分组 将min6细胞分为si-NC组(转染si-NC)、si-NC+乙酸钠和丙酸钠组(转染si-NC,添加乙酸钠和丙酸钠)、si-GPR43组(转染si-GPR43)、si-GPR43+乙酸钠和丙酸钠组(转染si-GPR43,添加乙酸钠和丙酸钠)。按照Lipofectamine 2000说明书步骤进行转染。调整min6细胞数量并接种于6孔板,使用不含抗菌药物的完全培养基培养,使转染时细胞达70%左右生长密度。制备si-GPR43特异性si-RNA(si-GPR43)与脂质体复合物,同时制备si-RNA(si-NC)与脂质体复合物,将复合物加入6孔板相应孔内。乙酸钠和丙酸钠组的终浓度均为100 μmol/L。
1.3.7RT-qPCR检测GPR43、Bcl-2、caspase3表达水平 TRIzol试剂提取各组胰岛组织和各组min6细胞中的总RNA,酶标仪检测总RNA的纯度和含量。RT-qPCR反应体系:cDNA模板2 ng,上、下游引物各0.4 μL,SYBR Primix Ex TaqTM5 μL,ddH2O补充至10 μL。PCR反应条件:95 ℃ 30 s预变性后,变性95 ℃ 7 s,退火55 ℃ 30 s,72 ℃ 15 s,共40个循环。扩增结果根据2-ΔΔCt法计算mRNA的相对表达量。PCR引物序列:GAPDH-F为5′-CCCTTAAGAGGGATGCTGCC-3′,GAPDH-R为5′-ACTGTGCCGTTGAATTTGCC-3′;GPR43-F为5′-AATCAGAAGACAGAAAAGGAGCTG-3′,GPR43-R为5′-TCTGGGGTCATTCTCCTTGG-3′;Bcl-2-F为5′-AGCATGCGACCTCTGTTTGA-3′,Bcl-2-R为5′-GCCACACGTTTCTTGGCAAT-3′;caspase3-F为5′-GAGCTTGGAACGGTACGCTA-3′,caspase3-R为5′-CCGTACCAGAGCGAGATGAC-3′。
1.3.8Western blotting检测GPR43、AMPK、p-AMPK、Bcl-2、caspase3表达水平 收集各组胰岛组织和各组min6细胞,使用RIPA裂解提取总蛋白。样品变性后通过SDS-PAGE凝胶电泳分离等量蛋白转至PVDF膜。5%脱脂牛奶4 ℃封闭1 h,TBST洗膜5 min,3次,加入GPR43抗体(1∶1 000)、AMPK抗体(1∶1 000)、p-AMPK抗体(1∶1 000)、Bcl-2抗体(1∶1 000)、caspase3(1∶1 000),4 ℃摇床孵育过夜。TBST洗膜5 min,3次,加入HRP标记的羊抗兔的二抗(1∶1 000)37 ℃孵育1 h,TBST洗膜5次,每次5 min。显影曝光,利用Image-Pro Plus图像分析系统对蛋白条带的灰度值进行分析。
1.3.9流式细胞术检测各组细胞凋亡情况 根据试剂盒检测说明,收集4组min6细胞,采用细胞计数板计算细胞数目,选取3×105个重悬的细胞,离心弃上清,PBS洗涤1次,加入500 μL稀释的1×Annexin V Binding Buffer工作液重悬细胞。细胞悬液中加入5 μL的Annexin-V-FITC和5 μL PI染色液。轻柔涡旋混匀后,室温避光孵育20 min,采用流式细胞仪检测细胞凋亡率。
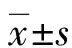
2 结 果
2.1短链脂肪酸改善小鼠T1D疾病症状 结果显示,与正常组比较,模型组小鼠体重降低,空腹血糖浓度升高,且高于13.8 mmol/L,口服葡萄糖耐量减弱,胰岛素水平降低(P<0.05),说明STZ造模成功。与模型组比较,乙酸钠治疗组和丙酸钠治疗组小鼠体重升高,空腹血糖浓度降低,口服葡萄糖耐量增加,胰岛素水平升高(P<0.05),见图1。

注:A为体重比较;B为空腹血糖比较;C为口服葡萄糖耐量比较;D为血清胰岛素比较;与正常组比较,*P<0.05;与模型组比较,#P<0.05。
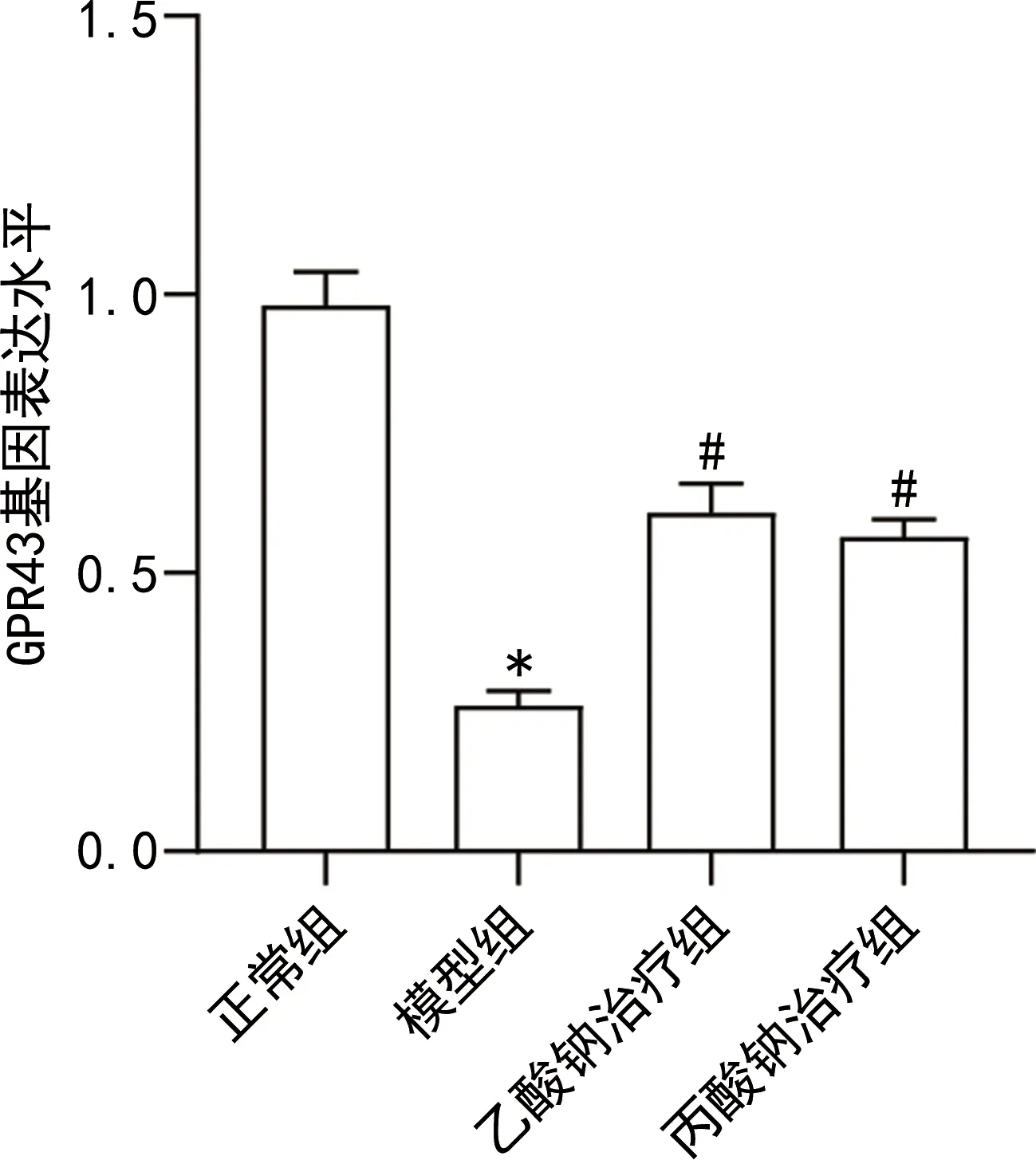
2.2短链脂肪酸激活小鼠胰岛GPR43及AMPK信号通路 RT-qPCR结果显示,与正常组比较,模型组小鼠胰岛GPR43 mRNA表达水平降低(P<0.05)。与模型组比较,乙酸钠治疗组和丙酸钠治疗组小鼠胰岛GPR43 mRNA表达水平升高(P<0.05),见图2。Western blotting结果显示,与正常组比较,模型组小鼠胰岛GPR43、p-AMPK蛋白表达水平降低(P<0.05)。与模型组比较,乙酸钠治疗组和丙酸钠治疗组小鼠胰岛GPR43、p-AMPK蛋白表达水平升高(P<0.05),见图3。
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
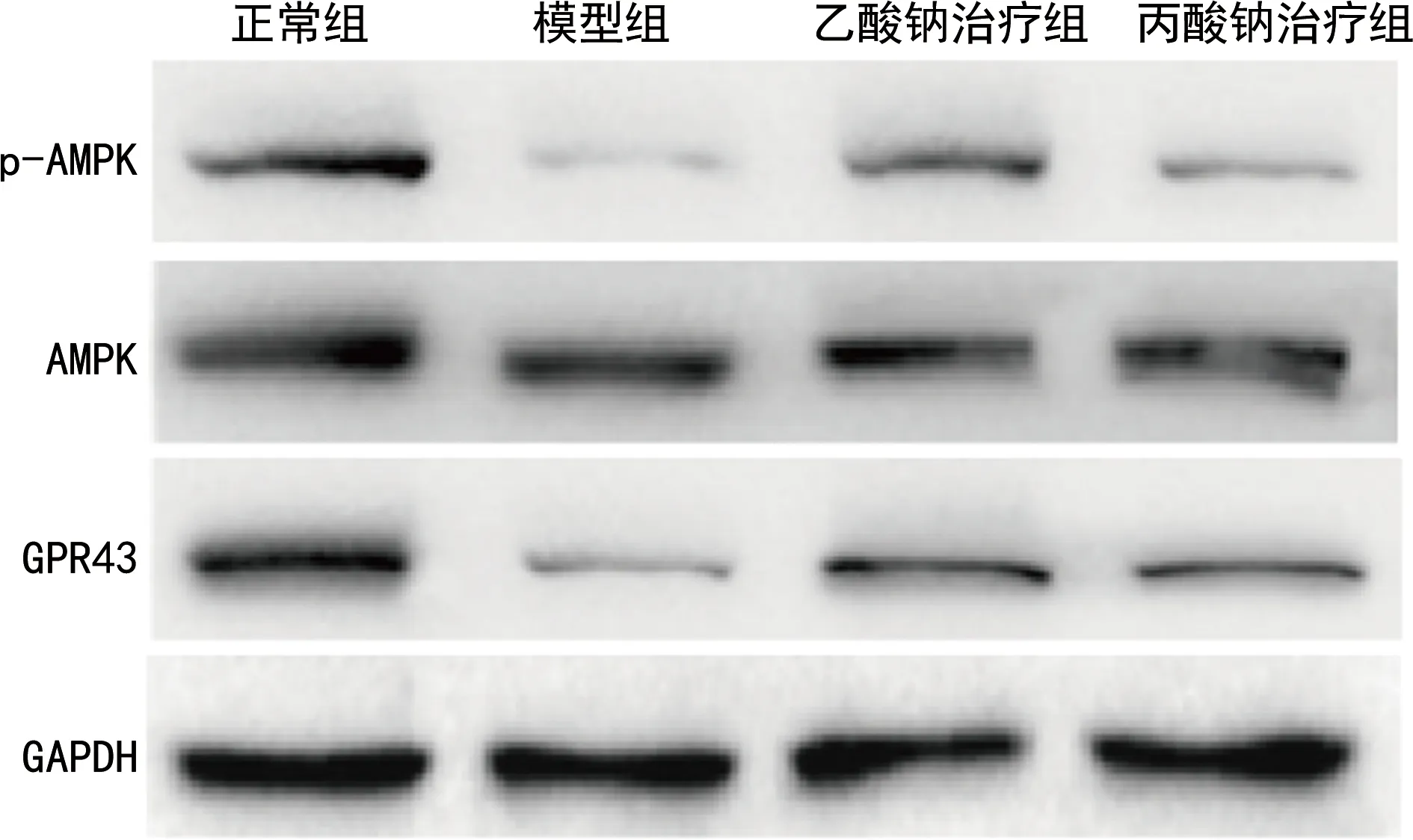
图3 短链脂肪酸促进胰岛GPR43和p-AMPK蛋白表达
2.3短链脂肪酸抑制小鼠胰岛细胞凋亡 RT-qPCR和Western blotting结果显示,与正常组比较,模型组小鼠胰岛caspase3 mRNA和蛋白表达水平升高(P<0.05),bcl-2 mRNA和蛋白表达水平降低(P<0.05)。与模型组比较,乙酸钠治疗组和丙酸钠治疗组小鼠胰岛caspase3 mRNA和蛋白表达水平降低(P<0.05),bcl-2 mRNA和蛋白表达水平升高(P<0.05),见图4、5。

注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
图5 短链脂肪酸对凋亡相关蛋白表达的影响
2.4沉默GPR43抑制AMPK信号通路 RT-qPCR结果显示,与si-NC组比较,si-GPR43组GPR43 mRNA表达水平降低(P<0.05),见图6A。Western blotting结果显示,与si-NC组比较,si-GPR43组GPR43和p-AMPK蛋白表达水平降低(P<0.05),见图6B。
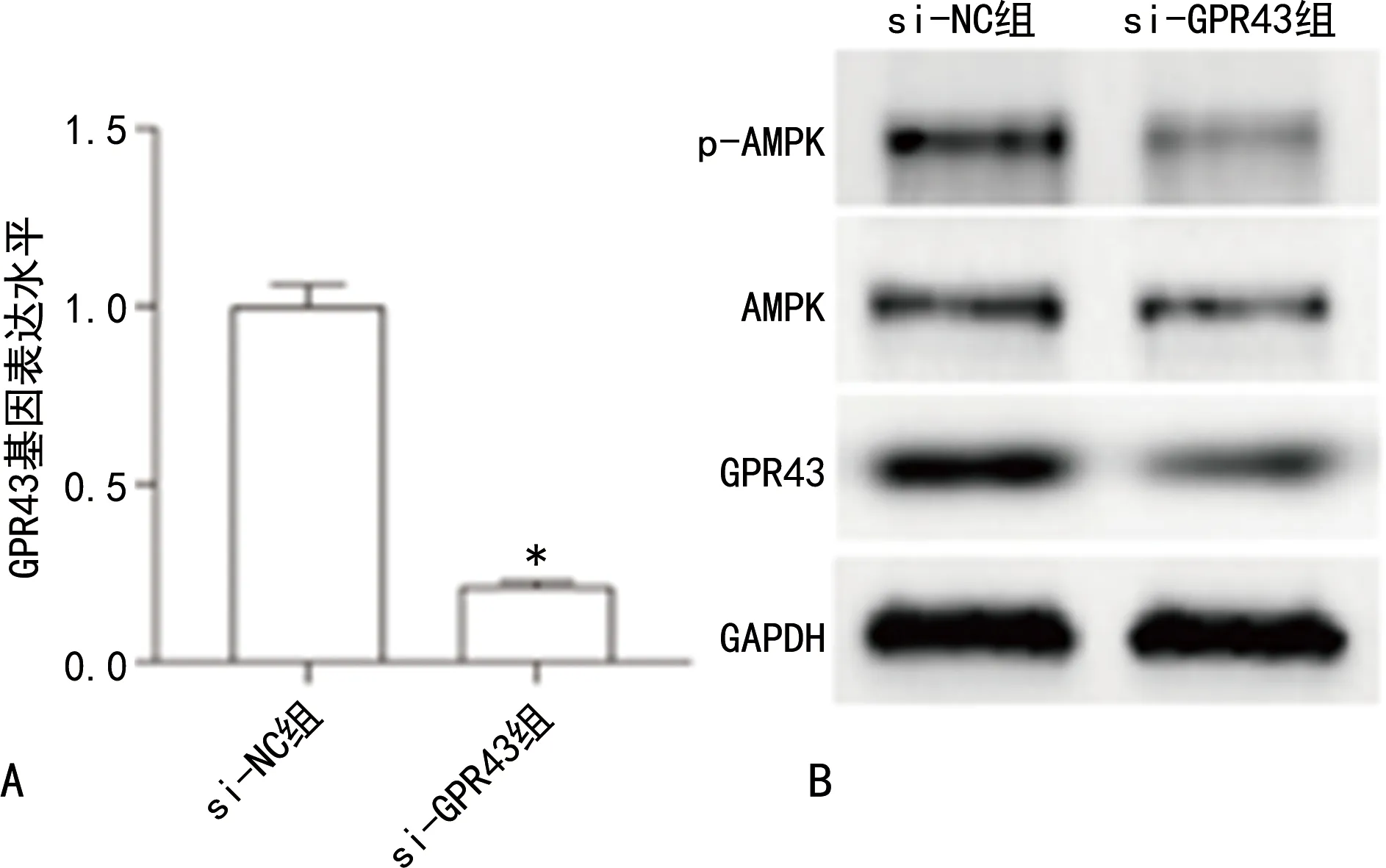
注:A为RT-qPCR检测GPR43基因表达;与si-NC组比较,*P<0.05;B为Western blotting检测GPR43、p-AMPK蛋白表达。
2.5短链脂肪酸通过GPR43抑制min6细胞凋亡 RT-qPCR和Western blotting结果显示,与si-NC组比较,si-NC+乙酸钠和丙酸钠组caspase3 mRNA和蛋白表达水平降低,bcl-2表达水平升高(P<0.05)。与si-NC组、si-NC+乙酸钠和丙酸钠组相比,si-GPR43组、si-GPR43+乙酸钠和丙酸钠组caspase3 mRNA和蛋白表达水平升高,bcl-2 mRNA和蛋白表达水平降低(P<0.05)。见图7、8。流式细胞术结果显示,与si-NC组比较,si-NC+乙酸钠和丙酸钠组细胞凋亡率降低(P<0.05)。与si-NC组、si-NC+乙酸钠和丙酸钠组相比,si-GPR43组、si-GPR43+乙酸钠和丙酸钠组细胞凋亡率升高(P<0.05)。见图9。
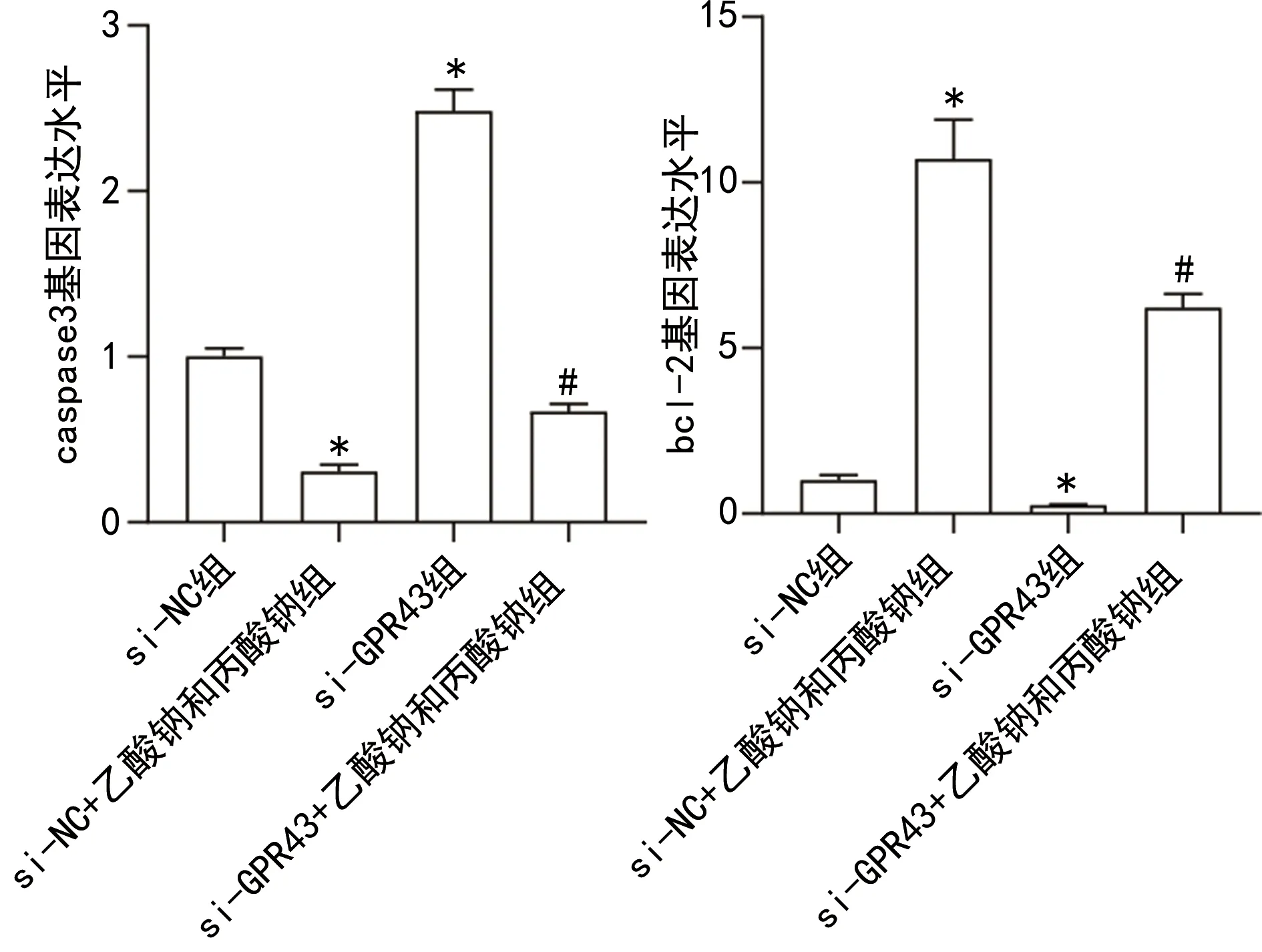
注:与si-NC组比较,*P<0.05;与si-NC+乙酸钠和丙酸钠组比较,#P<0.05。

图8 沉默GPR43拮抗短链脂肪酸对细胞凋亡相关蛋白的抑制作用
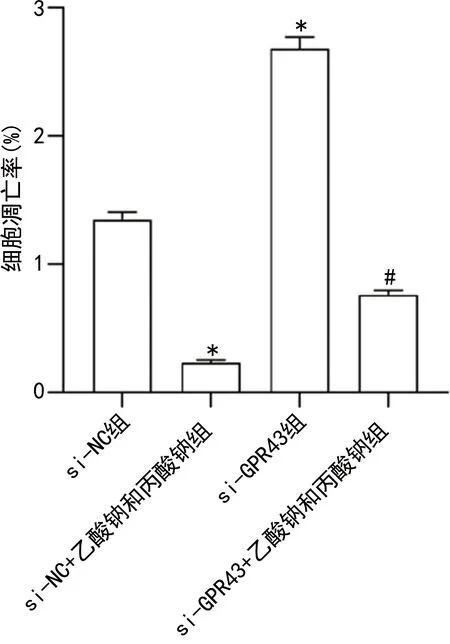
注:与si-NC组比较,*P<0.05;与si-NC+乙酸钠和丙酸钠组比较,#P<0.05。
3 讨 论
一项流行病学研究表明,全球T1D发病率正以每年3%~4%的速度增加,尤其是在年幼的儿童中[11]。尽管胰岛素输送治疗和血糖监测方法有所改进,但绝大多数T1D患者血糖并未达到理想的控制水平。
短链脂肪酸是将膳食纤维与肠道健康联系起来的关键代谢物。短链脂肪酸在促进健康方面发挥着重要作用,MIYAMOTO等[12]发现短链脂肪酸可以调节血压,有益于心血管系统。另外有研究发现,乙酸盐通过分泌胰高血糖素样肽1和肽YY等肠道激素对宿主能量和底物代谢产生有益影响,如增加能量消耗和脂肪氧化、调节体重和葡萄糖稳态等[13]。本研究通过腹腔注射STZ诱导小鼠T1D模型,然后给予乙酸钠和丙酸钠灌胃治疗,结果发现乙酸钠和丙酸钠治疗显著升高了小鼠体重、口服葡萄糖耐量和胰岛素水平,降低了空腹血糖浓度,表明短链脂肪酸口服治疗可以改善小鼠T1D疾病症状。
一般来说,短链脂肪酸可通过多种不同的方式进入细胞发挥作用,第1种是被动扩散,第2种是通过载体介导的转运,第3种是激活G蛋白偶联细胞表面受体。GPR43作为G蛋白偶联受体的一种,可以结合短链脂肪酸协助其进入细胞,根据吸收部位的不同,分散到骨骼肌、肝脏、脂肪组织等外周组织中发挥作用[14]。最近的研究发现,人体摄入的膳食纤维可能会通过短链脂肪酸介导的GPR43和GPR109A作用来预防糖尿病肾病[15]。另外有研究表明,短链脂肪酸介导的GPR43激活可以抑制脂肪细胞中的胰岛素信号传导,从而抑制脂肪组织中的脂肪堆积,并促进其他组织中的脂质和葡萄糖代谢水平[16]。在本研究中,乙酸钠治疗组和丙酸钠治疗组小鼠胰岛GPR43 mRNA和蛋白表达水平升高,提示短链脂肪酸发挥作用可能是通过激活GPR43实现的。
T1D作为一种自身免疫性疾病,胰岛β细胞的增殖与凋亡的相对比例失调可导致胰岛β细胞自身抗原的产生,导致促炎细胞因子、趋化因子、活性氧中间体和其他促凋亡刺激物浓度增加,从而诱导胰岛β细胞凋亡[17]。HU等[18]采用乙酸盐和丁酸盐两种短链脂肪酸均能防止STZ诱导的min6细胞凋亡、活力降低、线粒体功能障碍,表明短链脂肪酸在维持胰岛β细胞代谢和促进胰岛β细胞在应激条件下的存活等方面发挥着重要作用。PINGITORE等[19]研究发现,结肠递送丙酸盐可以改善胰岛β细胞的胰岛素分泌,可通过抑制细胞凋亡来增强葡萄糖刺激的胰岛素释放和维持胰岛β细胞的功能。AMPK在细胞内许多生理和病理过程的调节中发挥重要作用,也被认为是治疗糖尿病和其他代谢疾病的重要靶点,AMPK是一种异源三聚体蛋白,由一个催化α亚基和两个调节亚基β和γ组成[20]。研究表明,调节AMPK活性可以诱导或抑制细胞凋亡[21]。在本研究中,通过检测凋亡相关蛋白caspase3和bcl-2的mRNA和蛋白表达,发现乙酸钠治疗组和丙酸钠治疗组小鼠胰岛细胞凋亡率降低,p-AMPK蛋白表达水平升高,以上结果表明短链脂肪酸通过激活AMPK信号通路来抑制小鼠胰岛细胞的凋亡。为了探究短链脂肪酸是否通过激活GPR43对AMPK信号通路的调节来发挥作用,本研究通过沉默GPR43抑制AMPK信号通路后,凋亡相关蛋白caspase3和bcl-2的mRNA和蛋白表达水平均升高,表明细胞的凋亡水平增加,而当使用乙酸钠和丙酸钠进行治疗后抑制了细胞的凋亡。以上结果表明短链脂肪酸通过激活GPR43,从而上调AMPK信号通路来抑制胰岛β细胞凋亡。
综上所述,本研究结果发现,短链脂肪酸口服治疗可以改善小鼠T1D疾病症状,短链脂肪酸可通过激活GPR43上调AMPK信号通路,从而抑制小鼠胰岛β细胞凋亡,缓解T1D。以上结果初步明确了短链脂肪酸在T1D治疗中的作用,提示增加短链脂肪酸的摄取可能是预防及治疗T1D的一种有价值的策略,可能为探索糖尿病的治疗提供新的思路。

