外周免疫评分对非小细胞肺癌免疫治疗疗效的影响及相关预测模型的构建*
何冠锋,林 慧,林春雨,曾 煜,宋楚歌,黄志发
1.广东医科大学附属第二医院呼吸与危重症医学科二区,广东湛江 524000;2.广东医科大学附属第二医院健康管理中心,广东湛江 524000;3.广东医科大学,广东湛江 524023
流行病学数据显示,肺癌是目前世界范围内发病率和死亡率居第一的恶性肿瘤,每年大约有180万新增病例,对人类的生命安全威胁极大,根据病理分型,其中最主要的类型就是非小细胞肺癌(NSCLC),占肺癌的85%[1-2]。该病的临床治疗手段依旧是以手术治疗为主,放射或其他靶向治疗为辅,但患者预后较差,药物使用有局限性,以及容易导致不良反应等问题还是十分严峻[3-4]。随着对肿瘤免疫研究的深入,免疫检查点抑制剂(ICI)由于疗效维持时间长、不良反应较少等优点越来越受到重视,其既可作为单一治疗药物,也可用于联合治疗[5-6]。目前,以外周免疫评分预测恶性肿瘤疗效与预后是临床预测模型研究的热点,但相关研究多局限于肿瘤原发病灶微环境的免疫评估,而外周免疫评分作为体现机体整体免疫功能的指标,在肺癌疗效中的价值有待深入研究[7]。此外,Nomogram模型是医学中常用的评估预后工具,通过整合不同预后相关变量,能够生成临床事件的单个数值概率,可满足对生物和临床整合模型需求,推动个性化医疗,以协助临床决策[8]。因此,本研究主要分析外周免疫评分预测NSCLC免疫治疗疗效的价值,并建立一个可以准确评估疗效的Nomogram模型,为临床防治提供参考依据。
1 资料与方法
1.1一般资料 选取2018年3月至2021年9月于该院接受免疫治疗的190例NSCLC患者作为研究对象,其中男114例、女76例,平均年龄(63.83±6.62)岁。纳入标准:(1)符合《中华医学会肺癌临床诊疗指南(2018版)》[9]中NSCLC的诊断标准;(2)血常规和心、肺、肝、肾功能检查均正常,可耐受免疫治疗;(3)未接受其他抗肿瘤治疗;(4)年龄>18岁;(5)临床资料完整。排除标准:(1)治疗依从性较差者;(2)合并有免疫性疾病者;(3)合并有传染性疾病者;(4)存在不可测量的病灶者;(5)缺乏疾病病理学诊断结果者。本研究经本院伦理委员会批准,所有患者及家属知情同意。
1.2方法
1.2.1临床资料 收集仔细询问并记录患者的临床资料,包括年龄、性别、体重指数(BMI)、吸烟、骨转移、TNM分期、分化程度、病理类型、病程、外周免疫评分、中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)。
1.2.2免疫治疗 所有患者均接受免疫治疗,静脉滴注信迪利单抗,200毫克/次,滴注时间30~60 min,每周治疗1次为1个疗程,治疗2个疗程后评价疗效。
1.2.3外周免疫评分标准 根据外周免疫评分系统相关标准[11],将患者分为免疫正常组(135例)、免疫低下组(25例)、免疫亢进组(30例)。
1.2.4免疫治疗效果评价 按照实体肿瘤疗效评价标准(RECIST)1.1[10]分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),计算总有效率:缓解率(RR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。根据临床疗效将CR、PR、SD患者作为有效组,PD患者作为无效组。
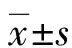
2 结 果
2.1免疫正常组、免疫低下组及亢进临床疗效比较 与免疫低下组及免疫亢进组相比,免疫正常组总有效率及疾病控制率均较高(P<0.05)。见表1。
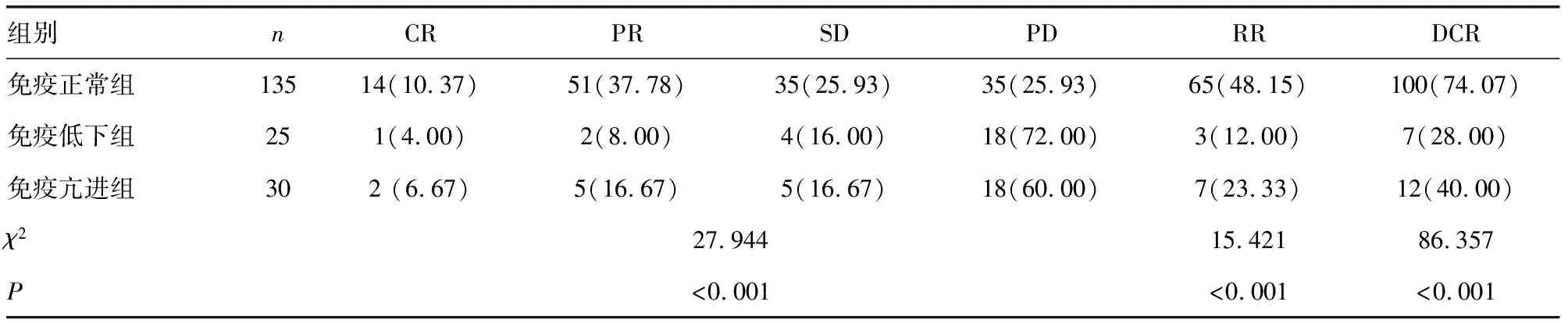
表1 两组临床疗效比较[n(%)]
2.2有效组和无效组患者一般资料比较 根据临床疗效,将190例患者分为有效组(128例)和无效组(62例)。两组患者年龄、性别、BMI、分化程度、病理类型、病程等一般资料比较差异均无统计学意义(P>0.05);与无效组相比,有效组吸烟、骨转移、TNM分期处于Ⅲ~Ⅳ期及免疫外周评分(>0或<0分)比例,以及NLR、PLR较低,差异均有统计学意义(P<0.05)。见表2。
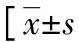
表2 两组一般资料比较或n(%)]
2.3ROC曲线分析 NLR、PLR预测免疫治疗疗效的AUC分别为0.662、0.721,cut-off值分别为4.23、195.67。见图1、表3。
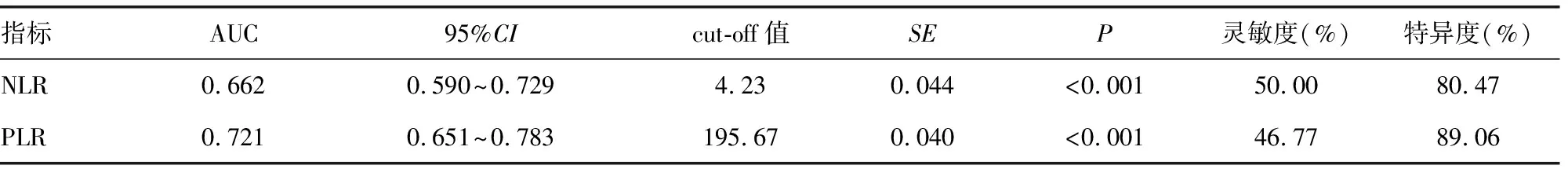
表3 ROC曲线分析结果
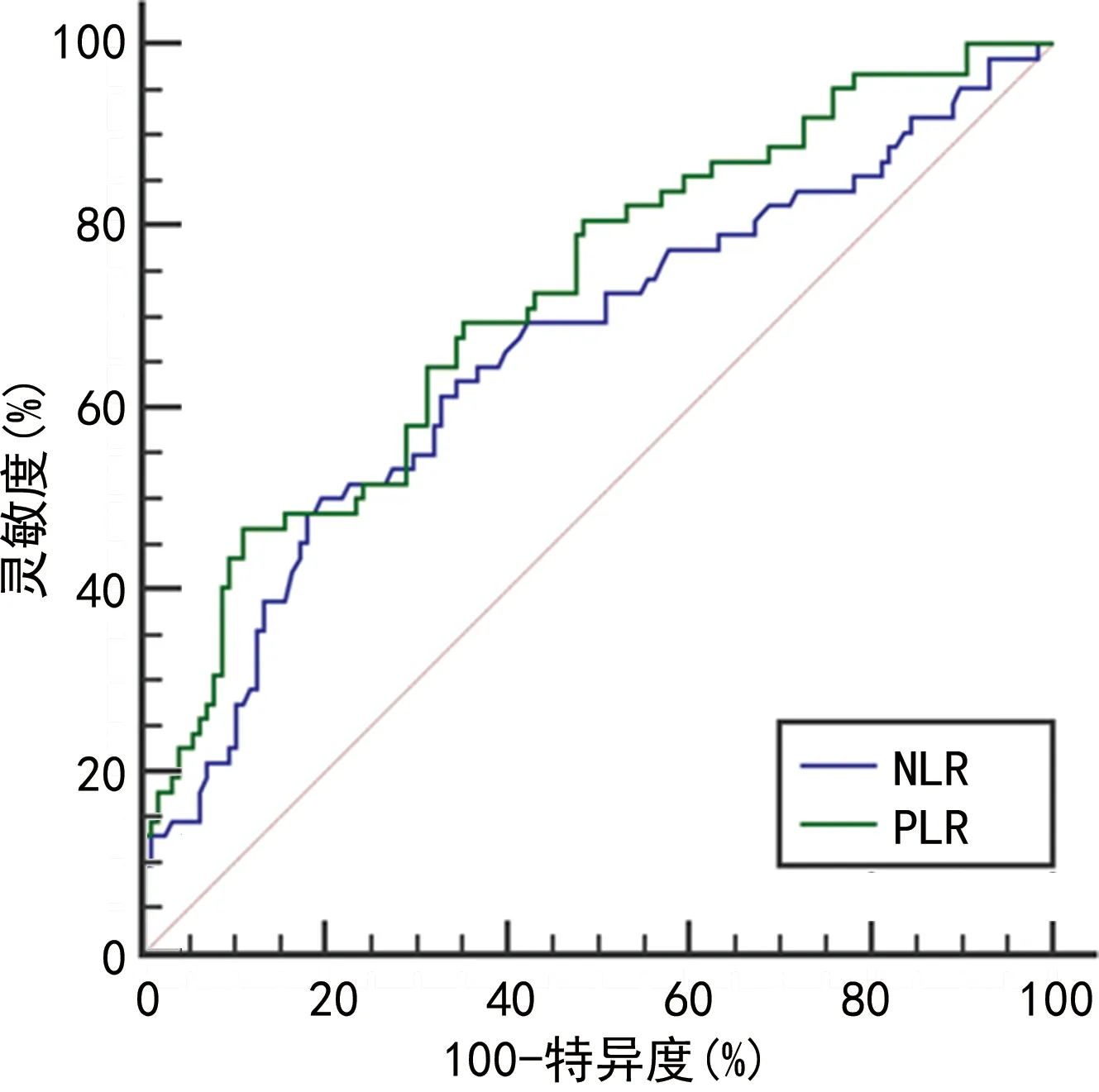
图1 ROC曲线分析
2.4Logistic回归分析 将吸烟、骨转移、TNM分期、外周免疫评分、NLR、PLR纳入回归分析,吸烟(是)、骨转移(是)、TNM分期(Ⅲ~Ⅳ期)、外周免疫评分(>0或<0分)、NLR(>4.23)、PLR(>195.67)是免疫治疗疗效的影响因素(P<0.05)。见表4。
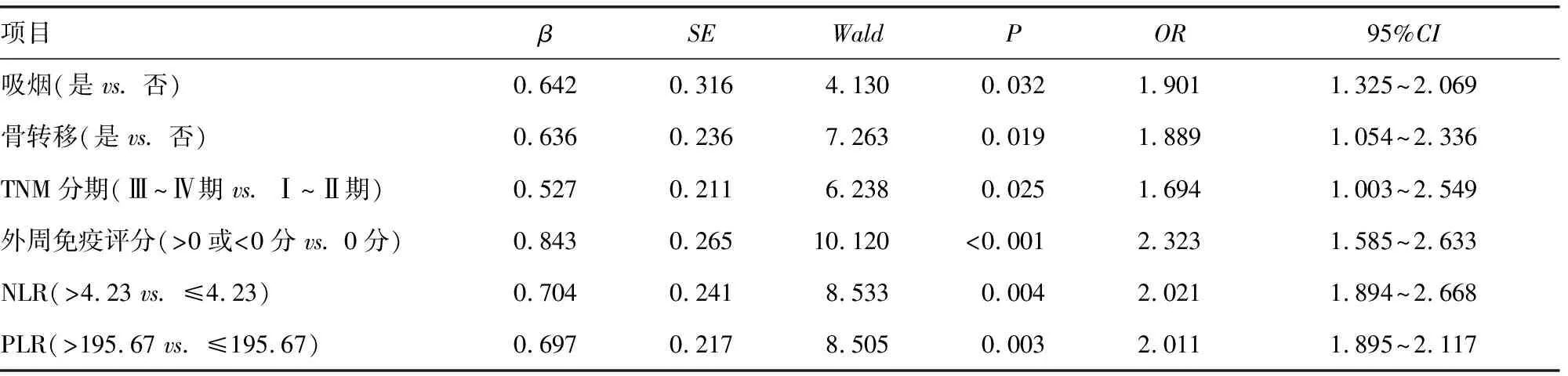
表4 免疫治疗疗效的影响因素分析
2.5预测疗效的Nomogram模型 吸烟、骨转移、TNM分期、外周免疫评分、NLR、PLR均为构建Nomogram模型的预测因子。见图2。

图2 免疫治疗疗效的列线图预测模型
2.6Nomogram模型校准曲线及DCA分析 内部验证结果显示,Nomogram模型预测患者治疗疗效的风险C-index为0.727(95%CI:0.684~0.810)。校准曲线显示,观测值与预测值之间保持较好一致性。见图3。DCA结果显示,Nomogram模型预测患者治疗疗效的风险阈值>0.07,Nomogram模型提供临床净收益。此外,Nomogram模型临床净收益均高于吸烟、骨转移、TNM分期、外周免疫评分、NLR、PLR。见图4。
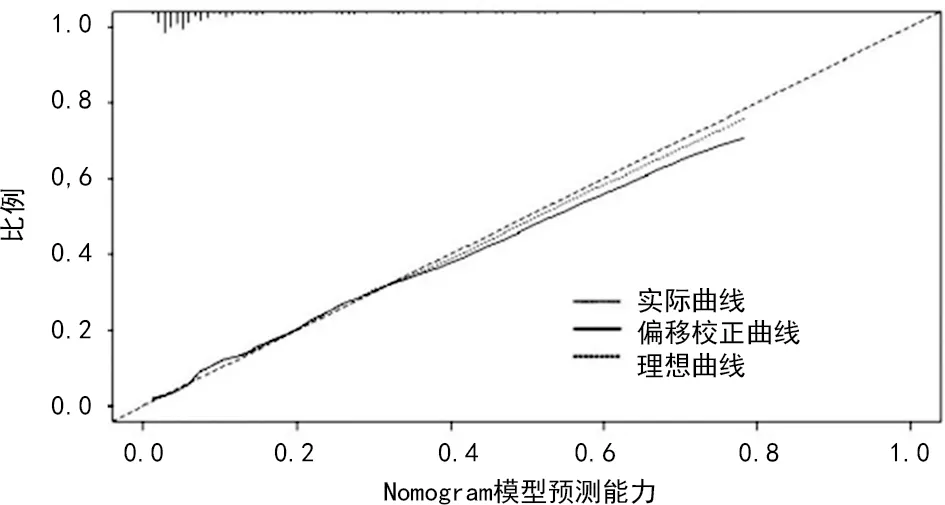
图3 免疫治疗疗效的列线图模型预测能力分析
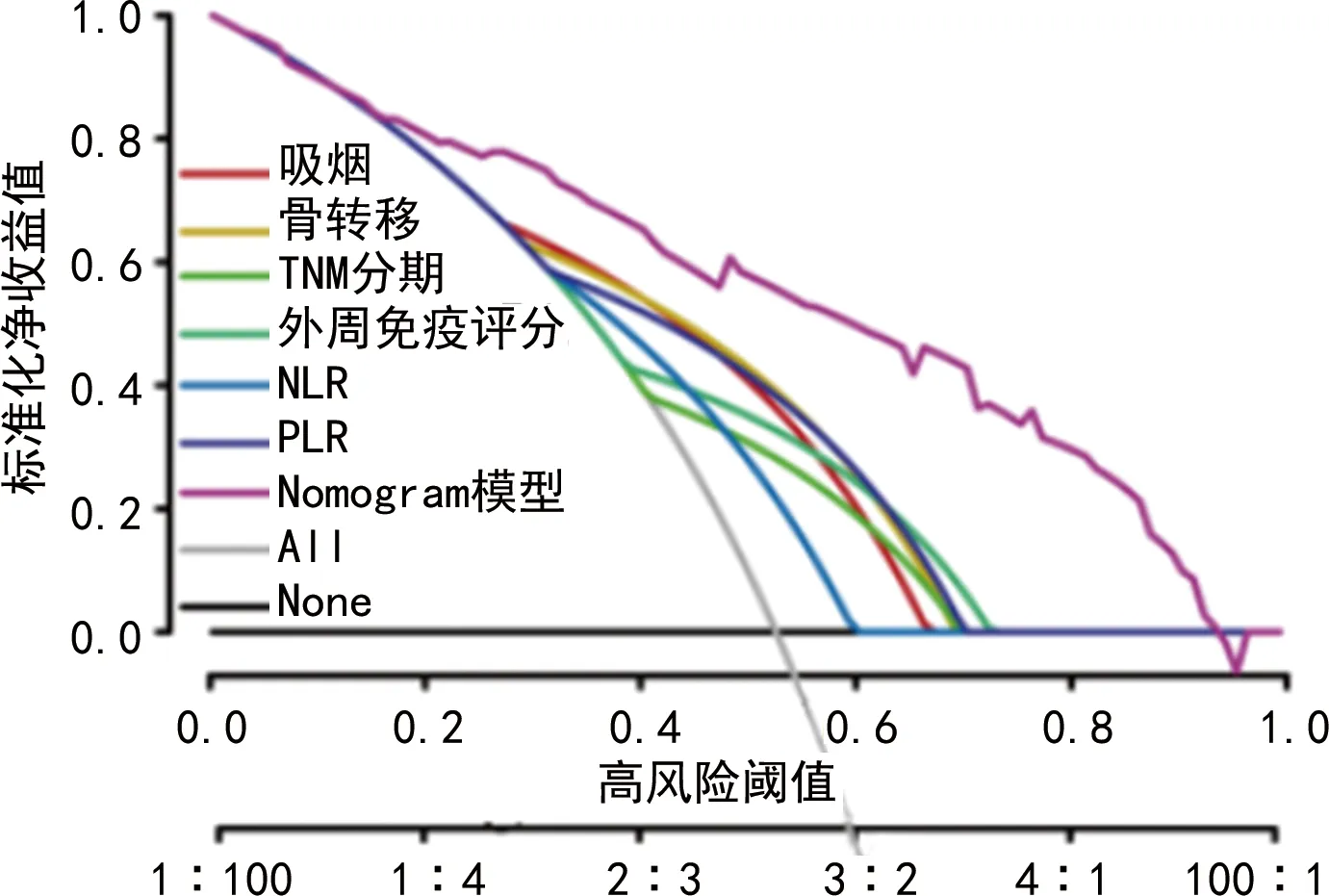
图4 列线图模型及各预测因子决策曲线分析
3 讨 论
目前在国际范围内,肺癌依旧是癌症患者死亡的主要原因,其中以NSCLC最为显著[12]。大多NSCLC患者在确诊时已属于疾病晚期,即使是接受根治性手术治疗,效果也并不理想。目前,免疫治疗作为新的治疗方法,在各种类型肿瘤治疗中疗效较好;其中,信迪利单抗属于PD-1免疫治疗药物,对复发或者难治的霍奇金淋巴瘤疗效显著,且可用于肺癌治疗[13]。
有研究指出,免疫细胞与NSCLC患者预后及临床分期关系密切[14]。另有研究显示,外周免疫评分可提示病灶区域的免疫微环境,并能预测患者的总生存期,对比TNM分期能更好地预测临床结局[15]。此外,Nomogram模型是肿瘤生存预测较好的临床工具。因此,本研究从外周免疫评分的角度分析其对免疫治疗疗效的影响,并建立一个可以预测患者免疫治疗疗效的模型。本研究结果显示,免疫正常组总有效率及疾病控制率均较免疫低下组及免疫亢进组升高(P<0.05)。这与罗添乐等[11]研究有一定的相同之处,该研究提到外周免疫评分可客观反映患者的生存时间,是肿瘤患者“正虚”及预后的评估指标。本研究结果还显示,与无效组比较,有效组吸烟、骨转移、TNM分期处于Ⅲ~Ⅳ期及免疫外周评分>0或<0分者较少,NLR和PLR水平较低,这提示以上变量与患者临床疗效有一定的相关性。有研究显示,吸烟者基因突变发生率更高,无进展生存期更长,会使肺鳞癌患者存在体细胞高频突变,对其预后有一定的影响[16]。还有研究表明,在临床上分期越晚,患者预后越差[17],所以TNM分期可能是NSCLC患者预后的参考因素;但也有研究认为TNM分期与其并没有相关性[18]。本研究单因素分析及ROC曲线分析结果显示,NLR、PLR均具有预测价值。赵之标等[19]指出,NLR和PLR可反映全身炎症反应的水平,与肿瘤导致的细胞破坏有密切联系,在NSCLC的免疫领域中占据主导地位,并认为NLR和PLR与患者免疫治疗疗效息息相关,是预测其疗效和预后的理想指标。王婷等[20]还认为,骨转移在骨髓微环境中,会使患者免疫反应降低,从而产生一部分有效的毒性细胞和大量未成熟和抑制的免疫细胞,骨转移的患者会有ICI耐药的倾向,所以其可以较好地预测ICI的疗效。本研究中,Logistic回归分析结果显示,吸烟(是)、骨转移(是)、TNM分期(Ⅲ~Ⅳ期)、外周免疫评分(>0或<0分)、NLR(>4.23)、PLR(>195.67)均是影响免疫治疗疗效的影响因素,这与以上研究结果也基本一致,也与孙静玮等[21]提出的“免疫正常化”概念相契合。
本研究将影响变量纳入Nomogram模型,内部验证结果显示,Nomogram模型预测患者治疗疗效的风险C-index为0.727(95%CI:0.684~0.810)。校准曲线显示,观测值与预测值保持较好一致性。DCA结果显示,Nomogram模型预测患者治疗疗效的风险阈值>0.07,临床净收益均高于吸烟、骨转移、TNM分期、外周免疫评分、NLR、PLR,这说明构建的模型具有较好的预测价值。有研究认为,年龄和性别也可能是影响患者疗效的因素[22],但该结果还存在一定争议,本研究在单因素分析中并未发现其有统计学意义。
综上所述,吸烟、骨转移、TNM分期、外周免疫评分、NLR、PLR是免疫治疗疗效的影响因素,且基于以上变量构建的Nomogram模型可用于患者治疗疗效预测。然而,本研究采用的是内部数据验证,在结论的广泛适用性上或许存在一定限制。

