血清miR-130a预测Her2阳性转移性乳腺癌患者化疗心脏毒性的临床价值
齐幸愉,马 超,齐永婧
河北中医学院第二附属医院/河北省第七人民医院肿瘤科,河北定州 073000
人表皮生长因子受体2阳性(Her2+)乳腺癌占所有乳腺癌亚型的20%~25%[1-2]。目前,Her2+转移性乳腺癌治疗主要是化疗结合Her2的靶向治疗。曲妥珠单抗2002年以来已被公认为Her2+乳腺癌的标准治疗药物,其可以明显改善患者的生存及预后,但在治疗过程中产生的心脏毒性仍然较为常见[3-4]。在临床实践中,确定接受曲妥珠单抗治疗的患者是否存在早期亚临床心功能不全至关重要。然而,目前可帮助预测化疗引起的早期亚临床心脏改变的可靠生物标志物较少。微小RNA(miRNA)作为一类小的非编码RNA分子,在RNA沉默和基因表达的转录后调节中发挥作用,可参与多种疾病的病理过程[5]。有研究证实,miR-130a在乳腺癌中异常表达[6];蛋白质组学分析表明,miR-130a的分子靶点与纤维化心脏表型相关[7]。因此,miR-130a可能作为心脏纤维化的生物标志物和潜在的治疗靶点。基于此,本研究分析血清miR-130a是否可作为预测Her2+转移性乳腺癌曲妥珠单抗化疗所致心脏毒性的潜在生物标志物。
1 资料与方法
1.1一般资料 2019年7月至2021年9月,连续纳入该院168例Her2+ 转移性乳腺癌患者,年龄29~84岁,中位年龄56岁,其中远处转移(淋巴结)102例(60.71%)。所有受试者均通过书面知情同意书。该研究得到本院伦理审查委员会的批准(审批号:2014-1136)。纳入标准:(1)年龄≥18 年;(2)不能进行根治性切除的转移性乳腺癌,根据世界卫生组织(WHO)分类,由两位病理学家独立确诊为局部浸润性乳腺癌(T2~4期或N1~3期),以免疫组化染色(3+)或根据原发肿瘤和(或)转移部位的局部评估通过原位杂交证实为Her2+;(3)根据实体瘤疗效评价标准(RECIST)1.1版[8],所有患者至少有一个可测量的病变和(或)不可测量的疾病可评估,且计划行紫杉醇+曲妥珠单抗辅助化疗;(4)中枢神经系统转移患者如果接受无抗Her2的局部治疗后至少稳定3个月;(5)东部肿瘤合作组(ECOG)评分≤2分,预期寿命≥12 周,左室射血分数(LVEF)≥50%;(6)之前未接受过全身治疗或抗Her2靶向治疗。排除标准:(1)存在心功能不全、缺血性心脏病、瓣膜性心脏病、严重肾功能不全或肝功能不全患者;(2)已知的对曲妥珠单抗治疗不耐受患者。
1.2方法
1.2.1治疗方法 所有患者接受每周80 mg/m2的紫杉醇(wPAC)联合曲妥珠单抗(负荷剂量为4 mg/kg,然后维持剂量为2 mg/kg)方案。治疗6个周期后,服用曲妥珠单抗6 mg/kg,每3周1次,直至因肿瘤进展或其他原因停药。在曲妥珠单抗治疗的第1年对患者进行研究,自联合化疗6个周期开始,每3个月通过计算机断层扫描进行影像性肿瘤评估。采用超声心动图来测量局部病变(乳腺、胸壁和皮肤)和区域淋巴结转移。
1.2.2疗效评估 根据RECIST v1.1标准评估化疗疗效。总有效率(ORR)定义为患者达到完全缓解(CR)和部分缓解(PR)的比例。临床受益率(CBR)定义为CR、PR和病情稳定(SD)持续时间超过6个月的患者比例。治疗失败时间(TTF)定义为从紫杉醇治疗开始到疾病进展或因不良事件停止治疗的时间间隔,用作紫杉醇疗效的替代指标。
1.2.3血清miR-130a水平检测 治疗开始后,对所有患者进行为期15个月的强化定期随访。于治疗前(基线)采集外周血,用肝素进行预处理,离心获得血清,并通过实时荧光定量PCR(RT-qPCR)检测血清miR-130a相对表达水平。使用QIAamp RNA血液Mini试剂盒(德国Qiagen)从新鲜血清中提取总RNA。采用紫外分光光度法检测RNA浓度,琼脂糖凝胶电泳检测RNA的纯度等。取RNA(2 μg)通过M-MuLV逆转录酶(美国Promega)逆转录为cDNA。血清miR-130a的相对表达通过Power SYBR Green PCR Master Mix kit(美国Applied Biosystems公司)进行定量。以U6为miR-130a的内参。引物均由上海通用生物技术有限公司生产。以miR-130a相对表达水平的中值为分界点,将患者分为高表达组和低表达组。
1.3随访 所有患者均需在基线检查时及此后每3个月测量1次LVEF。主要终点是曲妥珠单抗诱导的心脏毒性(TIC)发生。TIC定义:在任何计划的随访时间点LVEF<45%,或者较基线值相对下降≥10%[9-10]和(或)患者住院治疗过程中发生任何心脏事件,包括心房颤动、不稳定心绞痛、急性冠状动脉综合征和症状性心力衰竭。本研究中只有1例患者发生心房颤动,因此没有进一步针对心脏毒性的严重程度进行分层。根据不良事件通用术语标准(CTCAE)4.0对其他不良事件进行分级。
1.4统计学处理 采用SPSS19.0统计软件进行数据处理,不服从正态分布的计量资料以M(P25,P75)描述,采用非参数检验;计数资料以例数或率表示,采用χ2检验。绘制受试者工作特征(ROC)曲线分析血清miR-130a预测乳腺癌患者化疗发生心脏毒性价值。采用单因素及多因素Logistic回归模型分析影响乳腺癌患者化疗发生心脏毒性的临床因素。绘制Kaplan-Meier生存曲线对中位生存时间进行Log-rankχ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1基线血清miR-130a与临床病理特征的关系 乳腺癌患者基线血清miR-130a水平为1.96(1.19,2.96)。根据乳腺癌患者基线血清miR-130a水平中位值(1.96),将血清miR-130a水平≤1.96的患者纳入低水平组(n=84),miR-130a水平>1.96的患者纳入高水平组(n=84)。经分析,基线血清miR-130a水平与N分期、LVEF相关。见表1。
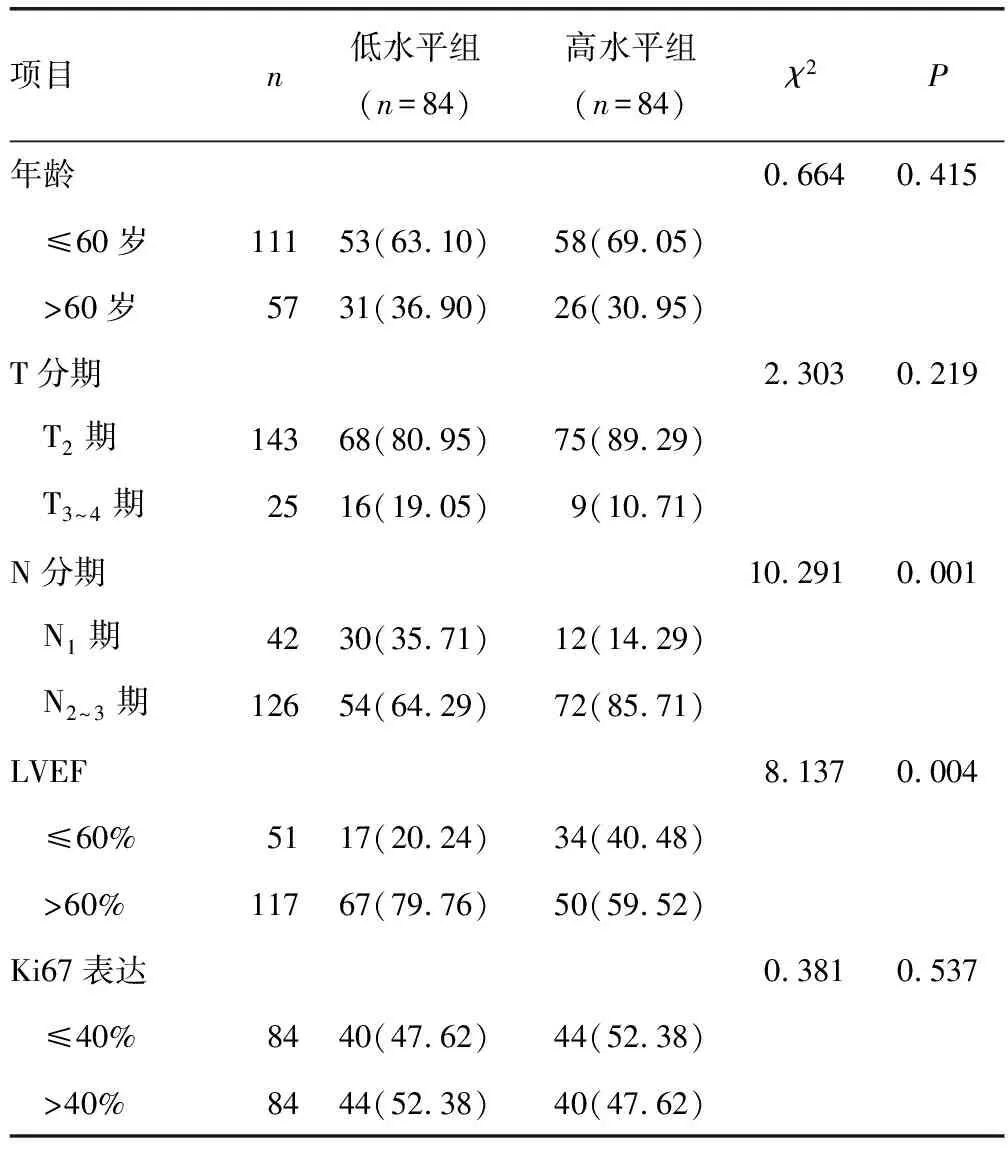
表1 血清miR-130a水平与临床病理特征的关系[n(%)]
2.2血清miR-130a水平与临床疗效的关系 168例患者平均随访时间为11.8个月。血清miR-130a低水平组与高水平组的ORR分别为38.10%和39.29%,CBR分别为80.95%和78.57%,差异均无统计学意义(P>0.05)。Kaplan-Meier生存曲线分析显示,血清miR-130a高水平组患者TTF明显短于低水平组[6.75(3.85,10.50)个月vs.9.30(3.60,16.35)个月],差异有统计学意义(P<0.001)。
2.3血清miR-130a水平与化疗不良反应的关系 随访期间,79例(47.02%)患者发生心脏毒性,26例LVEF<45%,53例LVEF较基线值降低≥10%。基线血清miR-130a表达升高与随访期间出现心脏毒性相关(P=0.001),与其他不良反应无显著相关性(P>0.05)。见表2。

表2 基线血清水平与化疗不良反应的关系[n(%)]
2.4基线血清miR-130a水平对心脏毒性的预测价值 心脏毒性组患者基线血清miR-130a水平显著高于非心脏毒性组[1.52(0.96,2.06)vs.2.39(1.67,3.50),P<0.001]。ROC曲线分析显示,基线血清miR-130a水平预测乳腺癌患者化疗发生心脏毒性的曲线下面积(AUC)为0.733(95%CI:0.657~0.809)。见图1。
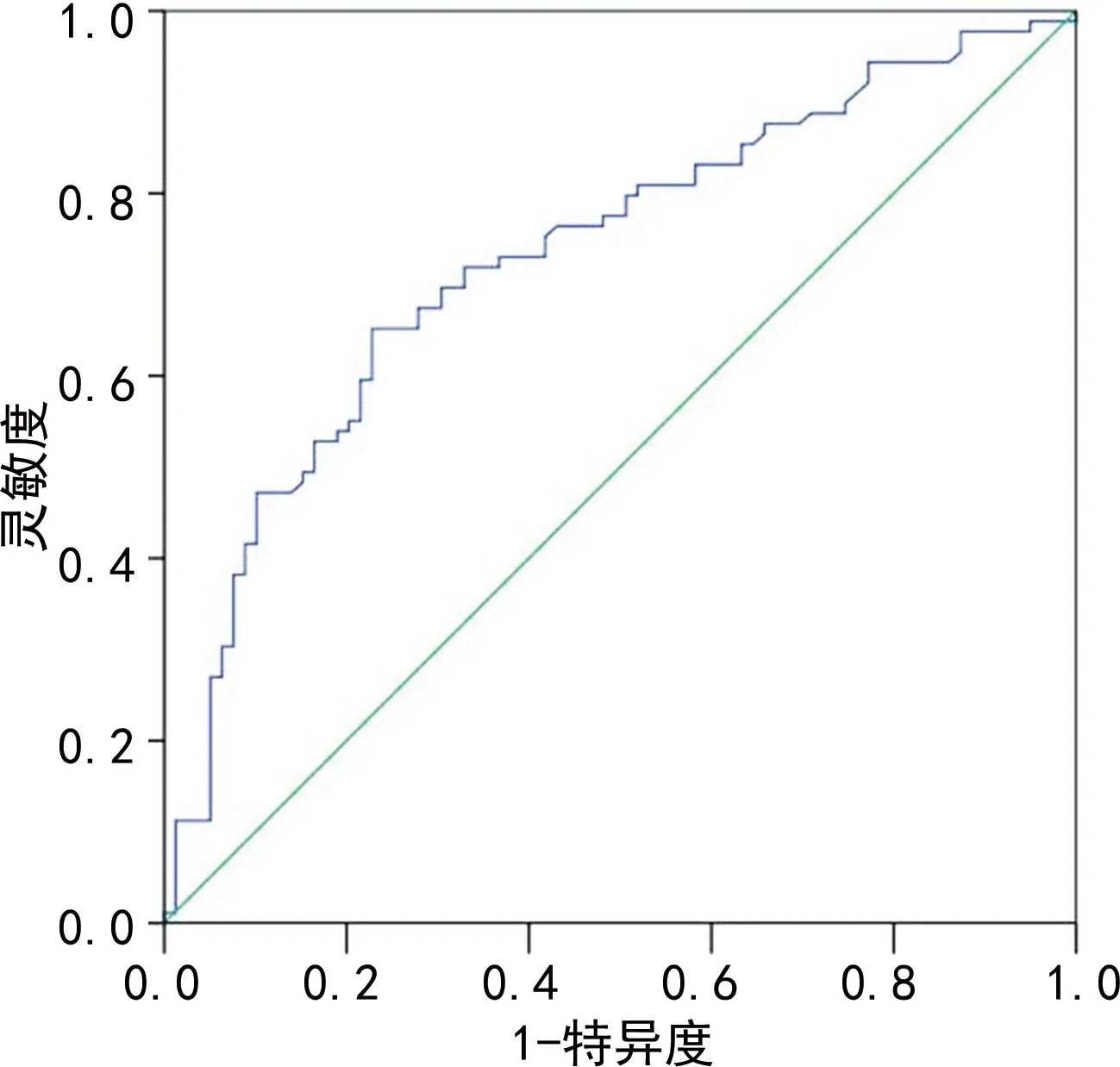
图1 血清miR-130a水平预测乳腺癌患者化疗发生心脏毒性的ROC曲线
2.5单因素和多因素Logistic回归分析影响乳腺癌患者化疗心脏毒性的临床因素 经单因素及多因素Logistic回归分析发现,发生肝转移、化疗相对剂量强度>70%、基线血清miR-130a水平>1.96均是乳腺癌患者化疗心脏毒性的独立危险因素(P<0.05)。见表3。
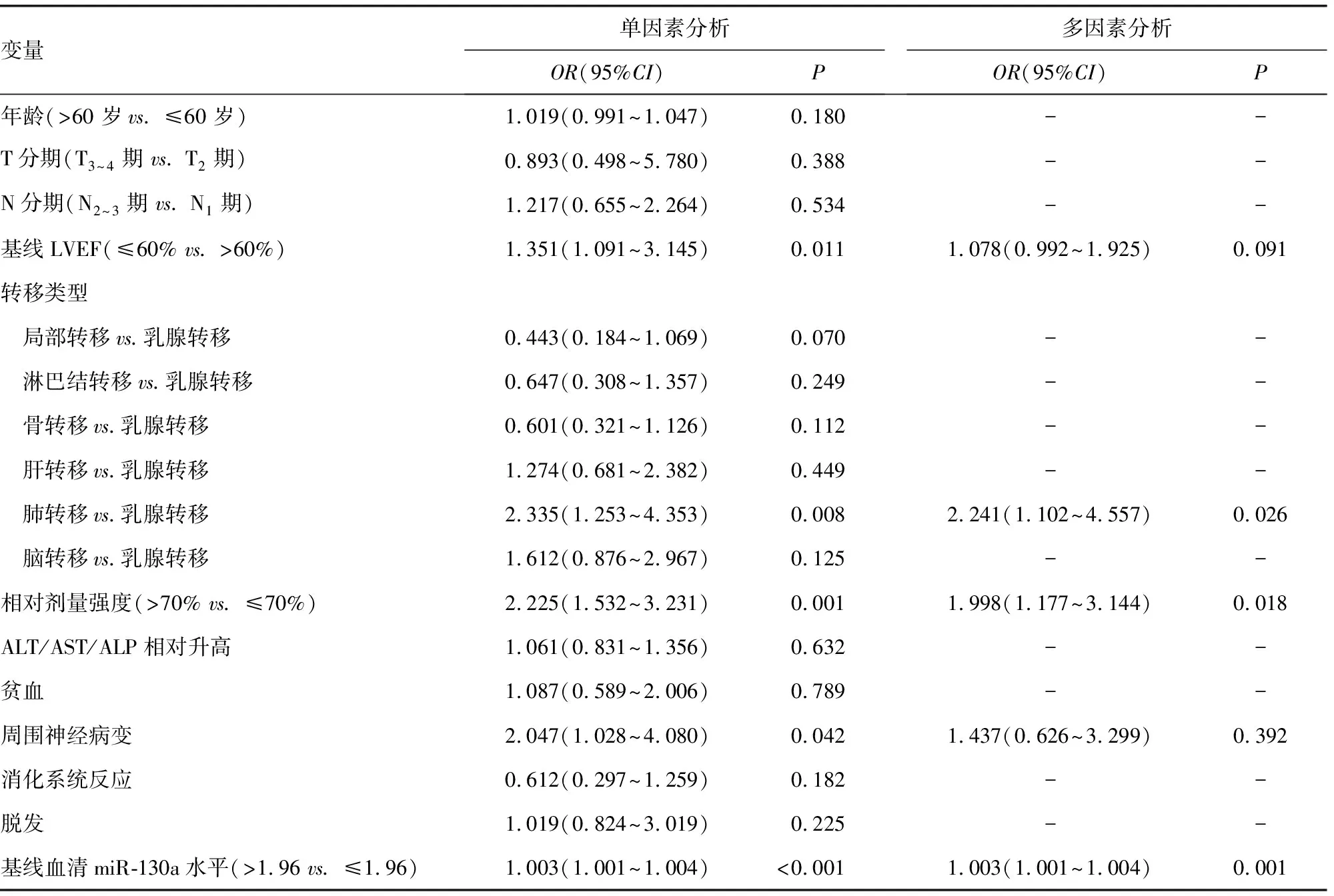
表3 单因素和多因素Logistic回归分析影响乳腺癌患者化疗心脏毒性的临床因素
3 讨 论
15%~20%的乳腺癌患者肿瘤组织Her2表达阳性,这与侵袭性临床表型、高转移率和不良预后相关[10-11]。曲妥珠单抗被认为是用于治疗Her2+乳腺癌最重要的靶向制剂,可显著提高转移性Her2+乳腺癌患者的生存率[12],然而心脏毒性一直是临床关注的焦点[13],在本研究报道了血清miR-130a水平升高与心脏毒性的关系。在曲妥珠单抗治疗的第1年,血清miR-130a水平升高与心脏毒性的发生风险有关。与左心室功能保持不变的患者相比,发生心脏毒性的患者基线血清miR-130a水平显著升高,而且基线miR-130a对于亚临床心功能不全有一定的预测效能。
研究表明,肿瘤可以将miRNA释放到循环中,血清中的miRNA以非常稳定的形式存在,不受内源性RNase活性的影响[14]。因此,某些具有癌症、组织或器官特异性功能的miRNA可能对乳腺癌患者产生内分泌、旁分泌或自分泌效应,直接或间接调节他们对化疗的反应[15]。本研究结果显示,高水平的血清miR-130a与较短的TTF相关,这可能归因于曲妥珠单抗耐药性。目前研究显示,有两条重要途径可能导致曲妥珠单抗耐药性[16-17]:首先,磷酸酶和张力同系物(PTEN)的激活预示着曲妥珠单抗的抑制作用,而通过PTEN缺失和PIK3CA突变激活PI3K通路则赋予乳腺癌曲妥珠单抗耐药性;其次,PTEN缺失导致SRC过度激活,SRC抑制似乎克服了曲妥珠单抗耐药性。据报道,miR-130a通过PTEN/Akt途径促进乳腺癌患者对阿霉素或三苯氧胺的耐药性[18]。因此,miR-130a也可能通过调节PTEN/PI3K/Akt通路和SRC的表达诱导曲妥珠单抗耐药性,这些分子机制进一步解释了miR-130a高表达与曲妥珠单抗临床疗效不良的关系。
在我国,紫杉醇一直在转移性乳腺癌化疗中起着核心作用。例如,一项随机Ⅲ期试验比较了多西紫杉醇和紫杉醇对Her2+乳腺癌的疗效,报告称紫杉醇的客观缓解率为61.9%[19],同时有6.5%出现至少一次LVEF下降。此外,曲妥珠单抗与心脏毒性风险也密切相关,尤其是与蒽环类药物合用时。服用曲妥珠单抗与心血管不良事件风险增加相关[20]。曲妥珠单抗诱导的心脏毒性被认为是一种Ⅱ型不良药物反应,通常会导致可逆性功能障碍而无细胞丢失,临床表现为无症状的LVEF下降[21]。此外,LVEF下降经常随着药物中断而改善,待恢复后恢复曲妥珠单抗治疗通常是可行的。因此,化疗方案的心脏安全性是一个重要的考虑因素。超声心动图和心电图是心脏情况的常规检查方式,但对早期预测心肌损伤的灵敏度较低。本研究使用了与临床相关且被广泛接受的国际心脏毒性定义[LVEF下降>10%和(或)LVEF<45%],因为患者通常只有在LVEF<45%时才会开始出现心脏症状,LVEF下降>10%可能提示心力衰竭风险增加,建议使用ACE抑制剂进行治疗。本研究结果发现LVEF损害与血清miR-130a表达水平升高有关。
miR-130a可能参与心血管系统的许多生理和病理过程。在心脏毒性评估中,亚临床心功能不全的累积发生率为47.02%,而且心脏毒性患者基线血清miR-130a水平普遍高于非心脏毒性患者,这意味着在接受辅助曲妥珠单抗治疗的Her2+乳腺癌患者中,miR-130a与心脏毒性呈正相关。进一步分析证实,基线miR-130a是曲妥珠单抗诱发心脏毒性风险的独立预测因子。其可能原因是,作为靶向过氧化物酶体增殖物激活受体γ的miRNA,miR-130a可增强心肌氧化应激,增加蒽环类药物诱导的心肌细胞毒性[22]。另外,miR-130a与更高的缺氧损伤易感性、心肌细胞凋亡和心肌纤维化相关。因此,可以推测miR-130a高表达的患者心脏毒性风险更高。本研究发现,血清miR-30a表达水平较高的患者在接受曲妥珠单抗后易发生左心功能不全,该指标可用于临床监测接受曲妥珠单抗加蒽环类辅助化疗的转移性Her2+乳腺癌患者的心脏毒性风险。但需要注意一些局限性:由于这是一项临床研究,miR-130a在引起心脏损伤和促进药物诱导心脏毒性方面的作用机制需通过细胞实验来验证;关于超声心动图,LVEF的测量可能因心率、负荷情况或超声医生不同可能会存在偏差。因样本量有限,这些发现仍需大样本、多中心的研究进一步验证。
综上所述,基线血清miR-130a水平升高与Her2+转移性乳腺癌患者接受曲妥珠单抗更短的TTF及更高的心脏毒性风险相关,可作为早期亚临床心功能不全的预测因子。

