髓源树突状细胞对Ⅱ型胶原诱导关节炎小鼠CD4+CD25+Treg细胞的影响*
龚艳杰,魏 明
郑州大学第五附属医院输血科,河南郑州 450052
类风湿关节炎(RA)是一类较为多见的自身免疫性疾病,以滑膜、骨及软骨的进展性损伤为显著特点,最后能够使关节出现形状改变、硬化强直等现象,具有特别高的致残率[1-2]。实验研究表明,包括淋巴细胞、滑膜细胞、树突状细胞(DC)等免疫细胞通过分泌各种细胞因子参与RA的发病[3-4]。DC是目前已知的作用最大的专职抗原提呈细胞(APC)之一,是固有免疫及获得性免疫之间的重要纽带,其在保持人体免疫耐受和免疫应答之间的平衡中发挥重要作用[5-6]。有研究表明,当未成熟树突状细胞(imDC)低表达CD80、CD86、主要组织相容性复合体(MHCⅡ)等细胞因子时,能使特异性免疫应答的较低潜能活化[7-9];也有研究表明,imDC在克罗恩病、多发性硬化症等自身免疫性疾病的动物模型上能诱导幼稚T细胞(Tn)向调节性T细胞(Treg)分化,促进抗炎因子如白细胞介素(IL)-10、转化生长因子(TGF)-β的表达,诱导免疫耐受,抑制炎症性病变[10]。本实验通过制作Ⅱ型胶原(CⅡ)诱导关节炎(CIA)小鼠模型,利用imDC和成熟树突状细胞(mDC)对其进行干预操作,以探讨imDC对CIA的作用及其作用机制,为临床开展RA细胞治疗提供新的方案。
1 材料与方法
1.1实验动物 40只6~8周龄的雄性BALB/c小鼠饲养于郑州大学动物实验中心无特定病原体(SPF)环境内,自由进食及进水,试验操作中对动物的处理遵照动物伦理学的规则,动物许可证号:SYXK(豫)2017-0028。其中10只小鼠用于获取骨髓源单核细胞,另外30只用于制作CIA动物模型。
1.2仪器与试剂 CⅡ、完全弗氏佐剂(CFA)、冰醋酸、脂多糖(LPS)购自美国Sigma公司,重组小鼠白细胞介素(rmIL)-4和重组小鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)购自美国PeproTech公司,三氢-吲哚菁型染料标记的抗鼠CD11c单抗(FE-Cy7-anti-CD11c)、藻蓝蛋白(PE)标记的抗小鼠CD25单抗、CD86单抗(APC-anti-CD25、APC-anti-CD86)、藻红蛋白标记的抗小鼠CD80单抗(PE-anti-CD80)、异硫氰酸荧光素(FITC)标记的CD4单抗以及MHCⅡ单抗购自美国BD公司,抗IL-10、抗-TGF-β和抗β-actin 单克隆抗体购自美国Santa Cruz公司,荧光标记山羊抗兔二抗及荧光标记大鼠抗山羊二抗购自英国Abcam公司,TGF-β和IL-10 ELISA试剂盒购自德国R&D公司。FACSCalibur流式细胞仪购自美国BD公司,倒置相差显微镜IX71型购自日本Olympus公司。
1.3方法
1.3.1小鼠BMDCs的分离[11]及培养 取10只BALB/c小鼠,用颈椎脱臼的方法将其处死,分离小鼠的股骨以及胫骨,再使用RPMI 1640培养基洗涤3次,除去两边的骨骺,用1 mL 的细空针吸取RPMI 1640培养基,多次洗涤骨髓空腔,同时使其完全分散开来,于25 ℃下2 000 r/min离心10 min,弃上层清液,收集骨髓单核细胞,按1︰1的比例滴加红细胞裂解液,25 ℃放置2 min,待裂解结束,1 500 r/min离心5 min,除去上层清液,用培养基重悬细胞,使细胞浓度达到1×106/L,以4毫升/孔的密度将其种于6孔板内,每孔中加入含GM-CSF(20 ng/mL)+IL-4(10 ng/mL)的RPMI 1640培养基2 mL,5%CO2、37 ℃培养箱中孵育,培养第3天时用6孔板内的单孔悬浮培养液2 mL,加入全新的6孔板内再培养,每孔再加入含GM-CSF(20 ng/mL)及IL-4(10 ng/mL)的RPMI 1640培养基2 mL,5%CO2、37 ℃培养箱中继续培养,培养7 d时,采集悬浮及半贴壁的细胞即为imDC。同时设置同型对照组。采用相同培养方法,培养第6天于6孔板中加入含LPS(1 μg/mL)RPMI 1640培养基2 mL,5%CO2、37 ℃培养箱中培养24 h,收获的细胞即为mDC。在光学显微镜下观察其形态同时采集照片。
1.3.2小鼠BMDCs的电镜形态观察 取上述培养的DC,以1 500 r/min离心10 min,弃上层清液,用0.1 mol/L磷酸盐缓冲液(PBS)洗涤3次。用50 μL PBS重新悬浮细胞,把细胞悬浮液滴在多聚赖氨酸包被的盖玻片上,37 ℃的恒温电烤箱中加热15 min,然后待细胞自然沉于盖玻片上。细胞沉淀之后,用冷的PBS缓慢漂洗3 次,再在4 ℃下用冷的pH7.4、3%戊二醛固定1 h。再用PBS 洗涤3次,每次约30 min,用1%锇酸固定1 h。PBS漂洗3次,然后使用不同浓度的乙醇慢慢逐步脱水,置换、干燥镀膜。采用电子显微镜观察细胞形态并记录。
1.3.3小鼠BMDCs的表型检测 取上述imDC和mDC,将细胞调整为1×106/mL,在100 μL反应体系中分别加入1 μL的三氢-吲哚菁型染料标记的抗鼠CD11c单抗、0.3 μL用PE标记的抗小鼠CD80单抗、0.6 μL用PE标记的抗小鼠CD25单抗以及CD86单抗,0.9 μL用FITC标记的MHCⅡ单抗,4 ℃黑暗条件下反应30 min,用PBS漂洗2次,除去尚未结合上的抗体,滴加4%的多聚甲醛进行固定之后,同时做空白对照,采用流式细胞仪检测,并用FlowJo软件进行结果分析。
1.3.4小鼠BMDCs共刺激分子CD80、CD86和MHCⅡ蛋白表达 用蛋白质裂解液提取蛋白,测定蛋白质浓度(Bradford法)。将蛋白质样品进行10%的SDS-PAGE电泳,把转移蛋白质于聚偏氟乙烯膜上。于25 ℃下封闭1 h,加入兔抗人CD80多克隆抗体(1∶1 000)以及兔抗人CD86多克隆抗体(1∶1 000),25 ℃下培育2 h,同时用小鼠抗人GADPH单克隆抗体(1∶2 000)作为内参照。洗涤之后加入辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶2 000)反应1 h,然后加ECL发光剂,暗室X光胶片曝光,在10~20 min内显影及定影。用Quantity One系统对目的条带的灰度值进行计算分析,用目的条带灰度和内参条带灰度比值作为目的蛋白的相对表达量。
1.3.5CIA小鼠模型及实验分组 在CⅡ中滴加0.1 mol/L的冰醋酸,将其在4 ℃条件下缓慢溶解,得到2 mg/mL 的溶液,4 ℃冰箱静置一夜之后,把CⅡ溶液和CFA按照1︰1的比例混匀即为乳化剂,用30只小鼠对其进行首次免疫,取50 μL的CⅡ乳化剂在每只小鼠的尾根部和背部等部位进行皮下注射。首次免疫之后的第6天,依照随机原则把小鼠分为imDC组(10只)、空白对照组(10只)和mDC组(10只)。每组小鼠都从尾静脉注入相异的干预剂,其中imDC组静注含有1×106个imDC的PBS 100 μL,mDC组静注含有1×106个mDC的PBS 100 μL,空白对照组静注100 μL的PBS。首次免疫后1周时,各组小鼠分别再进行1次免疫强化,使用的药物及剂量与首次免疫相同。
1.4观察指标
1.4.1关节炎指数(AI)评分 测定在免疫强化的同一天对两组小鼠的AI评分进行测定,之后每隔7 d测定1次,一共测定4次(用时3周),检测方法采用5 级评分法进行评估。0级:正常的关节;1级:关节发红但是不肿;2级:关节有轻微红肿;3级:关节中等程度红肿;4级:关节重度红肿同时伴有功能受限。AI评分为每只小鼠四肢关节评分的汇总,最高分为16分。各实验组所有小鼠关节炎的总得分除以该组小鼠的数量为该组小鼠的平均AI评分。
1.4.2血清IL-10及TGF-β水平检测 于免疫强化之后第21天,在各组小鼠眼眶上取血1.0 mL,以2 000 r/min离心15 min,收集上层清液,遵照ELISA试剂盒的说明书测定小鼠血清IL-10及TGF-β水平。
1.4.3流式细胞术测定 CD4+于强化免疫第21天处死3组小鼠,取出脾脏,在冰浴条件下分离脾细胞,裂解红细胞,用PBS洗涤3次,用免疫磁珠试剂盒分选CD4+T细胞,使细胞的浓度变为4×106/100 μL,接种至含RPMI 1640培养基的24孔培养板,5%CO2、37 ℃的培养箱中培育48 h,收集各组细胞,PBS洗涤3次,使细胞浓度达到1×106/mL,用FITC标记的CD4单抗以及PE标记的抗小鼠CD25单抗,4 ℃黑暗条件下反应30 min,PBS漂洗2次,滴加4%的多聚甲醛固定,同时做空白对照,最后放于流式细胞仪进行测定。
1.4.4免疫印迹法检测 检测小鼠脾脏组织IL-10和TGF-β蛋白表达在4℃条件下(冰水中)将上述脾脏组织匀浆裂解,提取蛋白。使用紫外分光光度计测量蛋白质浓度。蛋白质的单孔上样量为25 μg。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳后,将蛋白质转到PVDF膜上,再使用5%的脱脂奶粉封闭2 h,TBST将膜洗涤3次,之后分别孵育羊抗小鼠的抗IL-10(1∶100)、TGF-β(1∶1 000)抗体及抗β-actin(1∶5 000)抗体,4 ℃放置一夜;用TBST将膜洗涤3次之后,再用IL-10及TGF-β孵育辣根过氧化物酶(HRP)标记二抗(1∶5 000),反应2 h之后,用TBST将膜再洗涤3次。最后,Luminol Ecl Reagent显影,并采用Image J软件对图像做灰度值扫描。
2 结 果
2.1小鼠BMDCs的体外培养形态变化 分离的小鼠骨髓细胞,经GM-CSF加IL-4诱导后培养的第3天,能够见到具有树突状突起的细胞,形态上体积小,比较圆润,贴壁生长,不牢固,同时也有集落样生长现象。培养第5天细胞的突起慢慢增加,细胞团也慢慢增加,细胞的形态体积逐渐变大,细胞膜上的树突状突起变多,剧烈晃动时会从培养板上脱离,见图1A、1B。骨髓细胞经GM-CSF+IL-4+LPS诱导后第8天,悬浮细胞的形态逐渐变大,突起显著变多变长,细胞膜上也慢慢伸出显著的树突样结构,长短不均,集中生长,见图1C、1D。
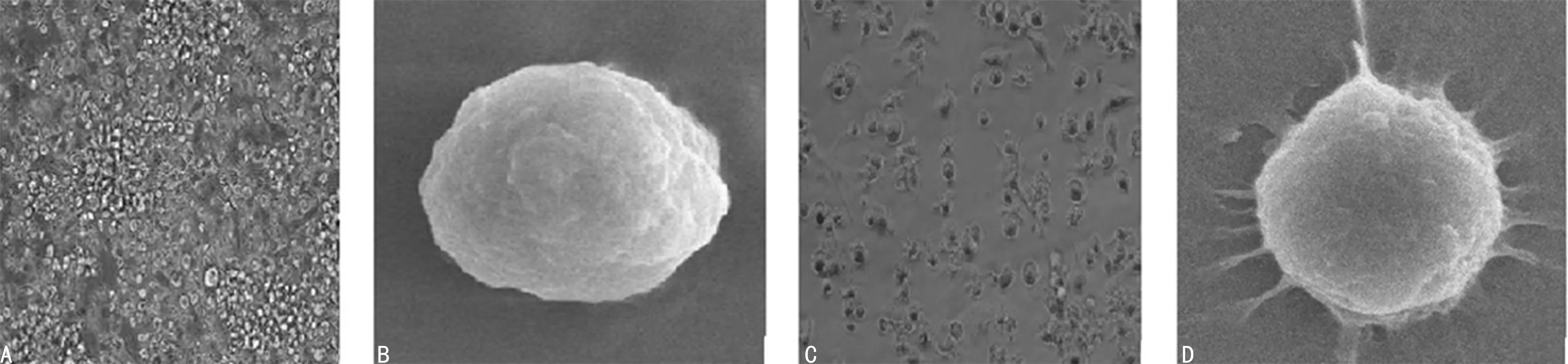
注:A为imDC第5 天倒置显微镜下(×100);B为imDC第5 天扫描电镜下(×3 000);C为mDC第8 天倒置显微镜下(×100);D为mDC第8 天扫描电镜下(×3 000)。
2.2小鼠BMDCs细胞表型分析 髓源单核细胞经IL-4+GM-CSF诱导后,其共刺激分子CD80、CD86、MHC-Ⅱ表达率分别为36.80%±5.86%、32.80%±6.42%、56.80%±5.36%,即为imDC;经IL-4+GM-CSF+LPS诱导后,其共刺激分子CD80、CD86、MHC-Ⅱ表达率分别为90.03%±7.38%、89.87%±7.10%、93.03%±7.76%,即为mDC。与imDC组比较,mDC组标志性分子CD11c,以及共刺激分子CD80、CD86和MHCⅡ表达率显著升高,差异均统计学意义(P<0.05)。结果表明DC成功诱导分化为imDC和mDC。
2.3小鼠BMDCs CD80、CD86和MHCⅡ蛋白表达 与imDC组比较,mDC组的CD80、CD86和MHCⅡ蛋白表达明显升高,差异均有统计学意义(P<0.05);表明imDC受到刺激后,共刺激分子CD80、CD86和MHCⅡ表达会明显上升,进一步证实imDC和mDC诱导分化成功。见图2。
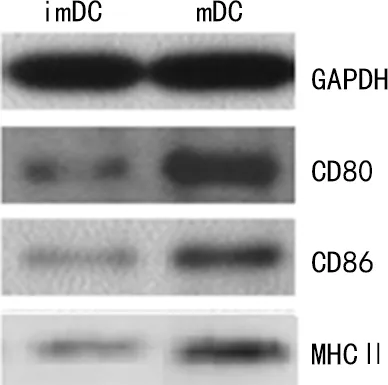
图2 树突状细胞CD80/CD86和MHCⅡ蛋白表达
2.4CIA小鼠AI的变化 首次免疫之后,3组小鼠的足部均有不同程度的轻微肿胀,但仅位于趾间关节,并没有畸形或者是强直现象。强化免疫之后第1天(首次免疫后第7天),imDC组和空白对照组肿胀加重,累及踝关节,但部分小鼠症状开始逐步缓解。强化免疫后第21天,imDC组AI评分[(7.28±1.45)分]显著高于mDC组[(13.78±2.14)分]和空白对照组AI评分[(12.31±1.83)分],差异均有统计学意义(P<0.05)。
2.5CIA小鼠血清IL-10和TGF-β水平变化 强化免疫后第21天,imDC组血清IL-10和TGF-β[(11.32±2.17)pg/mL和(27.15±4.71)pg/mL]显著高于mDC组[(5.47±1.83)pg/mL和(11.64±2.67)pg/mL]及空白对照组[(4.96±1.79)pg/mL和(12.06±2.25)pg/mL],差异均有统计学意义(P<0.05)。
2.6CIA小鼠脾脏IL-10和TGF-β蛋白表达 强化免疫后第21天,imDC组CIA小鼠脾脏IL-10和TGF-β蛋白表达均明显高于mDC组和空白对照组,差异均有统计学意义(P<0.05)。见图3。

注:A为imDC组;B为mDC组;C为空白对照组。
2.7CIA小鼠脾脏Treg细胞变化 强化免疫后第21天,imDC组脾脏Treg细胞比例(4.62%±1.03%)显著高于mDC组(3.05%±0.87%)和空白对照组(3.03%±0.91%),差异均有统计学意义(P<0.05)。
3 讨 论
RA起病通常是由人体内免疫耐受被破坏、体液免疫亢进[12]造成的。DC作为机体内仅存的能够使初始T细胞发生免疫应答的抗原提呈细胞[13],在RA的发生发展中起着关键的作用。有研究提出,imDC在很大程度上能够诱导Treg细胞产生,同时使自身免疫性T淋巴细胞发挥清除作用来维持机体的免疫稳态[14-16]。这为RA患者体内自身反应性T淋巴细胞的清扫,以及免疫耐受重建提供了新的治疗希望。但是对于机体内能够捕捉自身抗原的DC来说,使其处于imDC状态则能很大程度上控制RA的病情,甚至将其彻底治愈。
在众多的自身免疫性疾病的动物模型上,imDC作为一种含有重大使用价值的细胞疗法,可以诱导机体产生免疫耐受,从而治疗炎性疾病。CIA小鼠模型能够有效地仿照RA患者的病理生理特征及其免疫系统的微生态,是一种被大家所公认的RA动物模型,可用于imDC相关实验研究。本研究结果表明,小鼠髓源单核细胞被诱导分化成为imDC之后,能够使共刺激分子CD80、CD86和MHCⅡ等细胞因子出现低表达现象,这类细胞的表型不具有强大的活化特异性免疫反应的功能,从而致使以Th17细胞为首的T淋巴细胞产生无效应答[16]。在本研究中,CIA小鼠经再次免疫强化之后,mDC组及空白对照组小鼠的足部病理变化与imDC组相比较为严重,说明在同源的小鼠体内imDC的确可以在一定程度上缓解关节炎的进展,改善病情。有文献提出,imDC进入体内之后可以增加抗炎细胞因子IL-10及TGF-β的表达,对炎症因子产生强烈的抑制效果,从而缓解组织处的病变[18]。本研究结果表明,小鼠免疫强化之后的第21天,imDC组CIA小鼠血清、脾脏的IL-10和TGF-β均显著高于mDC组和对照组,结果与上述文献报道一致。相关类型抗炎介质表达增加的过程中,有许多免疫学者认为是imDC激活Treg细胞群,激发了巨大的免疫耐受反应[19]。Treg细胞作为特异性免疫的负向调控因子,在炎症过程处于剧烈状态下或者有自身的组织细胞受到攻击时,能够由相关细胞因子刺激Tn的分化从而使其产生。有研究表明,imDC在整个的变化过程中产生了相当关键的作用,被活化的Treg细胞能够产生大量的IL-10及TGF-β,从而达到免疫耐受及抗炎的目的[20]。本研究结果表明,小鼠强化免疫之后第21天,imDC组小鼠脾脏Treg细胞比值与mDC组及空白对照组相比显著增高,这提示imDC诱导免疫耐受的途径可能是由于Treg细胞群受到某种因素的刺激进而获得增殖所致。
因此,imDC能够诱导Treg细胞的产生及体内自身反应性T细胞的清除,目前这是RA研究的热点,至于怎样用最佳的药物保持递呈自身抗原DC在imDC状态当前尚未发现。但是,随着免疫学、分子生物学以及基因组学等先进性学科的快速发展,以后的科研探究有望就如何调节imDC来重建自身免疫性疾病患者免疫耐受进行讨论,为RA的治疗乃至彻底治愈提供最佳的治疗策略。

