原发性硬化性胆管炎小鼠NK1R/TGF-β1/miR-31轴对胆汁瘀积及肝纤维化的影响
武云飞,张卫彬,杨 成,李 博
锦州市中心医院普外二科,辽宁锦州 121000
原发性硬化性胆管炎是临床较为常见的进行性非化脓性胆管疾病[1]。流行病学调查显示,原发性硬化性胆管以女性多发,临床主要以种肝内外胆管损伤、肝内胆汁淤积作为主要特征,同时合并其他自身免疫性疾病[2]。在病理学研究中,原发性硬化性胆管主要表现为肝内胆管的进行性破坏[3],进一步造成局部病灶部位的炎症反应及纤维化,而随着疾病的发展,最终会造成门脉高压及肝硬化,严重影响患者的生命质量[4]。有研究报道指出,随着疾病的进展,门脉高压呈进行性进展,肝纤维化程度升高,肝功能下降[5]。神经激肽1受体(NK1R)对炎症反应水平有一定指导意义[6]。转化生长因子-β1(TGF-β1)是肝脏细胞病变及纤维化的重要指标。血清微小RNA-31(miR-31)最早被认为是肿瘤细胞迁移的重要指征,但是近年研究认为,miR-31对肝纤维化的不断浸染具有积极意义[7]。本研究主要通过原发性硬化性胆管炎小鼠NK1R/TGF-β1/miR-31轴对胆汁瘀积及肝纤维化的影响,为临床诊断及治疗提供依据。
1 材料与方法
1.1实验动物 120只雌性SPF级新生小鼠由中科院提供;体重180~217 g,平均(25.33±2.39)g;饲养条件:温度(21±2)℃,湿度30%~70%,光照每昼夜12 h。
1.2仪器与试剂 仪器:酶标仪(DNM-9602,北京普朗新技术有限公司);台式高速冷冻离心机(TGL20M,JTLIANGYOU);恒温水浴箱(HH-W420/W600);PCR仪[中科瑞泰(北京)生物科技有限公司]。试剂:Trizol 试剂(上海联硕生物科技有限公司);试剂盒(上海罗氏)。
1.3方法
1.3.1模型构建 将120只实验小鼠随机分为模型组、对照组、空白组3组,每组40只。模型组:腹腔注射聚肌胞苷酸(1%)建模,注射剂量5 mg/kg,每周注射2次,对实验小鼠进行随机病理学检测。对照组:腹腔注射等量的生理盐水,注射剂量同模型组。空白组:不采取任何处理措施。
1.3.2标本处理 取肝组织放入4%多聚甲醛固定中,后经乙醇脱水、石蜡包埋等步骤后,行连续切片后封闭。根据常规步骤进行Masson染色[1],镜下观察肝组织病理形态。
1.3.3研究方法 分别对实验小鼠进行眼眶采血4 mL,3 000 r/min离心10 min取上清。采用酶联免疫试验检测实验小鼠血清TGF-β1、TGF-β1水平,采用荧光定量PCR(RT-qPCR)法检测miR-31水平。操作流程严格按照说明书进行。
1.3.4观察指标 比较3组实验小鼠NK1R、TGF-β1、miR-31水平,比较无明显纤维化组、明显纤维化组及早期肝硬化组实验小鼠NK1R、TGF-β1、miR-31水平,比较胆汁淤积组及非胆汁淤积组小鼠NK1R、TGF-β1、miR-31水平。
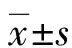
2 结 果
2.13组小鼠肝脏纤维化情况比较 取的样本后通过Masson染色观察3组小鼠肝组织结果变化,结果发现,空白组、对照组肝组织结构清晰,肝小叶完整,肝细胞索排列整齐,以中央静脉为中心呈放射状排列,汇管区仅有极少量的纤维组织。肝纤维化模型组小鼠部分肝小叶结构紊乱,有脂肪空泡、有大量炎症细胞浸润,并有假小叶形成,肝细胞普遍坏死,胶原纤维大量增生并形成纤维间隔。见图1。
注:A为对照组;B为模型组;C为空白组。
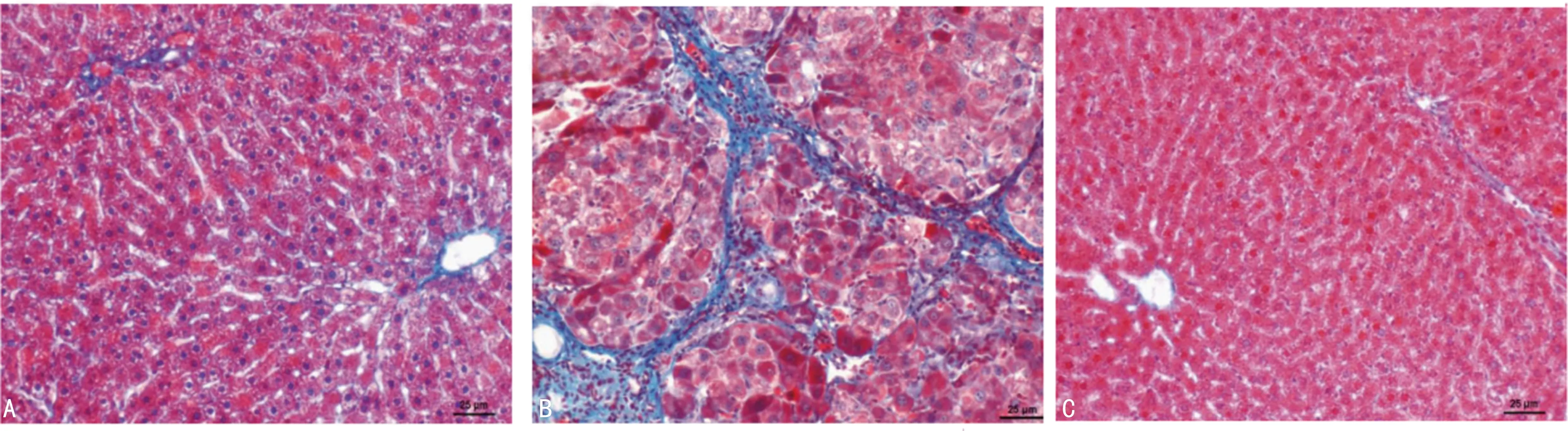
2.23组小鼠NK1R、TGF-β1、miR-31水平比较 3组小鼠NK1R、TGF-β1、miR-31水平比较,差异有统计学意义(P<0.05),两两比较结果显示,模型组NK1R、TGF-β1、miR-31水平高于对照组、空白组,差异均统计学意义(P<0.05)。见表1。
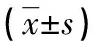
表1 3组小鼠NK1R、TGF-β1、miR-31水平比较
2.3不同肝脏纤维化情况小鼠NK1R、TGF-β1、miR-31水平比较 无明显纤维化组、明显纤维化组、早期肝硬化组小鼠NK1R、TGF-β1、miR-31水平差有在统计学意义,两两比较结果显示,NK1R、TGF-β1、miR-31水平从高到低依次为早期肝硬化组、明显纤维化组、无明显纤维化组,差异均有统计学意义(P<0.05)。见表2。
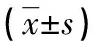
表2 不同肝脏纤维化情况小鼠NK1R、TGF-β1、miR-31水平比较
2.4不同胆汁淤积情况小鼠NK1R、TGF-β1、miR-31水平比较 非胆汁淤积组NK1R、TGF-β1、miR-31水平低于胆汁淤积组,差异均有统计学意义(P<0.05)。见表3。
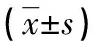
表3 不同胆汁淤积情况小鼠NK1R、TGF-β1、miR-31水平比较
2.5相关性分析 Spearman相关性分析显示,实验小鼠的NK1R、TGF-β1、miR-31水平与肝脏纤维化情况(r=0.741、0.694、0.587,均P<0.001)及胆汁淤积情况(r=0.556、0.559、0.785,均P<0.001)均呈正相关。
3 讨 论
肝纤维化是肝硬化前期的一种病理变化,多数造成慢性肝损害的因素均可能导致肝纤维化。在病毒感染、酒精及遗传等各种致病因素影响下,肝细胞被破坏[8],反复性肝细胞损伤、修复,以及细胞外基质在肝脏内的沉积[9],从而引起肝脏结构和功能发生改变,进而引起肝纤维化。目前研究认为肝纤维化及初期肝硬化通过适当的治疗可以得到控制和逆转[10]。肝纤维化的诊断多采取肝脏穿刺活检,但是肝脏活检存在依从性不高、易受取材部位影响的局限性,而血清学指标检测简便、快捷,并可有效避免由于取材造成的误差,对于患者的预后评价更加直观[11]。
本研究结果显示,随着实验小鼠肝脏纤维化程度升高,实验小鼠NK1R、TGF-β1、miR-31水平呈上升趋势。有研究显示,NK1R主要反映了机体免疫细胞的活性,随着NK1R水平升高,进一步调控局部病灶部位的SP水平,提升炎症反应水平[12]。而在肝硬化疾病的进展中,自身免疫性细胞对于局部病灶部位的肝细胞及病毒造成损伤的肝细胞进行吞噬,加剧疾病的进展[13]。这提示在肝脏纤维病变过程中,NK1R可通过对自身免疫系统的上调作用,进一步刺激机体的自身免疫细胞的激活,对于疾病的进展具有主要意义。TGF-β1在肝细胞纤维化转变过程中发挥着重要的作用。有研究显示,TGF-β1是调节细胞生长及分化的重要蛋白[14]。而在本研究中,随着肝脏细胞的不断纤维化病变,抑制IL-3、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、巨噬细胞集落刺激因子(M-CSF)所诱导小鼠造血前体细胞和长期骨髓液体培养(LTBMC)的集落形成[15],并降低巨核细胞对IL-3和CSF的反应性,进一步造成病变细胞自身吞噬,而在不同胆汁淤积情况的分析中,随着胆汁在肝细胞内的不断淤积,自身免疫细胞对于局部病灶部位的吞噬细胞对于损伤细胞的修复不断增强,而在此过程中造成的肝细胞的损伤也在升高,局部炎症反应呈现级联反应,进一步促进TGF-β1水平升高。miR-31最早在肿瘤细胞中发现,在肝脏细胞的纤维化的发展中主要通过NK1R、TGF-β的协同作用,进而导致肝细胞的坏死[16]。本研究结果显示,NK1R、TGF-β、miR-31与肝细胞内的胆汁淤积及肝脏纤维化的疾病进程呈正相关。但是,本研究还存在一定的局限性,由于纳入的样本量较小,有待进行大样本研究进一步验证。
原发性硬化性胆管炎小鼠的NK1R、TGF-β1、miR-31和胆汁瘀积、肝纤维化程度均升高,且NK1R、TGF-β1、miR-31升高与胆汁瘀积及肝纤维化升高呈正相关,可为临床诊断提供一定的依据。

