伴肝转移性结直肠癌患者微卫星不稳定率与PD-L1/PD-1表达及预后的相关性研究*
江少锋,杨晓琳,贺 滢
湖南省肿瘤医院/中南大学湘雅医学院附属肿瘤医院:1.消化泌尿内一科;2.教学办,湖南长沙 410006
微卫星指基因组中一段具有高度突变性的简单重复序列,在DNA复制过程中微卫星序列发生增减突变即为微卫星不稳定(MSI)。根据MSI突变位点数量的多少可划分为高频MSI(MSI-H)、低频MSI(MSI-L)及微卫星稳定(MSS)。国内最新的结直肠癌肝转移诊治指南[1-2]均推荐结直肠癌患者进行MSI检测,进而为精准制订治疗策略提供依据。结直肠癌MSI-H的特点是早期MSI-H发生率约20%,晚期MSI-H发生率(约5%)远低于早期[3]。早期结直肠癌相关的研究认为,MSI-H表明患者预后良好[4],且MSI状态与程序性死亡配体1(PD-L1)/程序性死亡受体-1(PD-1)的表达具有相关性[5];而发生远处转移的晚期结直肠癌中MSI-H的临床意义尚存争议,其与PD-L1表达的关系也不清楚。本研究将在发生肝转移的转移性结直肠癌患者中分析MSI状态与PD-L1表达、化疗疗效的相关性。
1 资料与方法
1.1一般资料 选取2018年1月至2020年3月在本院诊断为结直肠癌的472例患者作为研究对象。纳入标准:(1)经活组织病理检查诊断为结直肠癌;(2)伴肝转移和无转移的结直肠肿瘤;(3)有完整的临床病理资料;(4)有完善的影像学资料可供评价肿瘤分期及疗效。排除标准:(1)接受过放化疗或靶向治疗;(2)既往有其他恶性肿瘤病史;(3)合并除肝脏以外其他部位转移。纳入的472例结直肠癌患者中,伴肝转移194例,无转移278例。本研究获得医院伦理委员会批准,并取得所有患者的书面知情同意。
1.2方法
1.2.1MSI状态的检测及分组 取伴肝转移的结直肠癌患者及无转移的结直肠癌患者的原发灶,根据指南[1-2]推荐,采用免疫组化的方法检测MSI。取病灶组织蜡块,制作石蜡切片,对MutL蛋白同系物1(hMLH1)、MutS蛋白同系物2(hMLH2)、MutS蛋白同系物6(hMLH6)进行免疫组化染色。由2名高年资病理科医生在双盲条件下进行读片,在400倍镜下随机观察5个视野,细胞核呈棕色或棕黑色颗粒为阳性,阳性细胞占比<30%为阴性、≥30%为阳性。hMLH1、hMSH2、hMSH6 3个蛋白中2个及以上表达阴性判断为MSI-H,1个表达阴性为MSI-L,3个均表达阳性为MSS。根据伴肝转移的结直肠癌患者MSI状态分为MSI-H组、MSI-L组、MSS组。
1.2.2PD-L1、PD-1 mRNA表达水平检测 取伴肝转移的结直肠癌患者的原发灶和转移灶,采用总RNA提取试剂盒提取组织中的总RNA;采用cDNA第一链合成试剂盒对总RNA进行逆转录、合成cDNA,采用荧光定量检测试剂盒对PD-L1、PD-1 mRNA表达水平进行荧光定量PCR检测。反应体系:cDNA 1 μL、荧光定量检测反应混合液10 μL,正、反向引物各0.6 μL,以去离子水补足至20 μL。PD-L1引物序列:正向5′-TAGCTAGCTAGTTAGTC-3′,反向5′-TCCAGGCTAGCTAGCTTA-3′;PD-1引物序列:正向5′-CGTAGGCGTTATGCGTATT-3′,反向5′-ATGCTATGCGTAGTAGCGT-3′。在荧光定量PCR仪上设置反应程序:95 ℃ 3 min,而后95 ℃ 15 s、特异性退火温度(PD-L1 60.0 ℃、PD-1 62 ℃、β-actin 62.0 ℃)25 s、72 ℃ 30 s,重复40个循环,反应结束后得到循环曲线及循环阈值(Ct)。内参β-actin引物序列:正向5′-TAGCGTATGCGTTAGCTGA-3′,反向5′-ATTGCTGGCTGATTGCGTA-3′。按照公式2-ΔΔCt计算PD-L1、PD-1的mRNA表达水平。
1.3化疗方案及疗效评价 根据指南[1-2]给予患者FOLFOX系统性化疗方案,共治疗6个周期,化疗后参照指南、按照实体瘤疗效评价标准分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),计算客观有效率、疾病控制率。客观有效率=CR率+PR率,疾病控制率=CR率+PR率+SD率。
1.4手术预后的评价 伴肝转移的结直肠癌患者化疗后进行结直肠癌原发灶和肝转移灶一期同步切除,手术后进行随访,随访截止时间为2022年4月30日,随访的终点事件为肿瘤发生复发或转移,据此计算无进展生存时间。
2 结 果
2.1伴肝转移与无转移的结直肠癌组织MSI状态比较 伴肝转移的194例结直肠癌患者结直肠癌组织MSI-H 11例(MSI-H率为5.67%),MSI-L 70例(MSI-L率为36.08%),MSS 113例(MSS率为58.25%);无转移的278例结直肠癌患者结直肠癌组织MSI-H 56例(MSI-H率为20.14%),MSI-L 84例(MSI-L率为30.22%),MSS 138例(MSS率为49.64%)。经检验,伴肝转移的结直肠癌组织MSI-H率低于无转移的结直肠癌组织,MSI-L率、MSS率高于无转移的结直肠癌组织,差异均有统计学意义(P<0.05)。
2.2伴肝转移的结直肠癌患者MSI-H组、MSI-L组、MSS组临床病理特征比较 伴肝转移的结直肠癌患者中,MSI-H组、MSI-L组、MSS组患者性别、年龄、原发灶位置比较,差异均无统计学意义(P>0.05),分化程度、淋巴结转移数目≥4个、肝转移数目≥2个、化疗前癌胚抗原(CEA)水平比较,差异均有统计学意义(P<0.05);两两比较显示,MSL-H组低分化的比例、黏液腺癌的比例、淋巴结转移数目≥4个的比例、肝转移数目≥2个的比例、化疗前CEA水平均高于MSI-L组和MSS组(P<0.05)。见表1。

表1 MSI-H组、MSI-L组、MSS组临床病理特征比较
2.3伴肝转移的结直肠癌患者中MSI-H组、MSI-L组、MSS组原发灶及转移灶内PD-L1、PD-1表达水平的比较 伴肝转移的结直肠癌患者中3组原发灶及转移灶内PD-L1、PD-1表达水平比较,差异均有统计学意义(P<0.05)。两两比较显示,MSI-H组原发灶及转移灶内PD-L1、PD-1的mRNA表达水平均高于MSS组、MSI-L组,差异均有统计学意义(P<0.05)。见表2。
表2 伴肝转移的结直肠癌患者中MSI-H组、MSI-L组、MSS组原发灶及转移灶内PD-L1、PD-1表达水平比较
2.4MSI-H组、MSI-L组、MSS组化疗近期疗效比较 MSI-H组化疗近期疗效客观有效率、疾病控制率均低于MSI-L组、MSS组(P<0.05)。见表3。
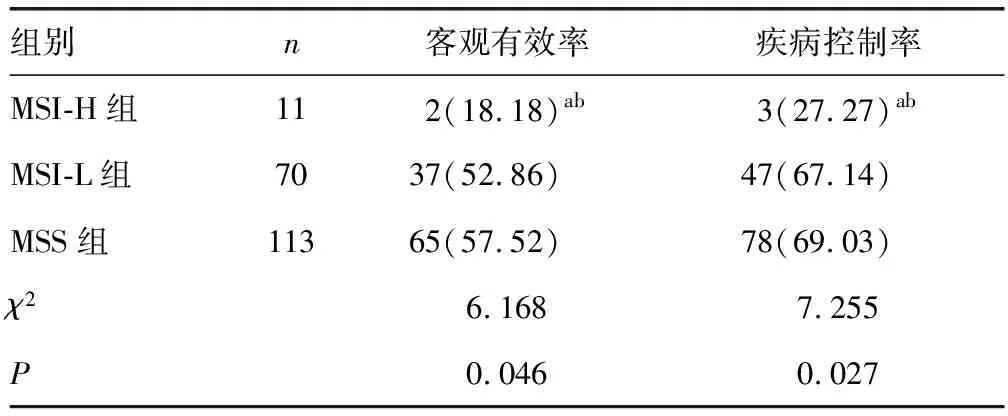
表3 MSI-H组、MSI-L组、MSS组化疗近期疗效比较[n(%)]
2.5MSI-H组、MSI-L组、MSS组预后比较 随访过程中,MSI-H组11例患者全部发生进展,MSI-L组60例患者发生进展,MSS组90例患者发生进展。经Log-rank检验,MSI-H组的累积无进展生存率低于MSI-L组和MSS组(P<0.05);MSI-H组与MSI-L组化疗的累积无进展生存率比较,差异无统计学意义(P>0.05)。见图1。

图1 K-M生存曲线
3 讨 论
结直肠癌的发生、发展过程中存在基因组不稳定,包括MSI、染色体不稳定及CpG岛甲基化三方面[6],其中MSI在肿瘤发生、病理进展、预后转归中均发挥了重要作用[7-8]。MSI的发生与错配修复基因突变或异常表达导致的错配修复蛋白表达缺失有关,根据基因突变数量不同MSI被分为MSI-H、MSI-L和MSS,准确评估MSI的状态能够为制订精准的结直肠癌治疗策略提供依据。
近些年,临床学者陆续开展了MSI与结直肠癌的相关研究,多数研究均支持早期结直肠癌中MSI-H的发生率高于晚期结直肠癌[7-8]。本研究对发生肝转移的晚期结直肠癌和无转移的结直肠癌进行了MSI状态检测和比较,结果显示转移性结直肠癌的原发灶内MSI-H率明显降低(P<0.05),MSI-L率及MSS率明显升高(P<0.05),这一结果与既往研究结果一致[7-9]。目前,MSI-H影响Ⅰ、Ⅱ期结直肠癌病理进展及预后的研究结果已被广泛接受,Ⅰ、Ⅱ期结直肠癌MSI-H往往提示预后生存良好,可能原因是MSI-H会促进细胞毒性T淋巴细胞、Th1淋巴细胞的浸润并促进癌细胞的清除[10-11]。但目前关于晚期结直肠癌中MSI与病情的关系尚存争议。
当结直肠癌进展至晚期后,MSI-H造成的病灶内淋巴细胞大量浸润会代偿性增加免疫检查点,促进癌细胞发生免疫逃逸,并形成了有利于癌细胞生长的微环境,在此基础上肿瘤病灶不断生长并出现相应病理特征的改变[12-13]。本研究结果显示,与MSI-L和MSS的伴肝转移晚期结直肠癌患者比较,MSI-H患者的低分化和黏液腺癌比例更高、淋巴结转移数目和肝转移数目更多、CEA水平更高(P<0.05)。另外,目前关于MSI状态的研究认为,MSI-L和MSS在生物学特征和临床特征上具有高度相似性,因而常常被归为一类,本研究对MSI-L患者和MSS患者的比较也未发现肿瘤病理特征的差异。以上结果表明,MSI-H促进了伴肝转移晚期结直肠癌的病理进展,包括分化程度变化、远处转移增多、CEA分泌增加。
研究认为,MSI-H在早期结直肠癌和晚期结直肠癌中的生物学作用均与肿瘤局部的免疫应答有关,MSI-H在结直肠癌早期促进淋巴细胞浸润、加强抗肿瘤免疫应答,在结直肠癌晚期代偿性增加免疫检查点、削弱抗肿瘤免疫应答、促进癌细胞的免疫逃逸[12-13]。有研究显示,结直肠癌免疫逃逸可能与PD-L1/PD-1途径有关,PD-1是一个负性共刺激受体,PD-L1与受体PD-1结合后能够向下游传导抑制性信号,最终实现对淋巴细胞分化成熟及增殖的抑制效应[14]。结直肠癌中PD-L1和PD-1高表达与病理进展有关,二者也是预后不良的相关因素[15-16]。本研究结果显示,MSI-H组患者原发灶和转移灶中PD-L1和PD-1水平均高于MSI-L组和MSS组,提示MSI-H在伴肝转移晚期结直肠癌的发生、发展过程中促进PD-L1/PD-1的表达,进而可能抑制抗肿瘤免疫应答、促进癌细胞的免疫逃逸。
对于确诊结直肠癌时已发生肝转移的患者,指南推荐采用系统性化疗方案进行辅助化疗,而后进行原发灶和转移灶的切除手术[1-2]。一项胃癌相关的临床研究证实,错配修复MLH1表达缺失与化疗耐药相关,提示MSI状态可能影响化疗疗效,进而影响预后[17]。本研究对伴肝转移的结直肠癌患者进行新辅助化疗,通过近期疗效的评价可知:MSI-H患者的客观有效率、疾病控制率均低于MSI-L患者和MSS患者(P<0.05),提示MSI-H会影响伴肝转移的晚期结直肠癌患者的化疗疗效。在新辅助化疗完成后进行手术切除,通过随访可知MSI-H患者的累积无进展生存率均低于MSI-L患者和MSS(P<0.05),提示MSI-H降低会对伴肝转移的晚期结直肠癌患者的预后产生不利影响。
综上所述,伴肝转移的结直肠癌原发灶内MSI-H率降低,MSI-H与分化程度变化、淋巴结和肝脏转移增加、CEA分泌增多等病理进展有关,也与PD-L1/PD-1表达升高、化疗近期疗效和远期预后不佳有关。本研究结果为认识MSI状态在转移性结直肠癌中的作用提供了一定依据,提示检测MSI对评估转移性结直肠癌病理进展和预后、制订精准治疗方案具有积极价值。

