糖络宁通过外泌体调控IRE1α 诱导细胞凋亡的作用机制研究*
姚伟洁,李 潇,冯 欣△,许利平
1 首都医科大学附属北京妇产医院北京妇幼保健院,北京 100006;2 首都医科大学中医药学院中医络病研究北京市重点实验室,北京 100069
中药复方糖络宁(以下简称TLN)在临床上治疗糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)取得了很好的临床疗效[1-2],前期实验发现,TLN 能够通过抑制雪旺细胞(schwann cells,SCs)中的IRE1α 表达,进而抑制内质网应激(endoplasmic reticulum stress,ER stress)诱导的细胞凋亡,从而改善DPN[3]。外泌体是由不同细胞类型释放到细胞外空间的纳米囊泡,外泌体可以将功能分子转移至靶细胞,充当细胞间的通讯工具[4-5]。前期研究发现,TLN 能够通过增加血清外泌体中的miR-322,降低SCs 中IRE1α 的表达,并通过降低IRE1 依赖性衰解(IRE1-dependent decay,RIDD)活性,抑制细胞凋亡[6]。提示外泌体在TLN 抑制IRE1α 诱导的细胞凋亡中发挥了重要的通讯作用。
研究发现,ER stress 发生时,IRE1α 能够通过募集肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor-associated factor 2,TRAF2),并与凋亡信号调节激酶1(apoptosis signal regulating kinase-1,ASK1)形成IRE1α-TRAF2-ASK1 复合体,进而激活c-Jun 氨基端激酶(c-Jun N-terminal kinase,JNK)的磷酸化,诱导细胞凋亡[7]。尽管TLN 能够通过外泌体作为媒介抑制IRE1α 的表达,抑制细胞凋亡,但其能否进一步通过抑制JNK 从而抑制细胞凋亡,至今尚未有研究。因此本实验以SCs 作为研究对象,通过提取大鼠血清分泌的外泌体干预SCs,进而探讨TLN通过外泌体调控IRE1α 抑制细胞凋亡的机制,为糖络宁治疗DPN提供依据。
1 材料与方法
1.1 实验药品链脲佐菌素(Sigma-Aldrich,批号:S0130);澳洲胎牛血清(Gibco,批号:10099-141);TRIzol 试 剂(Invitrogen,批 号:15596-025);TransStart Tip Green qPCR SuperMix(AQ141-02,全式金);TransScript First-Strand cDNA Synthesis SuperMix(AT301-03,全式金);高效RIPA 组织/细胞裂解液(索莱宝,批号:R0010-100);蛋白Marker(Genstar,批号:M221);超敏发光液(Millipore,批号:WBKLS0100);BCA 测定试剂盒(博奥森,批号:C-0018);小鼠单克隆p-JNK抗体,兔单克隆Bcl-2 抗体,兔单克隆Bax 抗体(Santa Cruz,批号:sc-6254,sc-7382,sc-7480);兔单克隆Cytochrome C 抗体,兔多克隆Caspase-3抗体,小鼠单克隆β-actin抗体,兔单克隆TRAF6抗体(Abcam,批号:ab133504,ab13847,ab8226,ab33915)。
1.2 实验仪器3K15 型低温离心机(Sigma);Mini-PROTEAN® Tetra 电 泳 槽(Bio-Rid);小型Trans-Blot®转印槽(Bio-Rid);371型二氧化碳培养箱(Thermo);MLS-3020 型高压灭菌器(SANYO),CFX96TM实时荧光定量PCR 仪(Bio-Rid);AC2-4E1型生物安全柜(ESCO)。
1.3 实验动物30只SD雄性大鼠,SPF级,6~8周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2016-0006。饲养条件:动物饲养于SPF级饲养室,12 h/12 h昼夜交替、温度(23±2)℃、湿度(55±10)%,自由进食饮水。动物实验经首都医科大学伦理委员会批准,符合伦理要求。
1.4 实验细胞雪旺细胞,选购大鼠RSC96 细胞株,购买于American Type Culture Collection(ATCC),培养基为Dulbecco's Modified Eagle Medium(DMEM)完全培养基,含有4 mM 谷氨酰胺,25 mM 葡萄糖,1 mM 丙酮酸钠,1500 mg/L 碳酸氢钠,10% FBS 及1%青链霉素混合液。雪旺细胞的培养环境为37 ℃和5% CO2的培养箱。
1.5 实验方法
1.5.1 分组与给药 TLN 原药材经过2 次煎煮后,将2 次滤液合并,继续加热浓缩至膏状,于真空干燥器中干燥成粉末,临用前加蒸馏水溶解到10.9 g 生药/kg。造模方法参照文献[8],30 只SD雄性大鼠适应性喂养1 周,分为空白组、模型组和TLN 组,每组10 只。其中模型组和TLN 组腹腔注射60 mg/kg 的链脲佐菌素(streptozotocin,STZ)溶液,空白组则腹腔注射等量PBS溶液。1周后测定大鼠空腹血糖(fasting blood glucose,FBG),FBG≥16.7 mmol/L 表明糖尿病模型建立成功。TLN 组灌胃给予10.9 g 生药/kg/d 的糖络宁溶液,持续给药12 周。空白组和模型组则给予10 mL/(kg·d)剂量的饮用水。最后一次给药1 h后将大鼠处死,腹主动脉取血,离心半径13.5 cm,3000 r/min 离心10 min 得到大鼠血清,-20 ℃冰箱保存备用。
1.5.2 外泌体的提取与内化作用 使用差速离心法提取大鼠血清中的外泌体。将大鼠血清依次300 g的离心力离心10 min,2000 g离心15 min,10 000 g离心30 min,收集上清液,继续70 000 g离心70 min,沉淀即为外泌体。使用PBS 溶解外泌体,用于后续研究。RSC96 细胞制成细胞悬液,并以4×105细胞/孔的数量接种于6 孔板中,于培养箱中放置过夜,待细胞贴壁后,分别将空白组、模型组和TLN 组大鼠血清分离的外泌体与细胞共培养24 h,收集细胞。
1.6 观察指标
1.6.1 Western blot 法测定蛋白表达 使用RIPA 裂解液提取RSC96 细胞中的蛋白,通过BCA蛋白定量试剂盒测定细胞蛋白浓度。将等量蛋白样本加入SDS-PAGE 凝胶中,并使用电泳分离蛋白,通过湿转系统将蛋白转运至0.45 μm PVDF膜上。使用5%脱脂奶粉室温封闭PVDF 膜2 h,随后加入相应一抗,4℃孵育过夜。吸弃一抗并加入相应二抗,室温孵育1 h 后,加入电化学发光试剂并置于凝胶成像系统中曝光形成图像。通过Image J软件计算蛋白样品的灰度值,计算蛋白的相对表达量,将β-actin 作为内标蛋白,结果以倍数的形式表示。一抗使用情况如下:小鼠单克隆β-actin抗体,兔单克隆TRAF6抗体,小鼠单克隆p-JNK抗体,兔单克隆Bcl-2抗体,兔单克隆Bax抗体,兔单克隆Cytochrome C抗体,兔多克隆Caspase-3抗体。
1.6.2 RT-PCR 法测定基因表达 使用TRIzol试剂提取各组RSC96细胞中的RNA,随后通过反转录试剂盒将RNA反转录为cDNA,cDNA继续通过SYBR预混系统和特异性引物进行RT-PCR 扩增,并通过计算2-△△Ct确定基因mRNA的相对表达水平。以β-actin作为内参,结果以倍数形式表示。引物使用情况见表1。

表1 引物序列
1.7 统计学方法通过SPSS 19.0 进行实验数据分析。计量资料以±s表示,多组独立样本间的比较使用One-Way ANOVA,非正态分布数据使用非参数检验方法,P<0.05 表示组间差异有统计学意义。
2 结果
2.1 TRAF2、p-JNK 及ASK1 蛋白表达与空白组相比,模型组TRAF2和p-JNK蛋白表达及ASK1 mRNA表达均显著升高(P<0.01);与模型组相比,TLN组TRAF2 和p-JNK 蛋白表达及ASK1 mRNA 表达均显著降低(P<0.01),表明TLN 能够通过外泌体抑制IRE1α-TRAF2-ASK1 复合体,进而抑制JNK 的磷酸化,抑制细胞凋亡。见图1、表2。
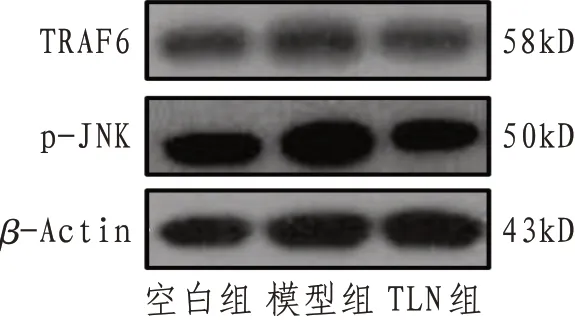
图1 各组TRAF2和p-JNK蛋白表达电泳图
2.2 Bcl-2和Bax蛋白表达与空白组比较,模型组Bcl-2表达显著降低,Bax表达显著升高(P<0.01);与模型组相比,TLN组Bcl-2表达显著升高,Bax表达均显著降低(P<0.01),表明TLN 能够通过外泌体抑制促凋亡蛋白Bax 的表达,促进抗凋亡蛋白Bcl-2表达,从而抑制细胞凋亡。见图2、表2。
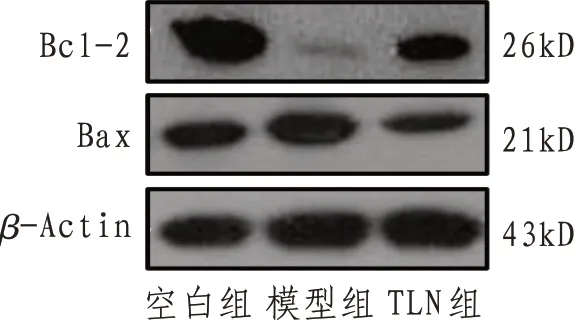
图2 各组Bcl-2和Bax蛋白表达电泳图
表2 各组TRAF2、p-JNK、Bcl-2、Bax蛋白及ASK1 mRNA表达比较(±s)
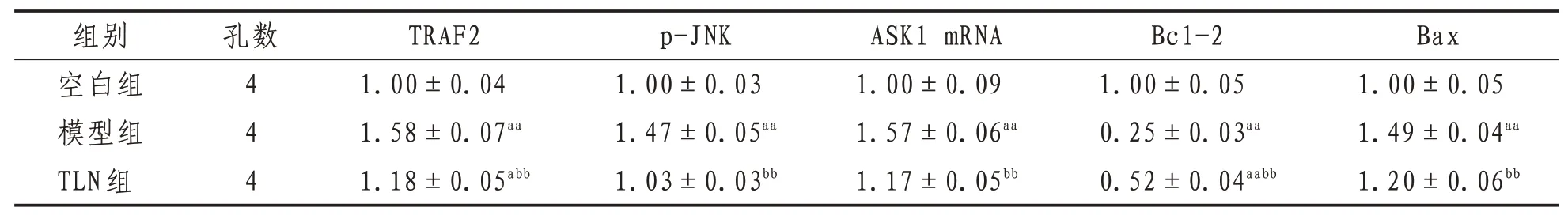
表2 各组TRAF2、p-JNK、Bcl-2、Bax蛋白及ASK1 mRNA表达比较(±s)
注:与空白组相比,aa表示P<0.01,a表示P<0.05;与模型组相比,bb表示P<0.01
?
2.3 Cyto C、cleaved-Caspase-3蛋白及Caspase-9 mRNA 表达与空白组比较,模型组Cyto C 和cleaved-Caspase-3 蛋白和Caspase-9 mRNA 表达显著升高(P<0.01);与模型组相比,TLN组Cyto C和cleaved-Caspase-3蛋白和Caspase-9 mRNA表达显著降低(P<0.01),表明TLN能够通过外泌体抑制Caspase-3诱导的细胞凋亡。见图3、表3。

图3 各组Cyto C和cleaved-Caspase-3蛋白表达电泳图
表3 各组大鼠Cyto C、cleaved-Caspase-3蛋白及Caspase-9 mRNA表达(±s)
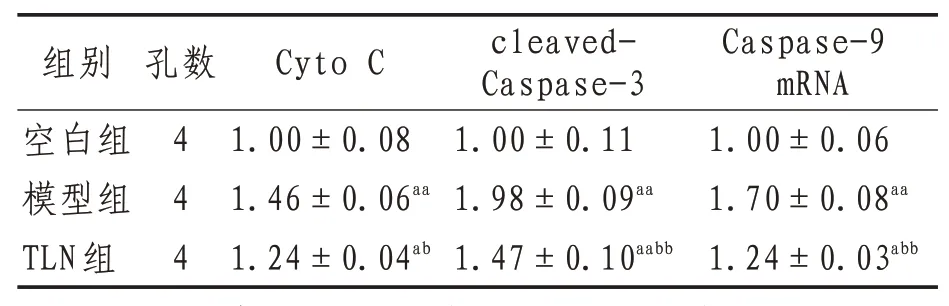
表3 各组大鼠Cyto C、cleaved-Caspase-3蛋白及Caspase-9 mRNA表达(±s)
注:与空白组相比,aa表示P<0.01,a表示P<0.05;与模型组相比,bb表示P<0.01,b表示P<0.05
?
3 讨论
外泌体是大小均一、直径约为30~100 nm、具有双层膜结构的球状或杯状囊泡,可由细胞分泌或存在于血液、尿液、唾液等体液中,其携带多种蛋白质、DNA、mRNA及miRNA等物质,通过与靶细胞结合,使靶细胞发生一系列的生物学效应[4-5]。研究发现,外泌体参与了糖尿病的发生过程,通过分离糖尿病及其并发症患者血清,并对血清中外泌体的miRNA进行测定,检测到多种miRNA的表达差异[9]。前期研究发现,TLN能够增加大鼠血清外泌体中的miR-322,进而降低SCs 中IRE1α 的表达,并通过降低RIDD 活性,抑制细胞凋亡[6],提示外泌体在TLN 抑制IRE1α 诱导的细胞凋亡中发挥了重要的作用。
JNK是MAPK家族的成员之一,JNK信号通路参与了多种细胞凋亡的发生[10]。ER stress发生时,IRE1α 通过募集TRAF2,并与ASK1 形成IRE1α-TRAF2-ASK1复合体,从而激活JNK的磷酸化,诱导细胞凋亡[7,11]。本实验的结果显示,TLN 能够通过外泌体抑制IRE1α-TRAF2-ASK1 复合体,抑制JNK的磷酸化,进而抑制细胞凋亡。
JNK 还能够通过上调促凋亡因子Bax,并抑制抗凋亡因子Bcl-2,从而诱导细胞凋亡[12]。Bcl-2和Bax是Bcl-2家族的蛋白,二者相互抑制,Bcl-2表达被抑制后,Bax 构象变化并寡聚化,促进线粒体对促凋亡因子敏感性,并破坏ER 膜形态的完整性,Ca2+外流,促进细胞凋亡。本实验中,TLN 能够通过外泌体抑制JNK 的磷酸化,从而抑制Bax 表达,并促进Bcl-2的表达,抑制细胞凋亡。
JNK 同样可以破坏ER 膜形态的完整性,导致Ca2+外流至线粒体,从而增加线粒体外膜通透化(mitochondrial outer membrane permeabilization,MOMP),MOMP 则进一步使细胞色素C(Cytochrome C,Cyto C)从内膜释放至细胞质,上调Caspase-9 和Caspase-3 表达,诱导细胞凋亡。本实验中,TLN则能够通过外泌体抑制JNK的磷酸化,从而抑制Cyto C 表达,并进一步抑制Caspase-9和Caspase-3的表达,抑制细胞凋亡[10]。
综上所述,糖络宁能够通过外泌体为媒介,通过抑制IRE1α-TRAF2-ASK1 复合体,进而抑制JNK的磷酸化,然后分别通过进一步抑制促凋亡蛋白Bax 表达,促进抗凋亡蛋白Bcl-2 表达,以及抑制Cyto C、Caspase-9 和Caspase-3 的表达,从而抑制ER stress诱导的细胞凋亡。

