安肠汤通过TRAF6/IRAK1/NF-κB 信号通路对溃疡性结肠炎大鼠的抑制作用研究
梁运特,孙平良,廖志远,赖斯华,张 琴,汤 勇,黄仲海
1 广西中医药大学研究生院,广西 南宁 530200; 2 广西中医药大学第一附属医院,广西 南宁 530023
溃疡性结肠炎(ulcerative colitis,UC)的临床表现以反复腹泻、黏液脓血便为主,多伴腹痛及不同程度的全身炎症症状,具有病程长、易复发及难治愈等特点[1]。研究表明,UC 发病机制与遗传因素、免疫异常、肠道微生态紊乱等密切相关[2-4]。前期研究表明,安肠汤具有显著抗炎、增强细胞免疫的作用,可减少UC 大鼠结肠黏膜的溃疡数和溃疡面积[5]。其治疗的机制是否与TRAF6/IRAK1/NF-κB 信号通路相关,目前尚无相关报道。本研究以安肠汤为研究对象,探究其对UC 大鼠结肠组织中TRAF6/IRAK1/NF-κB 信号通路中关键蛋白TRAF6、IRAK1、p-NF-κB、NF-κB 蛋白表达的影响,阐明安肠汤基于TRAF6/IRAK1/NF-κB 信号通路修复受损肠黏膜治疗UC的药效作用机制。
1 材料与方法
1.1 实验动物健康SPF 级SD 大鼠60 只,雄雌各半,体质量180~220 g,购自长沙天勤生物技术有限公司,实验动物许可证号码:SCXK(湘)2014-0011。饲养环境:广西中医药大学医学分子实验室,许可证号:SYXK 桂2010-0001;实验温度:20~23 ℃,实验室湿度:50%~60%。实验方案经广西中医药大学第一附属医院动物实验伦理委员会批准[批准号为2013(KF)-E-003]。
1.2 主要药物安肠汤药物组成:补骨脂25 g,黄芪20 g,党参15 g,白头翁15 g,茯苓15 g,槟榔15 g,熟附子15 g,地榆15 g,赤芍15 g,鸡内金10 g,薏苡仁10 g,干姜10 g,白术10 g,木香10 g,延胡索10 g,甘草10 g。药材由广东康美药业股份有限公司提供。将以上中药材洗净、浸泡30 min,先煎附子30 min,再加入剩余药物,继续熬30 min,每副药水煎3次,浓缩后4 ℃保存备用。美沙拉嗪肠溶片(佳木斯鹿灵制药有限公司,国药准字H19980149,规格:0.25 g/片)。本次实验用药处方及用量经广西中医药大学附属第一医院药学部审核。
1.3 试剂及耗材水合氯醛(成都市科龙化工试剂厂,批号:2013101801,规格:250 g/瓶);PrimeScript ™ RT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara,型 号RR047A);PrimeScript ™ RT Master Mix(Perfect Real Time)(Takara,型号RR036A);TriQuick Reagent(索莱宝,型号R1100);TB Green™ Pre-mix Ex Taq™ Ⅱ(Tli RNaseH Plus)(Takara,型号RR082A);5% 2,4,6-三硝基苯磺酸液(南宁市托普邦生物科技有限公司,商品编号:P2297-10 mL,规格:10 mL/瓶);甲醛(成都市科龙化工试剂厂,批号:20130817,规格:500 mL/瓶);TransScript®-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金,型号AU311);0.2 mL荧光定量PCR 透明八排管八连管盖(ABI,型号4323032);高效RIPA 组织/细胞裂解液(Solarbio,型号R0010);蛋白酶抑制剂混合液(100xPIC)(Solarbio,型号P6730)。
1.4 实验仪器T18 型组织匀浆机(IKA);TU-100C 型恒温金属浴锅(上海一恒);单道移液器(德国Eppendorf公司,10/20/100/200/1000 μL);一次性使用真空采血管(江西精致科技有限公司,抗 凝 管EDTA.K2);Ulti Mate 3000 型Thermo FisherUHPLC 3000 液相色谱(美国赛默飞);超声清洗机(郑州园田清洁设备有限公司);电泳仪(Bio-Rad,PowerPac Basic);蛋白转印模块(湿转)(Bio-Rad,Mini Trans-Blot Cell);TD4 型普通离心机(上海卢湘仪);DW-86L728J 型Haier 医用低温保存箱(青岛海尔特种电器);FC-1100 型超微量核酸检测仪(遂真);G8830-64001 型Ariamx Real-Time PCR(Agilent Technologies);4375786 型Veriti ™ 96-Well Thermal Cycler(Applied Biosystems®);5418R 型低温离心机(eppendorf);SIM-F140AY65 型制冰机(广西中医药大学第一附属医院医学生物实验室)。
1.5 实验方法
1.5.1 造模方法 参照文献[6-7]建立UC 大鼠模型,在禁食但不禁饮24 h 后,使用水合氯醛(浓度:10%,按大鼠体质量0.3 mL/100 g 计算用量)进行腹腔内注射麻醉,将灌肠管逐步深入距大鼠肛门约7 cm,注入2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid solution,TNBS)(按大鼠体质量90 mg/kg 计算用量)造模,等待药液完全进入肠道后,将大鼠继续提尾倒立2 min,保证药液充分吸收。空白组大鼠用等体积的生理盐水注入,待操作完毕大鼠清醒后给予自由饮食以及进水。造模成功表现:1)反复出现大便溏泄,甚至有脱肛症状;2)形体消瘦、食欲及体质量均下降;3)出现畏寒弓背,群体蜷缩聚堆;4)精神神态萎靡,毛色枯槁;5)易疲劳、嗜卧。以1)—3)项为主症,4)—5)项为兼症,具备两项主症及两项兼症即可认为大鼠模型复制成功。
1.5.2 分组及给药 大鼠模型建立后,将造模组大鼠随机分为模型组,美沙拉嗪组,安肠汤低、中、高组,每组10 只。空白组和模型组大鼠每天予0.9% NS 3 mL/只进行灌胃,美沙拉嗪组大鼠以美沙拉嗪混悬液5 mg/mL 灌胃,安肠汤低剂量组给予1 mL/(kg·d)(相当于临床等效量)、中剂量组给予5 mL/(kg·d)(相当于临床等效量的5倍)、高剂量组给予10 mL/(kg·d)(相当于临床等效量的10倍),灌胃量为药液+0.9%NS共3 mL。给药周期为14天。
1.5.3 标本处理 大鼠给药灌胃14 天后,使用水合氯醛麻醉,剖腹取腹主动脉血5~7 mL,静置30 min,予离心15 min 分离血清,并于-20 ℃冰箱保存待测。在距离肛门约8 cm 处取结肠病变最明显的组织,以0.9%NS 冲洗干净后,切取病变处结肠组织,一部分冻存于-80 ℃冰箱,另一部分固定于4%多聚甲醛。
1.6 观察指标
1.6.1 病理学组织观察 取结肠组织的病变部位,采用10%甲醛固定24 h 后,依次进行酒精脱水、浸蜡、组织切片、脱蜡、HE 染色等,在光镜下观测组织形态学改变并拍照。
1.6.2 qPCR 测定大鼠结肠组织中TRAF6、IRAK1、NF-κB mRNA 相对表达量 把组织剪成细小的碎片,取50~100 mg 放入2 mL 离心管置于冰盒上,依次加入1 mLTriQuick Reagent,用匀浆机匀浆至无沉淀,室温静置,加入0.2 mL 氯仿后静置,取上清0.5 mL加入洁净的离心管;加入0.5 mL异丙醇,静置10 min;离心,弃上清;加入1 mL 75%乙醇,4 ℃,12 000 g×5 min离心,弃上清;加入1 mL无水乙醇,4 ℃,12 000 g×5 min 离心,弃上清;65 ℃金属浴锅上烘干沉淀,加0.03 mLDEPC 水溶解。使用超微量核酸检测仪(遂真,FC-1100)进行RNA浓度及纯度检测,后按照逆转录试剂盒说明书进行逆转录操作,所得cDNA置于-80 ℃保存待用。
qPCR 反 应 体 系 为:MonAmp ™SYBR® Green qPCR Mix:10 μL,cDNA:1 μL,Primer Forward(10 μM):0.4 μL,Primer Reverse(10 μM):0.4 μL,H2O:8.2 μL;反应程序:预变性95 ℃:30 s;PCR循环(40 循环):95 ℃:10 s,60 ℃:30 s,溶解曲线:标准溶解曲线程序。实验仪器为Agilent Technologies AriaMx Real-Time PCR 仪。经实验获得的数据使用SPSS 17.0 软件进行整理及分析,采 用2-ΔΔCT 法 进 行 分 析,公 式 为:ΔCt=(Ct gene-Ctβ-actin),ΔΔCt=(ΔCt treat-ΔCt control)。所得数据使用GraphPad 进行整理制图。引物序列见表1。
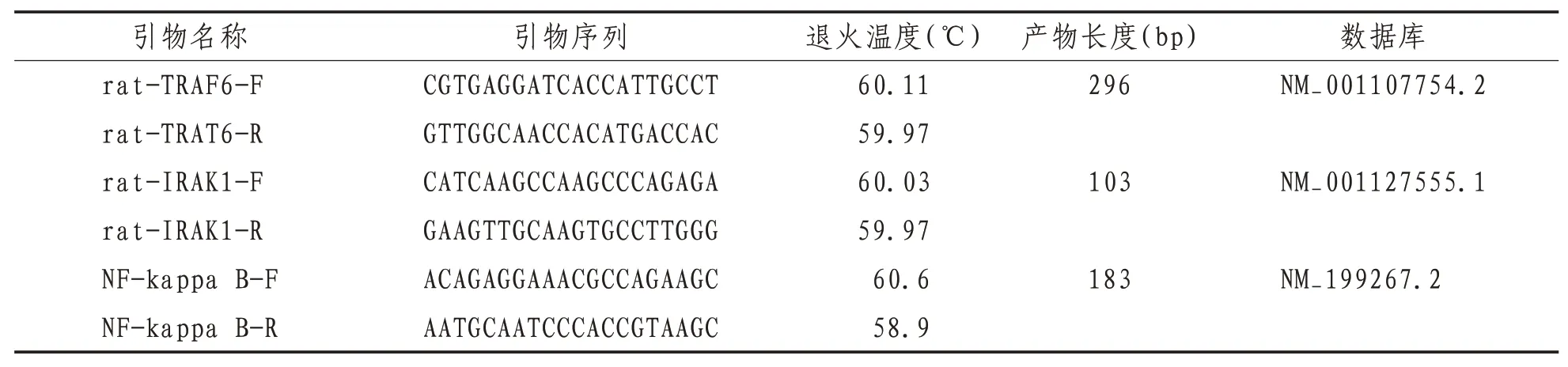
表1 引物序列
1.6.3 Western blot 法检测结肠组织TRAF6、IRAK1、p-NF-κB、NF-κB 表达 组织剪成细小的碎片,取20~40 mg放入2 mL离心管置于冰盒上,加入200~400 μL RIPA-PMSF-PIC,用匀浆机匀浆至无沉淀,匀浆时匀浆5 s左右放回冰盒冷却一会儿再继续匀浆。离心半径:8.4 cm,12 000 r/min 离心5 min,取上清采用BCA 法测定蛋白含量。将浓度定量至2 μg/μL,加入4×蛋白上样buffer,100 ℃变性10 min。所得变性后的蛋白置于-80 ℃保存待用。90 V 恒压电泳约20 min,待样品进入分离胶层后,换用120 V恒压电泳1~1.5 h。300 mA 恒流转膜90 min。用TBST(索莱宝,T1081)配制8%脱脂奶粉(索莱宝,D8340)作为封闭液,将膜放入封闭液中封闭3 h。按抗体说明书上的推荐比例使用封闭液将一抗(一抗信息另附表格)进行稀释,将膜放入稀释后的一抗中4 ℃ 孵育12 h。一抗孵育完成后,使用TBST 洗膜3 次,每次15 min。将膜放入按1∶4000 比例稀释的二抗(goat anti-rabbit:Abcam,ab6721)中37 ℃ 孵育1 h,使用TBST洗膜3次,每次15 min。使用ECL 显色剂对膜进行显色,于凝胶成像仪中进行曝光成像。
1.7 统计学方法采用SPSS 17.0 软件进行统计学分析,计量资料以±s表示,多组间采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠结肠组织的病理改变与空白组比较,模型组大鼠肠组织结构完全紊乱,结肠黏膜表面严重缺损,腺体排列损伤严重,层次不清,不同程度出现隐窝分支及扭曲,隐窝数量减少,更有大量炎细胞聚集,浸润,其中腺体破坏甚至丢失;安肠汤低、中、高剂量治疗后,UC 小鼠结肠黏膜病变均有一定程度的改善,其中安肠汤高剂量治疗和美沙拉嗪治疗后小鼠结肠黏膜病变恢复更加明显。见图1。
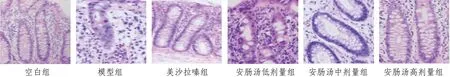
图1 各组大鼠结肠组织的病理改变(HE,×100)
2.2 大鼠结肠组织中TRAF6、lRAK1、NF-κBmRNA相对表达量与空白组比较,模型组大鼠组织中TRAF6、IRAK1、NF-κB mRNA 相对表达量明显增高(P<0.05);与模型组比较,美沙拉嗪组和安肠汤低、中、高组大鼠血浆中TRAF6、IRAK1、NF-κB mRNA相对表达量显著降低(P<0.05);与美沙拉嗪组比较,安肠汤高剂量组大鼠血浆中TRAF6、IRAK1、NF-κB mRNA相对表达量降低(P<0.05)。见表2。
表2 各组大鼠血浆中TRAF6、lRAK1、NF-κB mRNA的相对表达量比较(±s)

表2 各组大鼠血浆中TRAF6、lRAK1、NF-κB mRNA的相对表达量比较(±s)
注:#表示与空白组比较,P<0.05;*表示与模型对照组比较,P<0.05;&表示与美沙拉嗪组比较,P<0.05
?
2.3 大鼠血清内TNF-α、lL-1β、lL-6含量与空白组比较,模型组小鼠血清内TNF-α、IL-1β、IL-6含量显著升高(P<0.05)。与模型组比较,安肠汤低、中、高剂量组及美沙拉嗪组小鼠血清TNF-α、IL-1β、IL-6 含量显著降低(P<0.05),其中美沙拉嗪组含量明显下降(P<0.05);以安肠汤低、中、高剂量干预后,以高剂量组TNF-α、IL-1β、IL-6 含量降低最明显(P<0.05),但均略差于美沙拉嗪组。见表3。
表3 各组大鼠结肠组织匀浆上清TNF-α、lL-1β及lL-6含量比较(±s)pg/mL
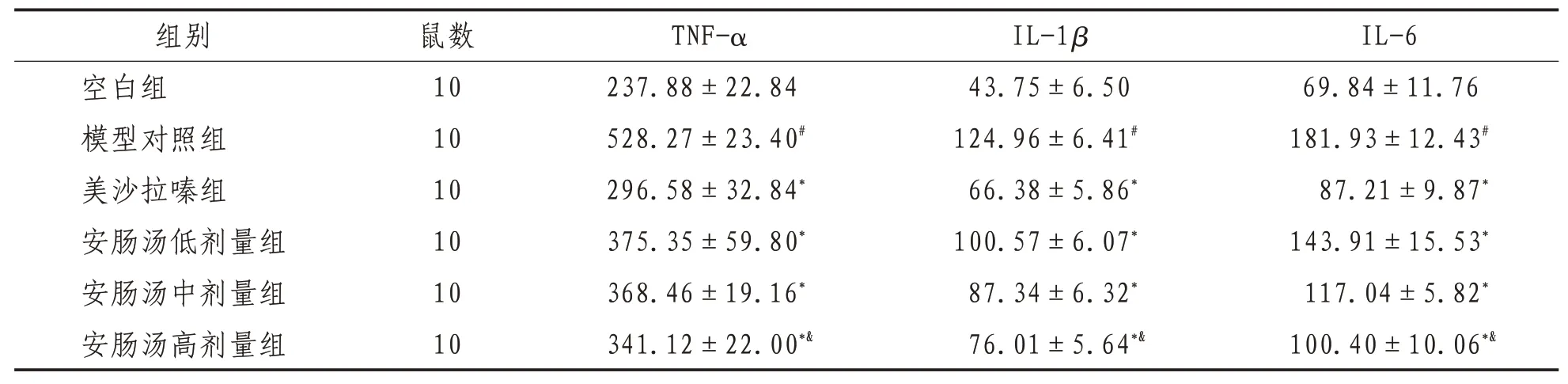
表3 各组大鼠结肠组织匀浆上清TNF-α、lL-1β及lL-6含量比较(±s)pg/mL
注:#表示与空白组比较,P<0.05;*表示与模型对照组比较,P<0.05;&表示与美沙拉嗪组比较,P<0.05
?
2.4 大鼠的结肠组织TRAF6、lRAK1、p-NF-κB、NF-κB表达与空白组比较,模型组大鼠结肠组织TRAF6、IRAK1、p-NF-κB、NF-κB蛋白表达量明显增高(P<0.05);与模型组比较,美沙拉嗪组和安肠汤低、中、高组大鼠结肠组织TRAF6、IRAK1、p-NF-κB、NF-κB 蛋白表达量显著降低(P<0.05);与美沙拉嗪组比较,安肠汤高剂量组大鼠结肠组织TRAF6、IRAK1、p-NF-κB、NF-κB 蛋白表达量显著降低(P<0.05)。见表4,图2。
表4 各组大鼠结肠组织中TRAF6、lRAK1、p-NF-κB、NF-κB的表达量比较(±s) kD
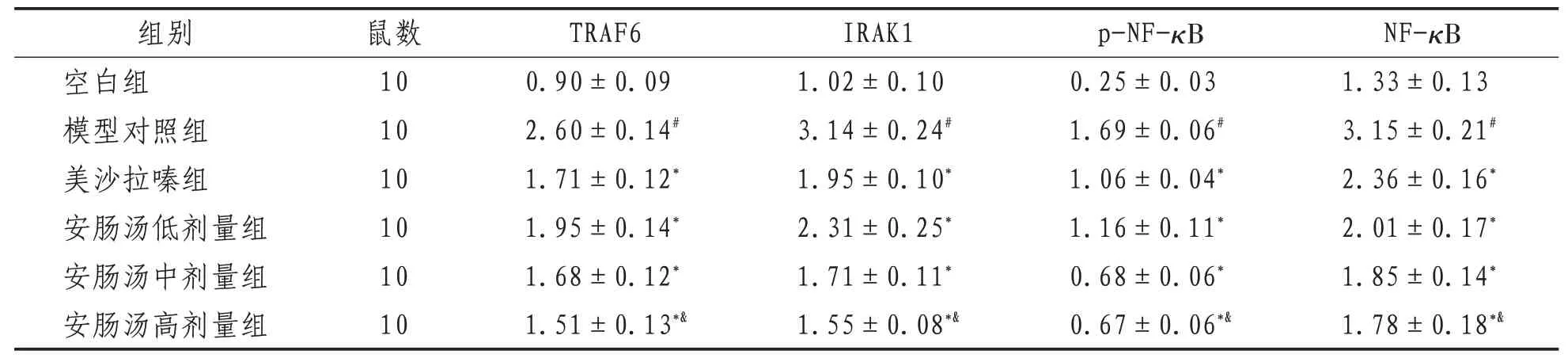
表4 各组大鼠结肠组织中TRAF6、lRAK1、p-NF-κB、NF-κB的表达量比较(±s) kD
注:#表示与空白组比较,P<0.05;*表示与模型对照组比较,P<0.05;&表示与美沙拉嗪组比较,P<0.05
?
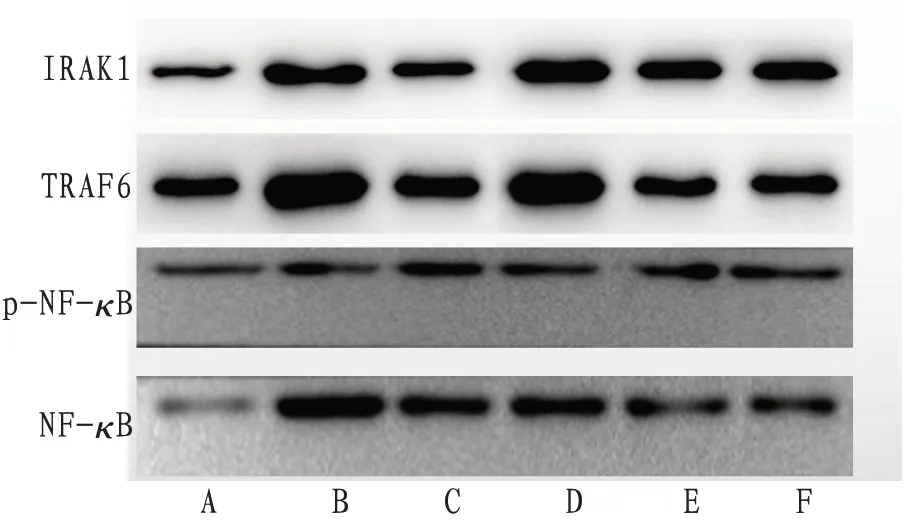
图3 Western blot检测小鼠结肠组织TRAF6、IRAK1、p-NF-κB、NF-κB的蛋白水平电泳图
3 讨论
3.1 UC 的病因和发病机制UC 的确切病因和发病机理至今仍然未知,但研究发现与肠道菌群失调和促炎介质的过表达密切相关[8-10]。前期研究结果显示,UC 大鼠的血清内毒素含量及粪便乙酸含量与其本病的严重程度成正相关,且安肠汤能明显降低UC 大鼠血清内毒素含量及粪便乙酸含量,调节肠道菌群,促进黏膜愈合[11]。
3.2 lRAK1 在NF-κB 信号通路传导中发挥关键作用目前发现的白细胞介素受体相关激酶(interleukin receptor related kinase,IRAK)共有4 个亚型,即IRAK1、IRAK2、IRAK3 和IRAK4,它们均可参与生物体的炎症反应过程[12-13],并在生物体中细胞因子或相关致病受体的下游信号通路传导中发挥关键作用[14]。研究表明,当白细胞介素受体1 被激活后,在细胞内吸引相关分子黏附进而激活IRAK1分子,成功被激活后IRAK1分子可调控NF-κB相关信号的转导,进而参与炎症细胞的增殖、侵袭等过程[15]。陈建翠等[16]研究发现,下调IRAK1 基因能调控NF-κB 信号通路并且抑制宫颈 癌细 胞生 长。XIAOFEN X 等[17]证 实IRAK1 和STAT3可协同上调IL-10的转录。
3.3 TRAF6主要通过经典途径活化NF-κB信号通路肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor related factor,TRAF6)是一个作用广泛的泛素连接酶,属于肿瘤坏死因子超家族,当其被激活的时,能够开启细胞内相关的信号通路。目前已知的TRAFs家族蛋白共有7种,标记为TRAF1~7。其中TRAF6 是细胞内最为重要的信号转导蛋白,具有特异性的受体结合[18-20],介导着细胞膜上多种信号通路的传导,TRAF6主要通过经典途径活化NF-κB信号通路,当机体受到炎症因子刺激后导致TRAF6 发生聚集作用,通过激活NF-κB 诱导激酶并使NF-κB 活化,启动NF-κB 信号通路并调控机体的免疫和炎性反应[21]。
3.4 NF-κB信号通路调控炎症因子的表达NF-κB信号通路在细胞的炎症反应、应激反应、免疫应答等过程中起到非常关键的作用[22-23],如IRAK、TRAF6等细胞因子可以结合细胞膜表面的受体,激发NF-κB 信号通路改变基因的表达,被活化的NF-κB可以游离至细胞核,激活或抑制多种κB 相关基因的转录,影响TNF-α、IL-1β、IL-6 和IL-10 等炎症因子的表达,这些促炎因子在UC 发生、发展及转归中发挥重要作用[24]。TNF-α、IL-6 和IL-1β都是促炎细胞因子,可调节血管内皮细胞的上内皮分子分泌,促进中性粒细胞对这些细胞因子的黏附[25]。TNF-α 的分泌诱导着广泛的生理和致病现象,如影响着细胞增殖、分化、死亡、基因转录及炎症的调节[26]。IL-6则是由活化的T细胞和成纤维细胞产生的一种细胞因子[27],在调节机体免疫、炎性等过程发挥重要作用[28-29]。IL-1β是一种通过促进血管因子生成而发挥抗皮质素作用的细胞因子,可使内皮细胞存、增殖[30]。
3.5 安肠汤能够通过TRAF6/lRAK1/NF-κB信号通路对UC 的炎症活动进行调控本实验中,qPCR结果显示,TRAF6、IRAK1、NF-κB mRNA 相对表达量在模型组中的表达高于正常组,在美沙拉嗪组和安肠汤组(低、中、高组)的表达量均低于模型组,提示美沙拉嗪肠溶片和安肠汤对TRAF6、IRAK1、NF-κB mRNA 相对表达量均有抑制作用,而安肠汤高剂量组的抑制作用略好于美沙拉嗪组。Western blot 结果显示,模型组大鼠结肠组织TRAF6、IRAK1、p-NF-κB、NF-κB 蛋白表达明显高于空白组,在美沙拉嗪组、安肠汤组(低、中、高)中低于模型组,提示美沙拉嗪肠溶片和安肠汤的干预对TRAF6、IRAK1、p-NF-κB、NF-κB 蛋白的表达均有抑制作用,安肠汤高剂量组的抑制作用略优于美沙拉嗪组。与此相对应的是,大鼠血清中炎症因子TNF-α、IL-1β、IL-6 的表达在模型组均明显高于空白组;在美沙拉嗪组及安肠汤组(低、中、高)均明显低于模型组,提示美沙拉秦肠溶片和安肠汤都能够抑制该信号通路末端炎症因子的表达,且美沙拉秦肠溶片的作用较强于安肠汤。
综上所示,安肠汤能抑制UC 肠黏膜炎症反应,且与肠黏膜损伤修复有密切关系,我们推测安肠汤能够通过TRAF6/IRAK1/NF-κB信号通路对UC的炎症活动进行调控,从而修复受损肠黏膜。然而安肠汤是复方中药方剂,其组成的的化学成分复杂,其确切的抗UC 组分及详细的作用机制有待于进一步研究。

