COS对抗菌蛋白ANG4在肠道表达的诱导作用
贺宇文 汤冠宇 李楚楚 李灿 纪春晓 陈韬
摘 要:血管生成素4(ANG4)是一种新型抗菌肽蛋白,具有抗菌、抗炎、血管生成、调节机体免疫反应等多种生物学功能,在机体先天免疫过程中发挥重要的作用。ANG4在新生小鼠肠道的表达受到多种因素的调节,如细菌信号和发育过程等。本试验选取细菌细胞壁表面分子的类似物壳寡糖(COS)作为诱导物,探究其对小鼠肠道ANG4表达和对肠道形态的影响。实时荧光定量聚合酶链式反应(qRT-PCR)和蛋白质免疫印迹(Western blot)分析表明,COS能增加小鼠肠道ANG4 mRNA及ANG4蛋白的表达;形态学观察结果显示,COS使小肠绒毛高度明显增加,平均隐窝深度均有降低,V/C值增加,表明COS可通过诱导ANG4等抗菌蛋白的表达,或通过其杀菌和免疫调节作用而不同程度地提高小肠黏膜的完整性。研究结果为COS以及ANG4在仔猪肠道疾病防治的应用提供了理论依据。
关键词:ANG4;COS;抗菌蛋白;实时荧光定量PCR;蛋白质免疫印迹
中图分类号:Q78 文献标志码:ADOI:10.3969/j.issn.1007-7146.2023.03.006
Inducing Effects of COS on Expression of Antimicrobial Protein ANG4 in Intestine
HE Yuwen2, TANG Guanyu1, 3, LI Chuchu1, LI Can1, JI Chunxiao1, CHEN Tao1, 3*
(1. College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Provincial Institution of Veterinary Drug and Feed Control, Changsha 410006, China; 3. Hunan Veterinary Drug Engineering and Technology Research Center, Changsha 410128, China)
Abstract: Angiogenin 4 (ANG4), a novel antimicrobial protein with multiple biological functions, such as antimicrobial, anti-inflammation, angiogenesis and regulating the bodys immune response, plays a key role in innate immunity. The expression of ANG4 in neonatal mice intestine is regulated by some factors including microbial signal and developmental stage. Being an analogue of surface molecules of bacterial cell wall, chitosan oligosaccharide (COS) was selected as a inducer to explore the effects on ANG4 expression and mophology in post weaning mice intestine. qRT-PCR and Western blot analyses showed that the mRNA and protein levels of ANG4 increased suggesting that COS can upregulate the expression of ANG4. The results of HE staining of mouse intestinal tract showed that the height of intestinal villi, the depth of crypt and the value of V/C increased significantly. It indicates that COS can improve the integrity of intestinal mucosae in some extent through either inducing the expression of some intestinal antimicrobial proteins, such as ANG4, or its antimicrobial and immunomodulation activities, and provide the theoretical basis for the applications of COS and ANG4 in controlling the intestinal diseases in piglets.
Key words: ANG4; COS; AMPs; qRT-PCR; Western blot
(Acta Laser Biology Sinica, 2023, 32(3): 234-239)
血管生成素(angiogenin,ANG)在上世紀70年代被Folkman等作为肿瘤的血管生成因子分离,可参与实体肿瘤的形成、发展和迁移过程中极为重要的步骤[1]。近年来许多研究表明,ANG不仅能促进血管的生成,还能从多方面影响炎症的发生以及肠道菌群的稳态[2-3]。ANG与血管内皮生长因子(vascular endothelial growth factor,VEGF)协同参与血管的形成以及调节血管内皮通透性。ANG4属于血管生成素家族,小鼠ANG4成熟蛋白由144个氨基酸残基组成,分子质量约16 kD[4] ,是一种新型的抗菌蛋白,具有多种生物学功能,如促进血管生成[5]、促进黑色瘤细胞的增殖[6]和抗炎作用等[7]。ANG4主要在肠道和胰腺中表达[8],对肠道中的细菌具有选择性毒性,如1 ?mol/L的ANG4处理2 h就能杀灭99%以上的致病菌粪肠球菌(Enterococcus faecalis)和单增李斯特氏菌 (Listeria monocytogenes),而肠道共生菌大肠杆菌K12(Escherichia coli)可耐受高达10 ?mol/L的ANG4[9]。Hooper等[9]在小鼠小肠内发现了ANG4 mRNA,其主要在小肠的潘氏细胞中表达,且表达受到细菌信号的调节,尤其在小鼠断奶后期表达量可升高30多倍,这意味着ANG4在小鼠断奶后的免疫撤除和应激中发挥了重要的作用。
壳寡糖(chitosan oligosaccharide,COS)是氨基葡萄糖或乙酰氨基葡萄糖通过β-1, 4糖苷键连接而成的聚合度为2~20的功能性低聚糖[10],在结构上与细胞壁的主要成分肽聚糖(peptidoglycan,PG)和脂多糖(lipopolysaccharide,LPS)相似。COS具有抗菌[11]、抗氧化[12]、免疫调节和抗炎[13-14]等功能,同时COS还具有相对分子质量低、生物活性高、水溶性较好、无毒、易被动物体吸收利用等优点[10]。因此,COS作为饲料添加剂被广泛应用畜牧业生产。
本实验室以前的研究表明,COS作为PG的类似物能明顯上调小鼠肠道组织表达抗菌蛋白RegIIIγ[15]。本研究拟以COS为诱导物,观察其对ANG4表达和肠道形态的影响,为断奶仔猪腹泻的防治提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
此动物试验的所有程序均符合《实验动物护理和使用指南》,动物的使用经过湖南农业大学动物伦理委员会(43321503)的批准。本试验所用昆明小鼠(Mus musculus)购于湖南嘉泰实验动物有限公司[许可证号:SCXK(湘)2015-00100]。选择12只怀孕母鼠(SPF级),饲养于湖南农业大学动物医学院第三教学楼动物房,正常采食与饮水。
1.1.2 主要试剂
小鼠ANG4多抗(上海强耀生物);β-actin、HRP标记山羊抗兔二抗(谷歌生物公司);Trizol(Takara生物技术有限公司);10%中性福尔马林固定液、0.9%生理盐水、COS溶液配制、30%聚丙烯酰胺溶液、1×电泳缓冲液、1×转膜缓冲液、10×TBS、TBST、封闭液等均由实验室自行配制。
1.2 方法
1.2.1 试验设计与取样
将12只孕鼠分笼饲养于动物饲养房中,平均温度为(23±2)℃,相对湿度为(50±10)%,正常采食与光照。母鼠产仔后新生小鼠用于试验。COS处理参照孟江海等[15],选定3个剂量组(200、600、1 000 mg/kg)。随机选取80只17日龄的小鼠(雌雄各半)用于试验,每组各20只小鼠。试验开始后,试验组开始连续灌胃COS溶液,对照组灌胃同样体积的生理盐水;各组分别于19、21、23、25 d取5只小鼠处死,取小鼠十二指肠、空肠、回肠、结肠组织分别储存,用于实时定量聚合酶链式反应(quantitative real-time PCR,qRT-PCR)、蛋白质免疫印迹(Western blot)和组织切片分析。
1.2.2 qRT-PCR检测小鼠肠道ANG4 mRNA的表达
小鼠肠道总RNA提取与qRT-PCR方法参照向琼昊等[16]所用方法,委托上海启因生物公司完成。qRT-PCR反应完成后,采用ΔΔCT法计算检测基因mRNA相对表达量。
1.2.3 Western-blot检测小鼠肠道ANG4蛋白的表达
肠道组织蛋白提取、定量及Western blot分析方法参照林梦雨等[17]所用方法,并用Image-Lab软件分析蛋白表达水平。
1.2.4 组织切片观察小鼠肠道组织变化
将小鼠肠道组织取出,用生理盐水冲洗后放入中性福尔马林固定液中固定后用于苏木精-伊红染色(hematoxylin-eosin staining, HE)[15],将切片置于显微镜下观察并采集图像。
1.3 数据处理与分析
本试验所有数据分析与作图均使用GraphPad Prism软件,并用t检验等方法对相关数据进行差异显著分析。所有试验均重复3次,P>0.05则统计无显著差异;P<0.05则统计为差异显著,标记为*;P<0.01则统计为差异极显著,标记为**。
2 结果与分析
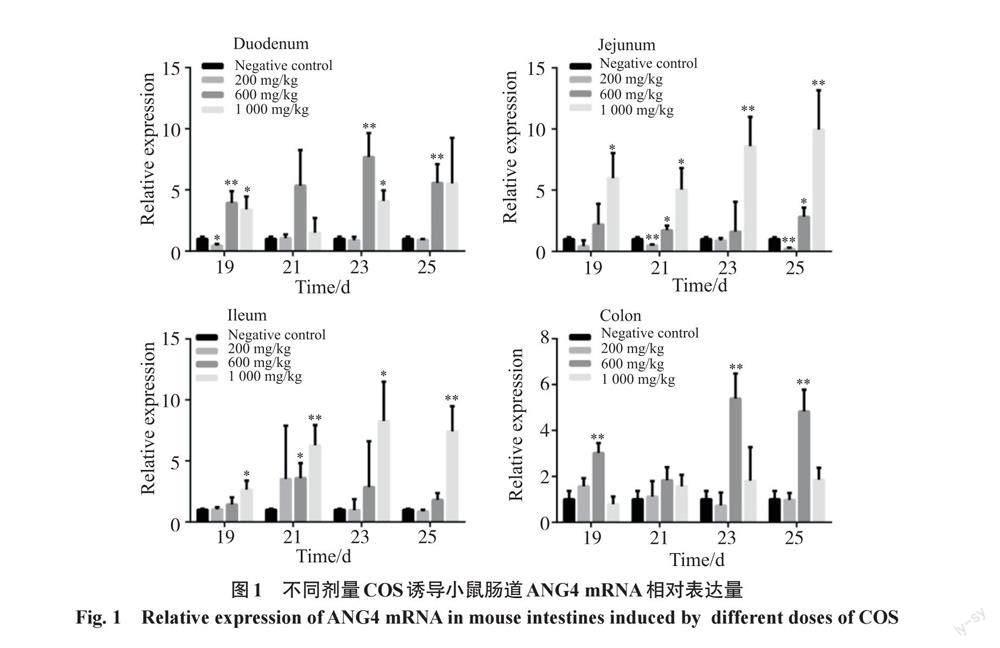
2.1 不同剂量COS诱导对小鼠肠道ANG4 mRNA表达的影响
通过qRT-PCR分析(图1),不同剂量的COS对ANG4 mRNA表达的影响是不同的:其中200 mg/kg组无论是在4个不同的部位,还是不同的时间点,ANG4的表达均无明显变化,在空肠甚至还有降低;而600和1 000 mg/kg组中ANG4 mRNA的表达均有显著上调,但剂量效应并不明显;同时在十二指肠、空肠和回肠中还表现出随发育阶段表达水平逐渐升高的趋势,但差异不明显,而这种变化趋势在结肠中并不明显。比较小肠不同部位ANG4 mRNA的表达水平,可以发现,600和1 000 mg/kg 2个剂量组中,十二指肠、空肠和回肠的整体表达水平要高于结肠。
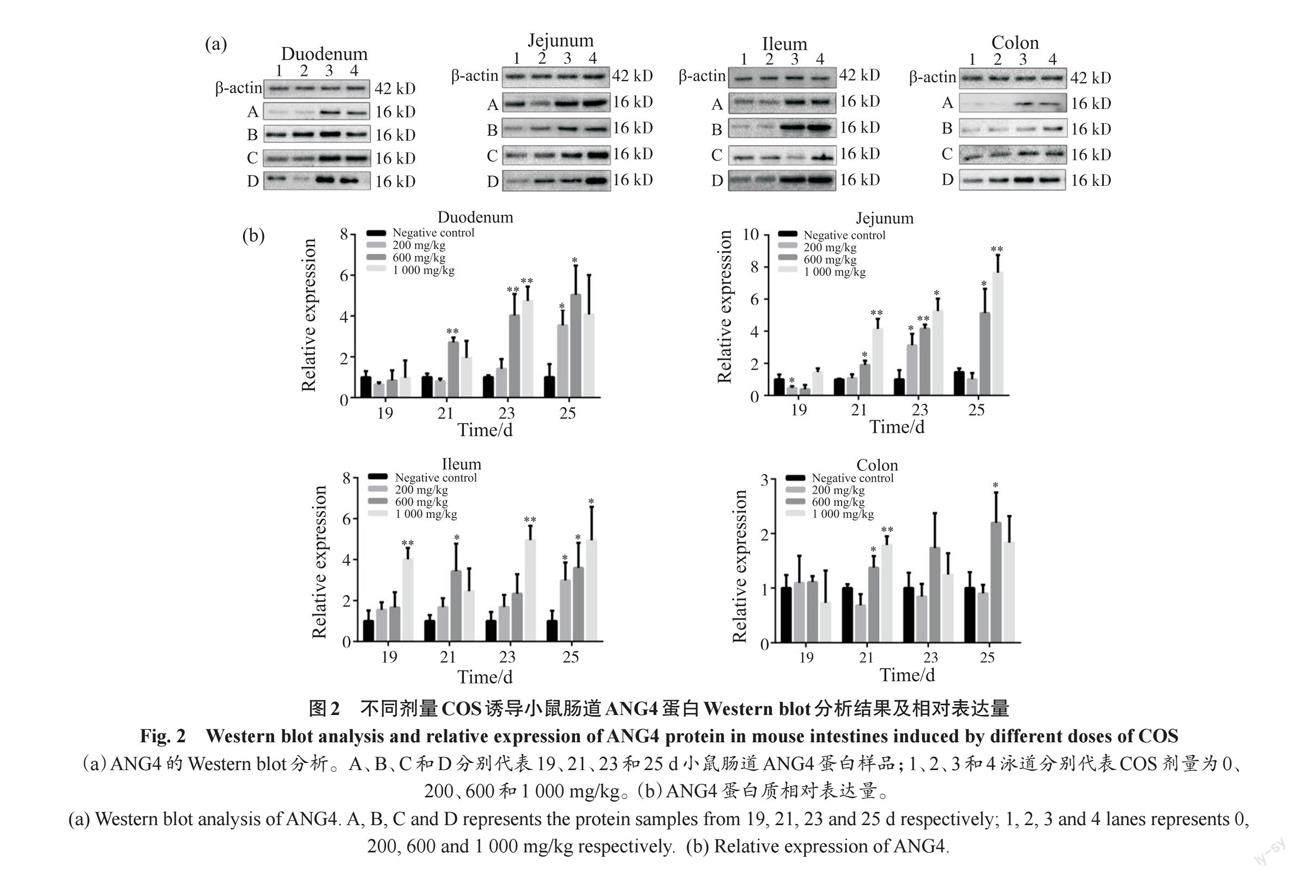
2.2 不同剂量COS诱导对小鼠肠道ANG4蛋白
表达的影响
COS对小鼠肠道ANG4蛋白表达水平的影响见图2。和对照组相比,在200 mg/kg剂量组的十二指肠、空肠和回肠中ANG4表达水平无明显变化,不过在25 d稍有升高(P<0.05);而600和1 000 mg/kg 2个组则从21 d 开始就有明显上调(P<0.05),且呈现出随发育时间而升高的趋势,但2个剂量组的蛋白表达量与COS剂量无明显相关性;和小肠相比,结肠中的ANG4表达水平相对较低,和小肠相同的是200 mg/kg COS处理对ANG4的表达几乎没有影响,而600和1 000 mg/kg COS处理增加了ANG4的表达,这一结果与mRNA检测结果相符。
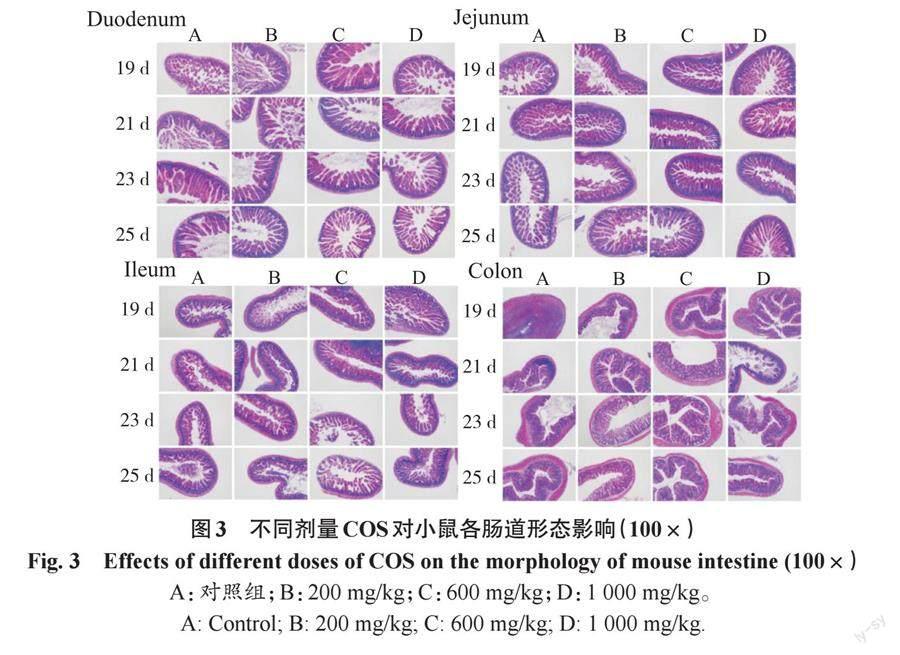
2.3 不同剂量COS对小鼠肠道形态的影响
本试验通过HE染色来观察小鼠肠道不同节段的绒毛长度和隐窝深度以及其形态变化,结果如图3所示。所有剂量组与对照组相比,肠黏膜的整体结构无明显差异,但4个肠段的肠绒毛排列更加紧密。
從图4可以看出,不同剂量的COS处理对于小肠的绒毛长度、隐窝深度、绒毛长度/隐窝深度比值(villus length/crypt depth,V/C)均有一定的影响。相对来说,200 mg/kg剂量组的影响最小,在十二指肠中以600 mg/kg剂量组更加明显,肠绒毛的高度增加,十二指肠隐窝深度有所下降,V/C值整体升高,除23和25 d的隐窝深度差异显著(P<0.05)外,其他均没有显著性差异(P>0.05)。而在空肠和回肠中1 000 mg/kg剂量的影响更加明显。比较小肠的3个节段,COS处理对回肠形态的影响最大,1 000mg/kg剂量的隐窝深度和V/C值均出现了明显的变化(P<0.05)。
3 讨论
仔猪在断奶期由于免疫撤除、母源抗体的缺失、饲料的改变、换栏等多种原因造成的应激,使其抵抗外来微生物的能力减弱,很容易引起断奶期仔猪的腹泻,而腹泻又是造成断奶仔猪死亡的重要原因。作为一种新型的抗菌蛋白,ANG4的表达在受到断奶刺激或者外来病原微生物的刺激后会增多,这意味着ANG4在断奶期的先天免疫过程中发挥了重要的作用。本试验以小鼠作为试验动物,利用不同剂量的COS作为诱导物来灌胃小鼠,观察其对肠道抗菌蛋白ANG4的表达以及肠道形态的影响,为ANG4在断奶仔猪腹泻防治中的应用提供理论基础。
ANG4在小鼠肠道中的表达受到发育和细菌信号的双重调控[18],在新生小鼠的肠道中几乎不表达,到断奶时其表达水平可提高约30倍,在这一阶段,无菌和常规饲养的小鼠ANG4的表达水平接近,但随后其表达水平出现了明显的差异,常规饲养小鼠ANG4的表达水平明显高于无菌小鼠,表明在这一阶段细菌信号可诱导ANG4的表达[9]。细菌可通过其细胞壁的表面分子如PG或LPS作为配体,与模式识别受体(pattern recognition receptor,PRR)即TLRs(toll like receptors)结合,激活相应的信号途径诱导多种抗菌蛋白的产生[19]。本项目组前期报道了采用灭活金黄色葡萄球菌(Staphylococcus aureus,G+)及其表面分子PG[20]、灭活大肠杆菌(Escherichia coli,G-)及其表面分子LPS[21]来处理猪小肠上皮细胞IPEC-J2细胞,均能诱导抗菌蛋白RegIIIγ的表达。COS是一种结构上与PG和LPS类似的化合物,具有抗菌、抗炎和免疫调节等多种生物学功能,作为饲料添加剂广泛地应用于畜牧业生产中。孟江海等[15]给断奶期间的小鼠连续灌胃COS,发现能提高小肠中RegIIIγ的表达。本试验共选取200、600和1 000 mg/kg 3个COS剂量,对断奶后的小鼠进行连续COS灌胃,并在mRNA和蛋白质水平来检测ANG4的表达变化,发现除200 mg/kg处理无明显影响外,600和1 000 mg/kg处理均可增加ANG4 mRNA和蛋白质的表达,表达水平呈现出随发育而逐渐升高的趋势,但无明显剂量效应;同时还发现,ANG4在小肠的表达水平明显高于结肠,这一结果与Hooper等[9]的报道相符。而向琼昊等[16]报道了新生仔猪小肠和结肠的ANG4的表达特征,结果显示,小肠和结肠均能产生ANG4,且表达水平比较接近,这与本研究结果有差别,造成这一差别的原因可能与小鼠和猪分属不同物种有关。
小肠是动物消化吸收的主要器官,其形态变化可影响机体的消化和吸收,同时小肠黏膜分泌的多种抗菌蛋白可以抵御外来微生物的入侵,预防肠道疾病的发生。小肠绒毛长度、隐窝深度、V/C值是衡量小肠形态的重要指标。小肠绒毛越长,小肠吸收营养物质的面积就越大[22]。在肠绒毛中只有成熟的绒毛上皮细胞才具有吸收营养的功能,所以,绒毛高度与细胞数量呈显著相关。同时在小肠不同节段中,回肠是吸收的主要部位,其形态的变化对于吸收功能具有直接的影响。形态学观察结果显示,COS处理对小鼠小肠不同节段整体结构无明显影响,但对绒毛高度、隐窝深度和V/C值有一定的影响。十二指肠的绒毛的高度略有增加,隐窝深度有所下降,V/C值整体升高,3个剂量中以600 mg/kg对其形态的影响更明显一些;和十二指肠相比,COS处理对小鼠的空肠和回肠的影响更加明显,尤其是回肠,1 000 mg/kg处理组中3个指标均出现了显著的变化(P<0.05),可能与其是小肠中绒毛最丰富的部分有关。在这些指标的变化中,绒毛高度的增加一方面可能是由于COS的处理能诱导抗菌蛋白RegIIIγ[15]和ANG4表达的升高,前者具有促进细胞增殖和损伤修复功能,同时二者均具有抗炎的作用[18],对于绒毛的完整性具有一定的促进作用,另一方面也与COS本身具有抗菌和免疫调节功能有关[11,13]。
综上所述,COS可以诱导小鼠肠道ANG4的表达,同时对小肠的形态结构有一定的影响,有利于小肠的消化和吸收。鉴于以上研究结果,可以设想ANG4在畜牧养殖行业中的畜禽肠道疾病,尤其是断奶仔猪腹泻防治中有着十分广阔的应用前景。
参考文献(References):
[1] FETT J W, STRYDOM D J, LOBB R R, et al. Isolation and characterization of angiogenin, an angiogenic protein from human carcinoma cells[J]. Biochemistry, 1985, 24(20): 5480-5486.
[2] STRYDOM D J. The angiogenins[J]. Cellular and Molecular Life Sciences, 1998, 54(8): 811-824.
[3] SUN D S, BAI R P, ZHOU W, et al. Angiogenin maintains gut microbe homeostasis by balancing α-Proteobacteria and Lachnospiraceae[J]. Gut, 2021, 70(4): 666-676.
[4] PREMZL M. Comparative genomic analysis of eutherian Ribonuclease A genes[J]. Molecular Genetic Genomics, 2014, 289 (2): 161-167.
[5] LEE H, CHO C, HWANG S, et al. Biological characterization of angiopoietin-3 and angiopoietin-4[J]. The FASEB Journal, 2004, 18(11): 1200-1208.
[6] CRABTREE B, HOLLOWAY D E, BAKER M D, et al. Biological and structural features of murine angiogenin-4, an angiogenic protein[J]. Biochemistry, 2007, 46(9): 2431-2443.
[7] LEE S H, KIM K W, MIN K M, et al. Angiogenin reduces immune inflammation via inhibition of TANK-binding kinase 1 expression in human cornealfibroblast cells[J]. Mediators of Inflammation, 2014, 2014: 1-12.
[8] BIRNEY E, ANDREWS D, CACCAMO M, et al. Ensembl 2006[J]. Nucleic Acids Research, 2006, 34: 556-561.
[9] HOOPER L V, STAPPENBECK T S, HONG C V, et al. Angiogenins: a new classof microbicidal proteins involved in innate immunity[J]. Nature Immunology, 2003, 4(3): 269-273.
[10] SHUANG L, SUN Y, DAI X. A Review of the preparation, analysis and biological functions of chitooligosaccharide[J]. International Journal of Molecular Sciences, 2018, 19(8): 1-19.
[11] HAFIZUR R M, RAHMAN S L, GORDON H L, et al. Inhibition of fungal plant pathogens by synergistic action of chito-oligosaccharides and commercially available fungicides[J]. PLoS One, 2014, 9(4): e93192.
[12] 彭皓, 趙芳芳, 张艳芳, 等. 糖工程与壳寡糖的概述及其应用研究进展[J]. 饲料与畜牧, 2012(11): 14-18.
PENG Hao, ZHAO Fangfang, ZHANG Yanfang, et al. Overview and application advance of glycoengineer and COS[J]. Feed and Husbandry, 2012 (11): 14-18.
[13] YANG E J, KIM J G, KIM J Y, et al. Anti-inflammatory effect of chitosanoligosaccharides in RAW 264.7 cells[J]. Central European Journal of Biology, 2010, 5(1): 95-102.
[14] YOON H J, MOON M E, PARK H S, et al. Chitosan oligosaccharide (COS) inhibits LPS-induced inflammatory effects in RAW 264.7 macrophage cells[J]. Biochemical & Biophysical Research Communications, 2007, 358(3): 954-959.
[15] 孟江海. 壳寡糖对抗菌蛋白RegIIIγ表达的诱导作用[D]. 长沙: 湖南农业大学, 2021.
MENG Jianghai. Induction effect of COS on the expression of a nove antibacterial protein RegIIIγ[D]. Changsha: Hunan Agricultural University, 2021.
[16] 向琼昊, 杜霞, 孟江海, 等. 猪ANG4在小肠表达的特征及细胞类型[J]. 激光生物学报, 2019, 28(1): 40-45.
XIANG Qionghao, DU Xia, MENG Jianghai, et al. Expression patterns and cell type of porcine ANG4 in small intestine[J]. Acta Laser Biology Sinica, 2019, 28(1): 40-45.
[17] 林梦雨, 吴洁, 杜霞, 等. 猪RegIIIγ在小肠表达的特征及细胞类型[J]. 激光生物学报, 2017, 26(6): 565-569.
LIN Mengyu, WU Jie, DU Xia, et al. Expression patterns and cell type of porcine RegIIIγ in small intestine[J]. Acta Laser Biology Sinica, 2017, 26(6): 565-569.
[18] GALLO R L, HOOPER L V. Epithelial antimicrobial defence of the skin and intestine[J] Nature Review Immunology, 2012, 12(7): 503-516.
[19] LEBEER S, VANDERLEYDEN J, DE KEERSMAECKER S C J. Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens[J]. Nature Review Microbiology, 2010, 8(3): 171-184.
[20] 杜霞. RegIIIγ蛋白在IPEC-J2细胞中表达调控的分子机理[D]. 长沙: 湖南农业大学, 2019.
DU Xia. Molecular mechanisms of RegIII gamma protein expression and regulation in IPEC-J2 cells[D]. Changsha: Hunan Agriculural University, 2019.
[21] 孟江海, 向琼昊, 宋云云, 等. 灭活大肠杆菌与脂多糖诱导猪肠黏膜上皮细胞表达RegⅢγ的机理研究[J]. 中国畜牧兽医, 2021, 48(3): 846-854.
MENG Jianghai, XIANG Qionghao, SONG Yunyun, et al. Mechanism study on inactivated E. coli and lipopolysaccharide co-induced IPEC-J2cells expressing RegⅢγ[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(3): 846-854.
[22] 劉秋东, 张中文, 刘凤华, 等. 复方白头翁胶囊对腹泻犬小肠绒毛长度和隐窝深度的影响[J]. 北京农学院学报, 2011, 26(3): 38-40.
LIU Qiudong, ZHANG Zhongwen, LIU Fenghua, et al. Effects of herbal medicine on villus height and cryptdepth in small intestine of canine[J]. Journal of Beijing University of Agriculture, 2011, 26(3): 38-40.

