构建宫颈癌铜死亡相关基因的预后模型和预测免疫治疗反应
薛莘子 赵悦 张丹 徐丹颖 王侠


摘 要:为了探究铜死亡相关基因在宫颈癌(CC)中的預后价值,从TCGA数据库下载CC患者的临床资料,随机分为训练组和验证组。通过单因素Cox、LASSO-Cox和多因素Cox分析筛选出铜死亡相关基因,构建风险模型。通过Kaplan-Meier曲线分析两个亚组和整个队列的总生存期(OS)、受试者工作特征曲线(ROC)和主成分分析(PCA)验证模型的预后价值。通过单因素和多因素分析来评价临床特征和风险评分的独立预后价值。利用基因本体(GO)和京都基因与基因组百科全书(KGEE)富集分析两个亚组间的生物学功能和途径,并进一步分析了两个亚组对药物的敏感性。最终构建了5个与铜死亡相关基因(FXD1、ARF1、APP、HSF1、MT1A)的预后模型。从风险评分的生存曲线来看,低风险组的OS远超过高风险组,且预后良好(P<0.05)。单因素和多因素Cox分析表明,风险评分是独立的预后因素(P<0.001)。根据ROC和PCA证明了预后模型的预测能力。利用ROC曲线分析评估风险评分和其他临床特征(如年龄、分级和分期)的敏感性和特异性,结果表明,风险评分的预后价值优于其他临床特征。富集分析结果表明,基因功能主要富集于细胞外基质、细胞外结构。根据肿瘤免疫功能障碍与排斥(TIDE)算法,低风险组患者的免疫治疗疗效优于高风险组。此外还发现24种药物的敏感性在两个亚组中的显著差异。本研究建立了5个铜死亡相关基因组成的预后风险模型,并证明了该模型可以准确预测患者的预后,且低风险评分的患者更易从免疫治疗中获益,为临床个体化治疗提供理论依据。
关键词:宫颈癌;铜死亡相关基因;风险模型;免疫治疗;预后
中图分类号:R737.3 文献标志码:ADOI:10.3969/j.issn.1007-7146.2023.03.009
Construction of the Prognostic Model for Cuproptosis-related Genes Prediction of the Immunotherapy Response in Cervical Cancer
XUE Xinzi1, ZHAO Yue1, ZHANG Dan1, XU Danying1, WANG Xia2*
(1. Graduate school, Xuzhou Medical University, Xuzhou 221000, China;
2. Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China)
Abstract: To explore the prognostic value of cuproptosis-related genes in cervical cancer, the clinical data of cervical cancer patients were downloaded from the TCGA database and randomly divided into training group and validation group. Cuproptosis-related genes were screened out by univariate Cox, LASSO-Cox and multivariate Cox analysis, and the risk model was constructed. Overall survival (OS) of the two subgroups and the entire cohort was analyzed by Kaplan-Meier curve, and the prognostic value of the model was verified by ROC curve and PCA. Univariate and multivariate analyses were performed to evaluate the independent prognostic value of clinical features and risk scores. The biological functions and pathways between the two subgroups were analyzed by gene ontology (GO) and Kyoto encyclopedia enrichment of genes and genomes (KGEE), and the sensitivities of the two subgroups to drugs were further analyzed. Finally, prognostic models of five cuproptosis-related genes (FDX1, ARF1, APP, HSF1, MT1A) were constructed. From the survival curve of risk score, OS in the low-risk group was much higher than that in the high-risk group, and the prognosis was good (P<0.05). By univariate and multivariate Cox analysis, risk score an independent prognostic factor (P<0.001). The predictive power of the prognostic model was demonstrated by receiver operating characteristic curve (ROC) and principal component analysis (PCA). ROC curve analysis was used to assess the sensitivity and specificity of risk scores and other clinical features, such as age, grade, and stage. And the results showed that the prognostic value of risk scores was superior to other clinical features. The results of enrichment analysis showed that gene function was mainly concentrated in extracellular matrix and extracellular structure. According to TIDE algorithm, immunotherapy efficacy of patients in the low-risk group was superior to that in the high-risk group. In addition, significant differences were found in the sensitivity of 24 drugs between the two subgroups. The study established a prognostic risk model composed of 5 cuproptosis-related genes, and proved that the model can accurately predict the prognosis of patients. And patients with low risk score are more likely to benefit from immunotherapy, which provides theoretical basis for clinical individualized therapy.
Key words: cervical cancer; cuprotosis related genes; risk model; immunotherapy; prognosis
(Acta Laser Biology Sinica, 2023, 32(3): 259-271)
宫颈癌(cervical cancer,CC)是女性生殖系统最常见的恶性肿瘤之一,手术、化疗和放疗已成为其传统治疗方法[1-2]。早期CC的局部病灶可通过手术、放疗或化疗获得良好的疗效,而传统治疗对晚期/复发性妇科肿瘤效果不佳,5年生存率仅16.8%。因此,晚期/复发性CC的治疗非常棘手,当一线治疗方案(顺铂、紫杉醇联合贝伐珠单抗)失败时,后续治疗的有效率非常低,预后极差。近几年热点的免疫治疗为这些晚期/复发性CC患者提供了新的治疗选择,甚至为治疗无望的患者带来了治愈的可能[3-5]。然而,梁金晓等[6]的研究表明,免疫药物对大多数晚期/复发性妇科肿瘤患者无效(原发性耐药),或疗效持续时间短(继发性耐药),这成为免疫治疗的瓶颈[7]。已有研究[8-9] 表明,免疫治疗对复发或晚期CC患者疗效显著,并取得了很大突破。目前,临床上常用的预测药物疗效的分子标志物预测价值有限。因此,寻找更有效的分子标志物以及可能对免疫治疗有效的患者,及时准确地评估免疫治疗的疗效,具有重要的临床意义。
Tsvetkov等[10]在2022年首次提出了一种全新的、具有铜依赖性的细胞死亡模式——“铜死亡(cuprotosis)”。不同于其他被知晓的细胞死亡模式,如凋亡、焦亡和坏死,相对于锌死亡和铁死亡,铜死亡是一种金属离子诱导的调节性细胞死亡,与线粒体呼吸密切相关[10-11]。机体内铜的摄取、排泄以及代谢受多种因素调节并保持动态平衡。其过多或过少都会导致一定的后果,过少会影响与金属结合酶的结合,使其功能异常;过多则会破坏细胞,导致细胞死亡[12-13]。而越来越多的证据表明,铜代谢与肿瘤发生有关,肿瘤细胞比正常细胞需要更高水平的铜[14-17]。一些肿瘤细胞表达高水平脂酰化的线粒体蛋白,并表现出高水平的呼吸活性。各种类型的癌症已被证明与肿瘤组织中銅含量的增加和(或)体内铜分布的改变有关(如乳腺癌[15]、CC[17]),并且减少肿瘤内铜离子含量可以增强免疫治疗。因此,在铜代谢过程中涉及的因素可能成为CC患者的潜在预后标志物和治疗靶点。
本研究基于癌症基因组图谱(the cancer genome atlas program,TCGA)数据库,筛选出5个与铜死亡相关的基因,构建风险评分模型,并进一步验证了该模型具有一定的预测价值。此外,研究中免疫治疗的疗效评价及药物敏感性对后续临床治疗更具指导意义。
1 材料与方法
1.1 收集数据
从TCGA数据库中获得CC患者的临床资料。本研究包括304例临床信息的样本,包括年龄、分级、临床TNM分期(tumor node metastasis classification)。从既往文献中获得19个铜死亡相关基因,结合分子特征数据库(GOBP_CELLULAR_COPPER_ION_HOMEOSTASIS, GOBP_CELLULAR_RESPONSE_TO_COPPER_ION)并剔除重复,最终筛选出49个铜死亡相关基因[10,18-19]。
1.2 构建预后模型
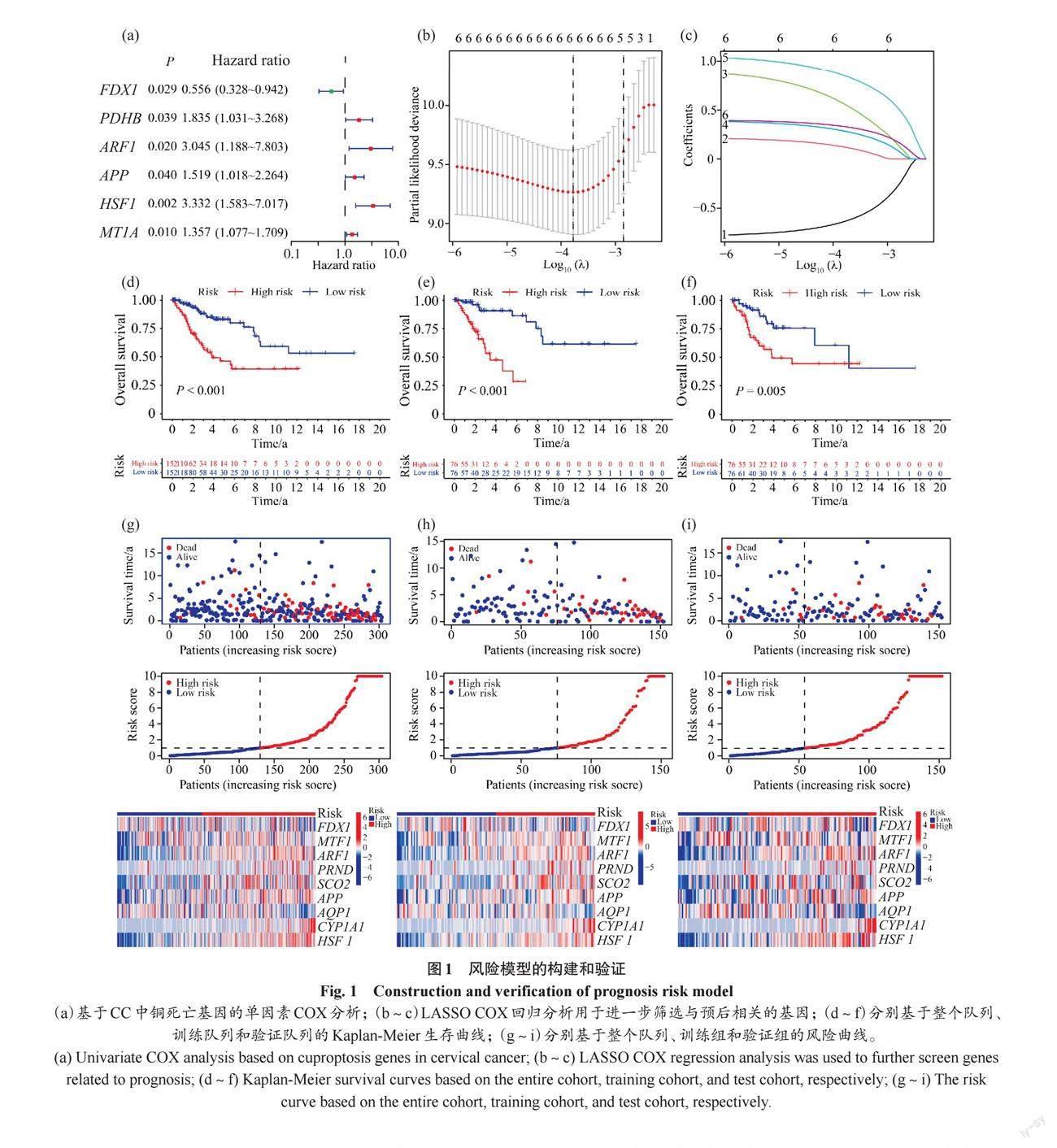
将304名CC患者分为训练组和验证组,结果显示,这两个亚组的临床特征没有显著差异。利用单因素、LASSO‐Cox回归[20]和多因素Cox回归分析筛选铜死亡相关基因,并根据风险评分计算公式计算每个患者的风险评分。风险评分=FDX1×(-0.743 203 703 700 511)+ARF1×1.014 682 357 424 06 + APP×0.439 512 746 165 105 +HSF1×1.123 473 309 358 06 + MT1A×0.407 713 075 452 012。
1.3 验证风险模型
将临床数据与风险评分相结合,计算出中位风险评分和相应系数,根据结果将训练组和验证组的患者分为高危组和低危组。利用单因素和多因素Cox分析来进一步确定风险评分是否是独立的预后因素。利用Kaplan-Meier曲线分析高、低风险组的总生存期(overall survival,OS)。此外,主成分分析(principal component analysis,PCA)和受试者工作特征曲线(receiver operating characteristic curve,ROC)用于评估预后模型的预测能力。使用单因素和多因素Cox回归来验证风险模型的独立预后作用并建立列线图,并且通过绘制校准曲线评估列线图的准确性。
1.4 预后风险评分与临床分期关系的探讨
为了评估不同分期预后模型的预测价值,并将其应用于不同临床分期的患者,采用单因素和多因素Cox回归分析研究风险评分与临床分期的关系。
1.5 肿瘤内免疫细胞浸润和免疫治疗的评价
为了分析风险评分与免疫细胞及功能之间的相关性,使用单样本基因集合富集分析(single sample gene set enrichment analysis,ssGSEA)来评估肿瘤免疫细胞的浸润和功能,并构建相关热图。通过肿瘤免疫功能障碍与排斥(tumor immune dysfunction and exclusion,TIDE)算法模拟肿瘤免疫逃逸机制来预测免疫治疗疗效[21],计算患者的得分,分析两个亚组免疫治疗的反应。
1.6 功能富集分析
对筛选出的铜死亡相关基因进行基因本体论(gene ontology,GO)功能分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,分析其生物学机制和相关信号通路。
1.7 计算肿瘤突变负荷分数
肿瘤突变负荷(tumor mutational burden,TMB)与肿瘤免疫治疗反应密切相关[22-23]。使用从TCGA数据库下载的CC患者样本的突变数据,比较两个亚组之间的突变分数,并分析其与风险评分的关系。瀑布图直观地揭示了风险评分和TMB之间的关系。
1.8 药物敏感性评价
IC50(half maximal inhibitory concentration)代表受试拮抗剂的半数抑制浓度。共有138种药物被纳入肿瘤药物敏感性基因组学数据库(genomics of drug sensitivity in cancer,GDSC)。通过“pRRophetic”和“ggplot2”软件包[24],分析常见抗肿瘤药物在高危组和低危组中的敏感性差异,并用箱线图进行可视化分析。
2 结果与分析
2.1 风险模型的构建与验证
基于TCGA数据库,我们选取了49个铜死亡相关基因和304个临床资料,通过单因素Cox分析和LASSO-Cox回归分析筛选出6个铜死亡相关基因(图1a),并确定了基因回归系数的轨迹变化和模型构建的交叉验证结果(图1b~1c)。随后进行多次多因素COX回归分析,筛选出5个与预后相关的基因来建立预后模型。根据中位风险评分将患者分为高、低风险组。风险评分的Kaplan-Meier曲线表明,风险评分高的CC患者预后差,OS低(P<0.05,图1d~1f)。通过图1g~1i,我们可以看到风险分值的分布和患者的存活率,随着风险评分的增加,死亡人数增加,存活时间减少。如图2a显示,低风险组患者的无进展生存期(progression free survival,PFS)明显高于高风险组患者(P<0.001)。通过以上分析,我们可以得出结论:随着风险评分的增加,患者的死亡风险增加,生存时间减少,预后差。
2.2 预后因素的独立预后价值和临床特征
为了验证风险评分和其他临床数据是否可以作为独立的预测因素,我们进行了单因素和多因素Cox回归。结果显示:在单因素分析(图2b)中,T分期和风险评分是独立的预后因素(P<0.001);在多因素分析(图2c)中,风险评分仍是5个临床特征中的独立预后因素(P<0.001)。ROC曲线下面积(area under curve,AUC)结果分析表明,此模型具有较高的预测能力和准确性(图2d),1年、3年和5年的AUC分别为0.751、0.736和0.748。利用ROC曲线分析了风险评分、年龄、分级和分期的敏感性和特异性(图2e)。此外,我们还通过C指数分析得出,风险评分的敏感性和特异性明显高于其他临床特征(图2f)。基于诺模图,评估每个预后因素对CC患者1年、3年和5年OS的预测能力(图2g)。从图2h可以看出,校准图与诺模图的预测结果非常吻合。为了更好地应用于临床,我们研究了不同分期与风险评分的关系。结果显示,风险评分可以准确预测不同临床分期患者的预后(P<0.05,图3a~3b)。此外,PCA分析揭示了两组之间的高度差异(图3c~3d)。通过比较高危组和低危组的13种免疫功能富集谱,我们发现,9种免疫功能富集谱在两个亚组是不同的,并且它们都在低风险组中富集(图3e)。
2.3 功能富集分析
通过差异表达基因(differential expressed genes,DEGs)的GO和KEGG富集分析高低风险组人群之间的生物学功能和途径的差异,进一步筛选出对生物体有意义的基因,为不同风险群体的预后结局及药物治疗效果差异提供证据。GO分析由生物过程、细胞组成和分子功能分析组成。生物过程主要涉及细胞外基质组织、细胞外结构组织和对生长因子刺激的反应。在细胞成分中,它主要集中在含胶原蛋白的细胞外基质、内质网腔、基底膜和血液微粒。分子功能主要与细胞外基质结构成分、受体配体活性和信号受体激活剂活性有关(图4a、4c、4e)。KEGG分析表明,基因主要富集于人类白细胞抗原、T细胞共刺激、炎症促进、检查点和抗原提呈细胞联合抑制(图4b、4d、4f)。基因集变异分析(gene set variation,GSVA)用于比较高风险组和低风险组之间的基因富集途径(图5a~5b)。
2.4 肿瘤免疫细胞浸润和免疫治疗的评价
使用ESTIMATE算法比较CC高危组和低危组之间的间质评分、免疫评分、估计评分和肿瘤纯度(圖6a~6b),结果显示,CC患者的低风险组具有较高的免疫评分和估计评分,但肿瘤纯度较低。为了进一步探讨肿瘤细胞与免疫浸润之间的关系,基于ssGSEA,计算出23种免疫细胞的免疫浸润分数。如图6c所示,Activated B cell(P<0.001)、Activated CD4 T cell(P<0.001)、Activated CD8 T cell(P<0.001)、Immature B cell(P<0.001)和MDSC(P<0.01),这些免疫浸润细胞在高危组和低危组存在显著差异,在低风险组体内有较高丰度的抗肿瘤免疫细胞,这可能部分解释了亚组间预后的显著差异。最后,我们使用CIBERSORT算法评估风险评分以及模型相关基因与肿瘤免疫浸润细胞的相关性(图6d)。根据TIDE算法结果显示,高危组与低危组之间的TIDE评分有统计学意义,低危组患者的免疫治疗疗效优于高危组(P<0.001,图6e)。
2.5 肿瘤突变负荷
瀑布图显示了两组中突变频率最高的15个基因。图7a~7b 结果显示,TTN是低风险组和高风险组中突变分数最高的基因。TMB是近年来在多种肿瘤免疫治疗中发现的可用于预测免疫治疗的独立生物标记物[25]。高TMB患者产生的新抗原多,肿瘤会被大量肿瘤特效异性T细胞攻击,抗PD-1/PD-L1抗体治疗可以使肿瘤T细胞反应得以更充分的发挥,因此,高TMB的患者对免疫检查点抑制剂治疗临床获益更大(图7c)。肿瘤突变负荷和风险评分的的组合生存分析相结合可以得到组合生存曲线。图7d 结果表明, TMB和风险评分的组合可以更有效地预测生存率,对CC患者的OS有显著影响。
2.6 药物敏感性与风险评分的关系
为了研究CC患者的风险评分与药物IC50的关系,以P<0.05为筛选标准,共获得24种药物,分析了24种常见抗癌药物在高危组和低危组之间的敏感性,如图8~9所示。其中阿糖胞苷(cytarabine)、伊马替尼(imatinib)、米哚妥林(midostaurin)和帕唑帕尼(pazopanib)在高危人群中具有更低的IC50值和更低的风险,这表明高危人群中的患者对这些药物高度敏感。而贝利司他(belinostat)等药物对低危患者的敏感性较高。通过上述结果,我们可以在临床上针对不同的患者群体提供针对性的药物,从而改善患者的预后。
3 讨论
铜死亡是一种新发现的细胞死亡方式,关于CC铜死亡相关基因的研究很少有论文发表,本研究就铜死亡相关基因与CC预后及免疫治疗的反应展开讨论。在本研究中,通过单因素、多因素及LASSO-Cox分析筛选出5个基因(FDX1、ARF1、APP、HSF1、MT1A)。ARF1可能激活以高尔基体为主平台的MAPK通路,进而激活细胞质RSK1,导致细胞增殖[26]。Zhang等[27] 的研究表明,FDX1与葡萄糖代谢、脂肪酸氧化和氨基酸代谢密切相关,也是肺腺癌治疗的潜在靶点。还有研究表明,FDX1可能通过影响各种癌症类型中的免疫浸润来调节肿瘤免疫微环境,其表达可能与治疗反应的评估有关,FDX1可能成为癌症监测和未来研究的生物标志物和潜在治疗靶点[28]。据报道,APP与人类恶性肿瘤相关,如结肠癌、胰腺癌、肺癌、甲状旁腺癌、乳腺癌、甲状腺癌和前列腺癌[29]。根据APP表达研究,APP沉默减少了癌症增殖,促进了细胞凋亡并增加了治疗敏感性[30]。有证据表明,HSF1通过MDTH-VEGF- C的表达促进CC的侵袭和转移[31],Hurley等[32]揭示了HSF1信号通路可以抑制肝母细胞瘤细胞的凋亡。综上所述,这些基因在癌症的发生进展中起重要作用,但在CC中具体的作用机制还需要进一步探索。
随后,本文对上述风险模型进行了验证,Kaplan-Meier曲线显示,高危组的CC患者预后不良(P<0.05)。AUC结果表明,该模型具有较高的预测能力。C指数曲线和ROC曲线结合临床特征分析表明,风险评分的预测准确率高于其他临床特征,其临床应用前景广阔。GO、KEGG富集分析表明,表达量有差异的基因都集中在细胞外的构成和功能上,由此可以推测,细胞外的构成和功能参与了癌症的发生发展。ssGSEA结果说明,肿瘤组织里面还包含有很多免疫细胞,其中Activated B cell、Activated T cell、Activated CD8 T cell、Immature B cell是适应性免疫细胞执行抗肿瘤功能。 MDSC是先天性免疫细胞具有免疫抑制功能,在抗肿瘤中起着关键作用,并且在低风险组患者的肿瘤微环境中具有更多的抗肿瘤免疫浸润细胞。此外,本研究发现低危组的TIDE评分明显高于高危组,高TMB的肿瘤患者具有获得更多新生抗原的潜力,能增强肿瘤免疫原性以及与免疫检查点抑制剂的反应,在临床上免疫治疗获益更好。这些发现日后都可以成为预测免疫治疗有效性的工具,更好地服务于临床。此次研究筛选出的24种药物,其药物敏感性在两个组别中差异有统计学意义,为临床治疗中的药物选择提供了理论支持。
首先,由于本研究只使用TCGA数据库中的数据,具有局限性;其次,我们没有进行外部验证,增加模型预测的可靠性和真实性;最后,利用生物信息学已经筛选出的基因,其具体作用机制目前还未阐明,需要进一步探讨研究。
总的来说,本研究构建了CC铜死亡相關基因预后模型,并验证了其预测的准确性和诊断价值,低风险组的患者对免疫治疗的疗效优于高风险组,可以在后续的临床治疗中为患者提供更精确的治疗方案,改善CC患者的预后。
参考文献(References):
[1] COHEN P A, JHINGRAN A, OAKNIN A, et al. Cervical cancer [J]. The Lancet, 2019, 393(10167): 169-182.
[2] FERRALL L, LIN K Y, RODEN R B S, et al. Cervical cancer immunotherapy: facts and hopes [J]. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 2021, 27(18): 4953-4973.
[3] POST C C B, WESTERMANN A M, BOSSE T, et al. PARP and PD-1/PD-L1 checkpoint inhibition in recurrent or metastatic endometrial cancer [J]. Critical Reviews in Oncology/Hematology, 2020, 152: 102973.
[4] SHIMOKAWA M, KOGAWA T, SHIMADA T, et al. Overall survival and post-progression survival are potent endpoint in phase III trials of second/third-line chemotherapy for advanced or recurrent epithelial ovarian cancer [J]. Journal of Cancer, 2018, 9(5): 872-879.
[5] TEWARI K S, SILL M W, PENSON R T, et al. Bevacizumab for advanced cervical cancer: final overall survival and adverse event analysis of a randomised, controlled, open-label, phase 3 trial (Gynecologic Oncology Group 240) [J]. Lancet (London, England), 2017, 390(10103): 1654-1663.
[6] 梁金晓, 黄纯娴, 林仲秋. 妇科恶性肿瘤免疫治疗进展 [J]. 国际妇产科学杂志, 2022, 49(2): 191-195.
LIANG Jinxiao, HUANG Chunxian, LIN Zhongqiu. Progress in immunotherapy of gynecologic malignant tumors [J]. International Journal of Obsterics and Gynecology, 2022, 49(2): 191-195.
[7] TOPALIAN S L, TAUBE J M, PARDOLL D M. Neoadjuvant checkpoint blockade for cancer immunotherapy [J]. Science (New York, NY), 2020, 367(6477): eaax0182.
[8] CHUNG H C, ROS W, DELORD J P, et al. Efficacy and safety of pembrolizumab in previously treated advanced cervical cancer: results from the phase II KEYNOTE-158 study [J]. Journal of Clinical Oncology, 2019, 37(17): 1470-1478.
[9] NAUMANN R W, HOLLEBECQUE A, MEYER T, et al. Safety and efficacy of nivolumab monotherapy in recurrent or metastatic cervical, vaginal, or vulvar carcinoma: results from the phase I/II checkmate 358 trial [J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2019, 37(31): 2825-2834.
[10] TSVETKOV P, COY S, PETROVA B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins [J]. Science (New York, NY), 2022, 375(6586): 1254-1261.
[11] JIANG X, STOCKWELL B R, CONRAD M. Ferroptosis: mechanisms, biology and role in disease [J]. Nature Reviews Molecular Cell Biology, 2021, 22(4): 266-282.
[12] KAHLSON M A, DIXON S J. Copper-induced cell death [J]. Science (New York, NY), 2022, 375(6586): 1231-1232.
[13] 刘骏达, 钟薇薇, 鲁显福, 等. 铜死亡与铜代谢相关疾病研究进展 [J]. 江蘇大学学报 (医学版), 2022, 32(4): 318-325.
LIU Junda, ZHONG Weiwei, LU Xianfu, et al. Research progress of cuproptosis and diseases related to copper metabolism [J]. Journal of Jiangsu University (Medicine Edition), 2022, 32(4): 318-325.
[14] ATAKUL T, OZLEM A S, ABAS BURCIN I, et al. Serum copper and zinc levels in patients with endometrial cancer [J]. Biological Trace Element Research, 2020, 195(1): 46-54.
[15] FENG Y, ZENG J W, MA Q, et al. Serum copper and zinc levels in breast cancer: a meta-analysis [J]. Journal of Trace Elements in Medicine and Biology, 2020, 62: 126629.
[16] PAVITHRA V, SATHISHA T G, KASTURI K, et al. Serum levels of metal ions in female patients with breast cancer [J]. Journal of Clinical and Diagnostic Research, 2015, 9(1): BC25-BC27.
[17] ZHANG M, SHI M, ZHAO Y. Association between serum copper levels and cervical cancer risk: a meta-analysis [J]. Bioscience Reports, 2018, 38(4): BSR20180161.
[18] CHEN B, ZHOU X, YANG L, et al. A cuproptosis activation scoring model predicts neoplasm-immunity interactions and personalized treatments in glioma [J]. Computers in Biology and Medicine, 2022, 148: 105924.
[19] LEI L, TAN L, SUI L. A novel cuproptosis-related gene signature for predicting prognosis in cervical cancer [J]. Frontiers in Genetics, 2022, 13: 957744.
[20] SIMON N, FRIEDMAN J, HASTIE T, et al. Regularization paths for coxs proportional hazards model via coordinate descent [J]. Journal of Statistical Software, 2011, 39(5): 1-13.
[21] JIANG P, GU S, PAN D, et al. Signatures of T cell dysfunction and exclusion predict cancer immunotherapy response [J]. Nature Medicine, 2018, 24(10): 1550-1558.
[22] LI Y, CHEN Z, TAO W, et al. Tumor mutation score is more powerful than tumor mutation burden in predicting response to immunotherapy in non-small cell lung cancer [J]. Cancer Immunology, Immunotherapy, 2021, 70(8): 2367-2378.
[23] SHA D, JIN Z, BUDCZIES J, et al. Tumor mutational burden as a predictive biomarker in solid tumors [J]. Cancer Discovery, 2020, 10(12): 1808-1825.
[24] GEELEHER P, COX N, HUANG R S. pRRophetic: an R package for prediction of clinical chemotherapeutic response from tumor gene expression levels [J]. PLoS One, 2014, 9(9): e107468.
[25] READY N, HELLMANN M D, AWAD M M, et al. First-line nivolumab plus ipilimumab in advanced non-small-cell lung cancer (checkmate 568): outcomes by programmed death ligand 1 and tumor mutational burden as biomarkers [J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2019, 37(12): 992-1000.
[26] ZHOU F, DONG C, DAVIS J E, et al. The mechanism and function of mitogen-activated protein kinase activation by ARF1 [J]. Cellular Signalling, 2015, 27(10): 2035-2044.
[27] ZHANG Z, MA Y, GUO X, et al. FDX1 can impact the prognosis and mediate the metabolism of lung adenocarcinoma [J]. Front Pharmacol, 2021, 12: 749134.
[28] XIAO C, YANG L, JIN L, et al. Prognostic and immunological role of cuproptosis-related protein FDX1 in pan-cancer [J]. Frontiers in Genetics, 2022, 13: 962028.
[29] TAKAGI K, ITO S, MIYAZAKI T, et al. Amyloid precursor protein in human breast cancer: an androgen-induced gene associated with cell proliferation [J]. Cancer Science, 2013, 104(11): 1532-1538.
[30] LIM S, YOO B K, KIM H S, et al. Amyloid-β precursor protein promotes cell proliferation and motility of advanced breast cancer [J]. BMC Cancer, 2014, 14: 928.
[31] SHI X, DENG Z, WANG S, et al. Increased HSF1 promotes infiltration and metastasis in cervical cancer via enhancing MTDH-VEGF-C expression [J]. Oncotargets and Therapy, 2021, 14: 1305-1315.
[32] HURLEY E H, TAO J, LIU S, et al. Inhibition of heat shock factor 1 signaling decreases hepatoblastoma growth via induction of apoptosis [J]. American Journal of Pathology, 2023, 193(2): 148-160.

