维生素C/白藜芦醇纳米复合脂质体制备及其抗氧化性研究
李蔓 吴晓娟 刘腊梅 周研 司瑾 何晓晓


摘 要:本文以具有親疏水特点的磷脂分子为基质材料,采用薄膜水化法制备了一种同时包载脂溶性白藜芦醇(Res)和水溶性维生素C(VC)的纳米复合脂质体(Lip@Res/VC),并将其用于细胞抗氧化研究。在Lip@Res/VC的制备过程中,以Res和VC的包封率以及脂质体的粒径、多分散指数和电位为指标,考察了Res和VC的最佳投入量。研究结果表明,分别选择Res为4.0 mg和VC为3.5 mg的投入量,制备的Lip@Res/VC的水合粒径为(92.29±5.41)nm,Res和VC的包封率分别为(85.13±5.37)%和(64.73±5.51)%。体外1,1-二苯基-2-三硝基苯肼(DPPH)和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸二胺盐(ABTS)自由基清除试验结果显示,Lip@Res/VC的抗氧化活性较只包载了Res的单一脂质体Lip@Res或只包载了VC 的单一脂质体Lip@VC均显著提高。通过选择正常肝细胞(L02细胞)为模式细胞,研究了Lip@Res/VC的细胞内抗氧化效果,结果显示,Lip@Res/VC具有清除细胞内活性氧(ROS)的能力,对过氧化氢诱导的L02细胞氧化损伤具有保护作用。
关键词:纳米复合脂质体;白藜芦醇;维生素C;活性氧;抗氧化
中图分类号:Q819文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.03.005
A Study on the Preparation and Antioxidant Activity of Vitamin C/Resveratrol Nanocomposite Liposomes
LI Man #, WU Xiaojuan#, LIU Lamei, ZHOU Yan, SI Jin, HE Xiaoxiao*
(College of Biology, State Key Laboratory of Chemical Biosensing and Chemometrics, Key Laboratory for Bio-Nanotechnology and Molecular Engineering of Hunan Province, Hunan University, Changsha 410082,China)
Abstract: By using phospholipid molecules with hydrophilic and hydrophobic properties as matrix materials, the nanocomposite liposomes (Lip@Res/VC) containing both fat-soluble resveratrol (Res) and water-soluble vitamin C (VC) have been prepared through thin film hydration method and have been further used for cellular antioxidant studies. In the preparation of Lip@Res/VC, the optimal added amount of Res and VC were determined by evaluating the encapsulation rate of Res and VC, hydration particle size, polydispersal index and zeta potential of nanocomposite liposomes. The results showed that the hydration particle size of Lip@Res/VC was (92.29±5.41) nm and the encapsulation efficiency of Res and VC were (85.13±5.37)% and (64.73±5.51)%, when the added amount of Res was 4.0 mg and VC was 3.5 mg, respectively. The DPPH (2, 2-diphenyl-1-picrylhydrazyl) and ABTS [2, 2'-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt] free radical scavenging assay in vitro showed that the antioxidant activity of Lip@Res/VC was significantly higher than that of Lip@Res or Lip@VC. Furthermore, L02 cells were selected as model cells to study the intracellular antioxidant effect of Lip@Res/VC. The results showed that Lip@Res/VC is capable of removing intracellular reactive oxygen species (ROS) and protecting L02 cells from oxidative damage induced by hydrogen peroxide.
Key words: nanocomposite liposomes; resveratrol; vitamin C; reactive oxygen species; antioxidant
(Acta Laser Biology Sinica, 2023, 32(3): 226-233)
人體内参与过氧化氢(H2O2)、超氧阴离子(O2·–)等活性氧(reactive oxygen species,ROS)产生的细胞机制有多种途径,如炎症反应、黄嘌呤氧化酶的激活等。当ROS浓度超过人体抗氧化机制的保护时,会导致氧化应激和细胞损伤[1];此外,氧化应激也被认为与癌症、神经退化和衰老等疾病相关 [2-3],因此,ROS的清除具有重要作用。研究报道,摄入维生素等抗氧化剂可以有效抵御ROS[4],其中,维生素C(vitamin C,VC)是一种强大的自由基清除剂,通过清除自由基,避免氧化应激和细胞损伤,然而VC的稳定性不是太好,在相对较高的温度和湿度下很容易被氧化[5-6]。除维生素外,多酚类物质白藜芦醇(resveratrol,Res)因其抗氧化活性而在多种疾病中发挥药理保护作用[7],成为研究的热点。尽管在几种体外模型研究中显示Res具有独特的保护作用,但临床研究表明其对人体的作用相对较小,这主要与Res的药代动力学和溶解性有关。为了克服溶解度的限制,有研究发现,将多酚载入脂质体等水溶性载体中可提供化学和生物保护[8-9]。脂质体由磷脂等极性脂质组成,具有良好的生物相容性,既适合亲水性药物也适合脂溶性药物的递送[10]。并且大豆卵磷脂含有多种脂肪酸,如多不饱和脂肪酸,这是人体所必需的[11]。因此,脂质体是一种有吸引力的药物载体[4,12]。基于此,本文利用薄膜水化法制备了同时包埋Res和VC的纳米复合脂质体(Lip@Res/VC),通过优化两种物质的投入量来达到两种活性成分的最大包封率。体外测定了Lip@Res/VC对1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸二胺盐 [2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS] 的自由基清除率。同时,以人正常肝细胞系(L02)为模式细胞,进一步考察了Lip@Res/VC的细胞内ROS清除能力。
1 材料和方法
1.1 主要仪器及试剂
ABTS、过硫酸钾(K2S2O8)、Res、VC、DPPH购自上海麦克林生化科技有限公司;大豆卵磷脂和胆固醇购自生工生物工程(上海)股份有限公司;RPMI 1640培养基由本课题组统一配制;人正常肝细胞系(L02)由本课题组细胞中心提供。所用试剂如无特别说明均为试剂纯,所有溶液均采用超纯水制备。
RE-5250旋转蒸发仪(上海亚荣生化仪器厂,中国);JY96-II超声波细胞粉碎机(新芝生物科技股份公司,中国);JEM-2100透射电子显微镜(JEOL,日本);UV-2600紫外可见分光光度计(岛津,日本);CR22G高速冷冻离心机(日立,日本);M1000多功能酶标仪(TECAN,美国);Nano-ZS纳米粒度及Zeta电位仪(Malvern,英国)。
1.2 纳米复合脂质体Lip@Res/VC的制备
采用薄膜水化法制备纳米复合脂质体Lip@Res/VC[13] 。首先,称取Res适量,卵磷脂100.0 mg、神经酰胺30.0 mg、胆固醇20.0 mg溶于25 mL乙醇,完全溶解后,转移至茄形瓶中,40℃水浴条件下,在旋转蒸发仪上减压蒸干有机溶剂,茄形瓶内壁得到一层脂膜。然后,加入含有适量VC的PBS(pH 7.0,15 mL)溶液,在40℃水浴旋转水化得到脂质体溶液。最后,将水化的脂质体溶液在针状超声波细胞破碎仪(功率:100 W)中超声30 min,获得Lip@Res/VC。因试验对照需要,用相同方法制备空白脂质体(Lip)、只含有Res的脂质体(Lip@Res)和只含有VC的脂质体(Lip@VC),4℃下避光保存。
为了得到性能优良的Lip@Res/VC,在Lip@Res/VC的制备过程中,以Res和VC的包封率以及脂质体的粒径、多分散指数和电位为指标,考察了Res和VC的最佳投入量。具体试验操作为:只改变Lip@Res/VC制备时Res或VC的投入量(3.0、3.5、4.0、4.5、5.0 mg)而不改变其他条件,制备Lip@Res/VC。考察Res或VC的投入量对Lip@Res/VC中Res或VC的包封率以及粒径、多分散指数和电位的影响,确定Res和VC的最佳投入量。
1.3 纳米复合脂质体Lip@Res/VC的Res和VC
包封率测定
将上述制备的Lip@Res/VC溶液在高速离心机(5 000 r/min,5 min)中离心,得到上清,去除溶液中游离的Res。离心后的Lip@Res/VC溶液转入分子截留量(molecular weight cut-off,MWCO)为3 500 Da的透析袋,将透析袋放于300 mL的pH为7.0的磷酸盐缓冲液(phosphate buffered solution,PBS)中,室温下置于磁力搅拌器上,透析5 h除去Lip@Res/VC溶液中游离的VC。测量透析外液在265 nm处的紫外吸光值(absorbance,A),计算Lip@Res/VC中VC的包封率。取100 μL透析内液加入乙醇超声破乳,测定溶液在305 nm处吸光值,计算Lip@Res/VC中Res的包封率。采用上述相同的方法也分别测定了Lip@Res和Lip@VC两种脂质体中Res和VC的包封率。
1.4 ABTS和DPPH 自由基清除试验
根据文献报道的方法测定脂质体的DPPH和ABTS自由基清除能力[14]。DPPH自由基清除试验:将脂质体(100 μL)溶液与DPPH(3 mL,0.04 g/L)乙醇溶液混匀,避光反应30 min后测量其在517 nm处紫外吸光值,根据公式(1)计算:
ScavDPPH/%=×100% (1)
ABTS自由基清除试验:分别配制ABTS(7 mmol/L)准备液和K2S2O8(2.45 mmol/L)溶液,等比例混合两种溶液,黑暗静置12 h后制得ABTS溶液。用超纯水将ABTS溶液稀释至A734 nm=0.70±0.02,然后将 ABTS(4 mL)溶液与脂质体(50 μL)溶液混匀,避光反应30 min后测定其在734 nm处紫外吸光值,记为AS;将脂质体替换成超纯水,测得AK;将ABTS溶液替换成超纯水,测得AC;根据公式(2)计算:
ScavABTS/%=(1-)×100% (2)
1.5 纳米复合脂质体Lip@Res/VC的细胞内ROS清除试验
为了考察Lip@Res/VC细胞内ROS的清除效果,将L02细胞先接种于96孔板中,然后分为6组,分别为:L02,L02+100 ?mol/L H2O2,L02+100 ?mol/L H2O2+Lip,L02+100 ?mol/L H2O2+Lip@Res,L02+100 ?mol/L H2O2+Lip@VC和L02+100 ?mol/L H2O2+Lip@Res/VC。用PBS清洗孵育了24 h的细胞,再加入200 ?L含有上述不同分组样品的1640培养基溶液,继续孵育24 h后通过3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝 [3-(4,5-dimethyl-2-thiazolyl)-2, 5-diphenyl tetrazolium bromide,MTT]测定不同处理的L02细胞的细胞生存率。
1.6 纳米复合脂质体Lip@Res/VC的储存稳定性考察
将Lip@Res/VC于4℃和27℃下避光保存10 d,以其中Res和VC的保留率为参考,测量Lip@Res/VC的稳定性。按照1.2中的方法合成新的Lip@Res/VC并参照1.3中的方法測定其中Res和VC的包封率,在贮藏的第0、2、4、6、8和10天取样测量复合脂质体中Res和VC的包封率。Res和VC的保留率(Retention Rate)按照公式(3)计算:
Retention Rate /%=×100% (3)
其中,Cd代表贮藏一定时间后复合脂质体中Res或VC的包封率;C代表新制备时纳米复合脂质体中Res或VC的包封率。
2 结果与分析
2.1 试验原理
维生素C/白藜芦醇纳米复合脂质体(Lip@Res/VC)的制备原理如图1所示。脂质体是由两亲性磷脂分子自组装成的一个双分子层球体,核心是亲水的,而双分子层的内层是疏水的,可以同时包封水溶性和脂溶性活性物质。具体为以卵磷脂、胆固醇、神经酰胺为脂膜原料,利用薄膜水化的方法合成脂质体。为了将脂溶性活性成分Res载入双层脂质体的内层中,将Res预先与设计好的脂膜成分混合,一起进行薄膜旋转蒸发,成膜后加入含有VC的PBS缓冲液(pH 7.0)将脂膜水化形成脂质体;在脂质体形成过程中,脂溶性活性成分Res因疏水作用被隔离在自组装的双层脂质体的内层中,而水溶性的VC进行一个主动加载进入脂质体的亲水核心,最终获得Lip@Res/VC。
2.2 VC和Res投入量的优化结果
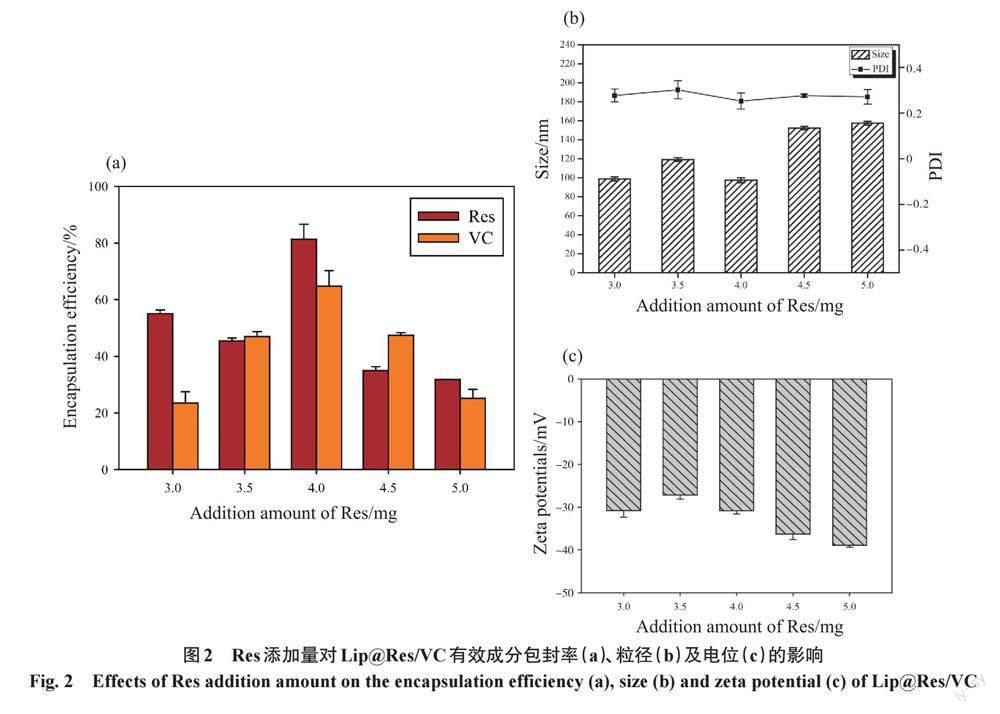
根据上述试验原理,在只改变合成体系中Res的投入量(3.0、3.5、4.0、4.5、5.0 mg)而不改变其他条件时,制备Lip@Res/VC,考察Res的投入量对Lip@Res/VC中VC的包封率、Res的包封率、脂质体粒径及电位的影响。如图2a所示,随着Res投入量的增加,VC的包封率先增高后降低,当Res的投入量为4.0 mg时,VC的包封率达到最大为(64.73±5.51) %。Res的包封率无规律性变化,但在Res的投入量为4.0 mg时也出现一个最大包封率。而且在Res的投入量为 4.0 mg时Lip@Res/VC水合粒径和聚合物分散性指数(polymer dispersity index,PDI)均最小(图2b)。所有脂质体均带有负电荷(图2c)。这些结果表明,适当增加Res的投入量可以提高活性成分VC的包封率及脂质体的分散均匀程度,综合包封率、粒径及PDI指数,选择Res的最终投入量为4.0 mg。
此外,只改变合成体系中VC的投入量(3.0、3.5、4.0、4.5、5.0 mg)而不改变其他条件,制备Lip@Res/VC,考察VC的投入量对Lip@Res/VC中Res的包封率、VC的包封率、脂质体粒径及电位的影响。如图3a所示,随着VC投入量的增加,Res的包封率无明显的规律变化,但当VC的投入量为3.5 mg时,Res的包封率达到最大为(85.13±5.37)%。VC的包封率也无规律性的变化,但在VC的投入量为5.0 mg时出现最低包封率为(32.55±2.89)%。Lip@Res/VC的水合粒径在VC的投入量为3.5 mg和5.0 mg时较小,而PDI指数趋势与水合粒径一致(图3b)。所有脂质体仍然均带有负电荷(图3c)。综合包封率、粒径及PDI指数,选择VC的最终投入量为3.5 mg。
图3 VC添加量对Lip@Res/VC有效成分包封率(a)、粒径(b)及电位(c)的影响
Fig. 3 Effects of addition amount of VC on the encapsulation efficiency (a), size (b) and zeta potential (c) of Lip@Res/VC
2.3 纳米复合脂质体Lip@Res/VC的表征
分别选择Res为4.0 mg和VC为3.5 mg的投入量,制备Lip@Res/VC后,采用高分辨透射电子显微镜(transmission electron microscope,TEM)和纳米粒度仪对所合成的Lip@Res/VC形貌和水合粒径进行了表征。脂质体样品均通过2%的磷钨酸复染后进行TEM成像。如图4a和4b所示,如同Lip一样,Lip@Res/VC的形态也呈球形且没有明显的破裂或黏连,这表明Res或者VC的包埋并不影响脂质体结构的完整性。此外,Lip@Res/VC的平均水合粒径为(92.29±5.41) nm,大于Lip的平均水合粒径(77.62±5.48)nm(图4c、4d),这可能是由于Lip@Res/VC包埋了Res和VC。
2.4 纳米复合脂质体Lip@Res/VC的体外ABTS和DPPH自由基清除效果
自由基的清除能力是天然活性物质抗氧化能力的重要评价标准[16-17]。Lip、Lip@VC、Lip@Res和Lip@Res/VC的自由基清除率如图5所示。尽管Lip中没有包埋活性物质,它的DPPH和ABTS自由基清除率仍分別有(9.24±0.98)%和(4.34±0.22)%,这可能是由于卵磷脂本身就具有自由基清除能力[14]。Lip@VC和Lip@Res对ABTS自由基的清除率分别为(23.45±0.12)%和 (49.96±4.00)%,与Lip相比分别增加了(19.11±0.16)%和(45.62±3.79)%,说明VC或者Res的加入可以提高脂质体的抗氧化能力。Lip@Res/VC相比于Lip的ABTS自由基的清除率增加了(65.39±2.99)%,明显高于Lip@Res和Lip@VC(图5a)。对DPPH自由基的清除率具有同样的趋势(图5b)。这些结果表明了Lip@Res/VC抗氧化能力的增加在很大程度上是由于Res和VC的共同作用。
2.5 纳米复合脂质体Lip@Res/VC的细胞内ROS清除效果
通常使用细胞内氧化模型来评估化合物对细胞内活性氧的清除能力。一般来说,H2O2是细胞中最常用的氧自由基发生器,能通过细胞膜渗透到细胞内部产生其他自由基,由此产生过量的ROS攻击生物分子,导致细胞损伤[18-20]。因此,通过构建H2O2诱导的L02细胞氧化应激模型来评价脂质体清除胞内ROS的能力。如图6所示,损伤组L02细胞在100 ?mol/L H2O2处理后,细胞存活率较对照组下降至(50.13±2.68)%。然而,当加入包埋活性成分的脂质体Lip@VC、Lip@Res和Lip@Res/VC与100 ?mol/L H2O2一起处理细胞后,L02细胞的存活率相比于损伤组分别增加到了(71.79±3.40) %、(65.43±2.46)%和(84.43±1.33)%,但Lip组细胞存活率仅为(53.57±3.07)%。这些结果表明,脂质体包埋Res或者VC可以提高细胞存活率,降低H2O2对L02细胞诱导的氧化损伤,具有细胞保护作用。这种细胞保护作用可能是由于其具有清除细胞内ROS的能力,而且Lip@Res/VC清除细胞内ROS的能力最强。
2.6 纳米复合脂质体Lip@Res/VC的储存稳定性考察
为了进一步考察在长时间的贮藏过程中,脂质体中包埋的活性物质是否会出现少量的泄漏释放。我们将Lip@Res/VC保存在不同的温度条件下,测量Res和VC的含量随时间的变化即保留率。如图7所示,在4℃和27℃的贮藏条件下随着时间的变化,Lip@Res/VC中VC和Res都存在少量释放的情况,因此保留率都呈现出下降趋势。但VC的保留率依然有80%以上(图7a),然而Res的保留率随着时间变化在4 d后呈现更明显的下降趋势,尤其在27℃条件下,保留率降至(50.71±3.77)%(图7b)。因此在温度更低的条件下更有利于纳米复合脂质体的贮藏,而Res的保留率明显低于VC,可能是由于Res在脂膜层的头基外区不稳定。
3 讨论
利用Res和VC溶解度的差异,通过薄膜水化法成功地合成了同时包载维生素C/白藜芦醇的纳米复合脂质体(Lip@Res/VC)。以脂质体的粒径(size)、多分散指数(PDI)、电位和两种活性成分的包封率为考察指标,优化两种成分的最佳投入量,获得了Res包封率为(85.13±5.37)%、VC包封率为(64.73±5.51)%、脂质体平均粒径为(92.29±5.41)nm的具有良好分散性的Lip@Res/VC。体外DPPH和ABTS自由基清除试验结果显示,该纳米复合脂质体Lip@Res/VC对DPPH和ABTS自由基清除率分别为(59.01±3.23)%和(69.73±2.27)%,其抗氧化活性较脂质体Lip@Res和Lip@VC相比均显著增强。进一步的细胞抗氧化研究表明,该纳米复合脂质体Lip@Res/VC具有较好地清除L02细胞内ROS的能力,能降低H2O2诱导的氧化损伤,具有细胞保护作用。我们合成的脂质体是由两亲性磷脂分子自组装成的一个双分子层球体,核心是亲水的,而双分子层的内层是疏水的,可以同时包封水溶性和脂溶性活性物质[10]。Res和VC都是具有较强的抗氧化能力的物质[6-7],用脂质体将脂溶性活性成分Res包埋在脂质体双分子层的膜上,水溶性活性成分VC包埋在脂质体亲水核心中。因此,我们推测在纳米复合脂质体Lip@Res/VC中Res与VC并不是通过相互作用来增强抗氧化能力,而是通过Res与VC两种活性物质的溶解性差异将其装载于脂质体的不同位置,脂质体装载了更多抗氧化物质,从而使得 Lip@Res/VC 的抗氧化能力优于Lip@Res和Lip@VC。该研究为进一步推进纳米复合脂质体在抗氧化方面的研究应用提供了试验依据。
参考文献(References):
[1] PANDA P, VERMA H K, LAKKAKULA S, et al. Biomarkers of oxidative stress tethered to cardiovascular diseases[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 9154295.
[2] LIU W, GAO Y, LI H, et al. Association between oxidative stress, mitochondrial function of peripheral blood mononuclear cells and gastrointestinal cancers[J]. Journal of Translational Medicine, 2023, 21(1): 107-119.
[3] KALINICHENKO A L, JAPPY D, SOLIUS G M, et al. Chemogenetic emulation of intraneuronal oxidative stress affects synaptic plasticity[J]. Redox Biology, 2023, 60: 102604-102617.
[4] JIAO Z, WANG X D, YIN Y T, et al. Preparation and evaluation of vitamin C and folic acid-coloaded antioxidant liposomes[J]. Particulate Science and Technology, 2018, 37(4): 453-459.
[5] DU J, CULLEN J J, BUETTNER G R. Ascorbic acid: chemistry, biology and the treatment of cancer[J]. Biochimica et Biophysica Acta, 2012, 1826(2): 443-457.
[6] SANTOS K, BRAGANA V, PACHECO L V, et al. Essential features for antioxidant capacity of ascorbic acid (vitamin C) [J]. Journal of Molecular Modeling, 2022, 28(1): 1.
[7] MA Z H, ZHANG Y M, LI Q C, et al. Resveratrol improves alcoholic fatty liver disease by downregulating HIF-1α expression and mitochondrial ROS production[J]. PLoS One, 2017, 12(8): e0183426.
[8] BONECHI C, MARTINI S, CIANI L, et al. Using liposomes as carriers for polyphenolic compounds: the case of trans-resveratrol[J]. PLoS One, 2012, 7(8): e41438.
[9] CADENA P G, PEREIRA M A, CORDEIRO R, et al. Nanoencapsulation of quercetin and resveratrol into elastic liposomes[J]. Biochimica et Biophysica Acta, 2012, 1828(2): 309-316.
[10] NONGONIERMA A B, ABRLOVA M, FENELON M A, et al. Evaluation of two food grade proliposomes to encapsulate an extract of a commercial enzyme preparation by microfluidization[J]. Journal of Agricultural and Food Chemistry, 2009, 57(8): 3291-3297.
[11] TAYLOR T M, WEISS J, DAVIDSON P M, et al. Liposomal nanocapsules in food science and agriculture[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(7/8): 587-605.
[12] WEBER S, ZIMMER A, PARDEIKE J. Solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC) for pulmonary application: a review of the state of the art[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2014, 86(1): 7-22.
[13] HAI L, HE D G, HE X X, et al. Facile fabrication of a resveratrol loaded phospholipid@reduced graphene oxide nanoassembly for targeted and near-infrared laser-triggered chemo/photothermal synergistic therapy of cancer in vivo[J]. Journal of Materials Chemistry B, 2017, 5(29): 5783-5792.
[14] LIU X, WANG P, ZOU Y X, et al. Co-encapsulation of vitamin C and β-carotene in liposomes: storage stability, antioxidant activity, and in vitro gastrointestinal digestion[J]. Food Research International, 2020, 136: 109587-109595.
[15] HUANG M G, LIANG C P, TAN C, et al. Liposome co-encapsulation as a strategy for the delivery of curcumin and resveratrol[J]. Food and Function, 2019, 10(10): 6447-6458.
[16] SUN Y, CHI J P, YE X Q, et al. Nanoliposomes as delivery system for anthocyanins: physicochemical characterization, cellular uptake, and antioxidant properties[J]. LWT-Food Science and Technology, 2020, 139(2): 110554-110562.
[17] LI W G, ZHANG Y, LIU Y R, et al. In vitro kinetic evaluation of the free radical scavenging ability of propofol[J]. Anesthesiology, 2012, 116(6): 1258-1266.
[18] WANG L Y, DING L, YU Z P, et al. Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal-derived antioxidant peptides in HepG2 cells[J]. Food Research International, 2016, 90: 33-41.
[19] WEN C T, ZHANG J X, FENG Y Q, et al. Purification and identification of novel antioxidant peptides from watermelon seed protein hydrolysates and their cytoprotective effects on H2O2-induced oxidative stress[J]. Food Chemistry, 2020, 327: 127059-127068.
[20] CHAI Z, HUANG W Y, ZHAO X, et al. Preparation, characterization, antioxidant activity and protective effect against cellular oxidative stress of polysaccharide from Cynanchum auriculatum Royle ex Wight[J]. International Journal of Biological Macromolecules, 2018, 119: 1068-1076.

