山东寿光蔬菜种业集团示范园部分番茄品种褪绿病毒感染分析
吴韵雅+杨葳+刘敏敏+杨硕+欧阳波

摘 要:番茄褪绿病毒(ToCV)病近几年来在我国各地相继暴发,北方产区染病情况尤为严重。对山东寿光蔬菜种业集团示范园内采集回的27个番茄品种的样品进行RT-PCR检测,结果表明,其中23个品种感染了ToCV;之后对这23个样品进行实时荧光定量PCR检测,分析病毒的CP基因的相对表达量,结果表明,感染品种中ToCV含量存在明显差异;进一步对样品的叶绿素含量进行了检测,结果表明,较难通过叶绿素含量高低判断ToCV的感染程度。
关键词:番茄褪绿病毒;PCR;实时荧光定量PCR;叶绿素
番茄是我国和全球最重要的蔬菜作物之一。近年来,番茄褪绿病毒(Tomato Chlorosis Virus,ToCV)病对我国番茄产业形成了潜在的威胁。2012年,北京首次出现该病毒病发生的报道,随后在胶东半岛、天津、河北等地也相继暴发了ToCV[1~3],目前该病毒病已经在山东省广泛蔓延,使得番茄产量大幅度下降,造成了巨大的经济损失。
ToCV属长线形病毒科(Closteroviridae)毛形病毒屬(Crinivirus),该病毒巨大,由2条超过8 kb的RNA链组成。ToCV不能由种子、汁液等途径进行传播,只能由银叶粉虱(Bemisia argentifolii)、烟粉虱(B. tabaci)、纹翅粉虱(Trialeurodes abutilonea)、温室白粉虱(T. vaporariorum)传播,是迄今为止发现的唯一一个可以由2个属的粉虱作为传播媒介的植物病毒[4,5]。在我国,烟粉虱是ToCV的主要传播媒介。1998年,美国佛罗里达州报道发现ToCV[6]。之后,ToCV相继在美洲、欧洲、亚洲以及中东等多个国家和地区蔓延。ToCV不但能侵染番茄,还可以侵染马铃薯、甜椒等其他的园艺作物[7],为害极大。
ToCV在侵染番茄后有较长的潜伏期,一般情况下3~4周内不会表现出明显症状,因此难以发现植株已经染病[8]。而且发病初期的典型症状与缺素症极其相似,容易混淆,具体表现为叶脉间失绿,叶片变厚,但叶脉仍为绿色;发病中期,叶片从边缘向中间坏死;发病后期,整个植株病死,严重影响果实的
质量。
目前,对于ToCV的鉴定和检测,主要运用血清学方法[9]和分子生物学方法[10,11]。分子生物学技术中,PCR技术操作简便、灵敏度高,因此被广泛使用。在PCR技术上发展起来的实时荧光定量PCR更是可以高效、快速地鉴别包括ToCV在内的任何植物病毒[12]。
山东寿光是“中国蔬菜之乡”,山东寿光蔬菜种业集团示范园是山东有代表性的示范园区之一。2015年示范园种植有800多个品种,当年的示范种植中许多番茄品种出现了叶片皱缩卷曲、边缘黄化等明显的病毒病症状,疑似感染了ToCV。为了确认ToCV的感染情况,从该示范园中取样,通过RT-PCR检测ToCV的外壳蛋白基因CP,分析ToCV的感染情况,进一步通过实时荧光定量PCR检测确定染病品种中CP基因的相对表达量,与此同时还测定了样品中叶绿素含量,以分析ToCV感染程度与叶绿素含量之间的关系。
1 材料与方法
1.1 试验 材料
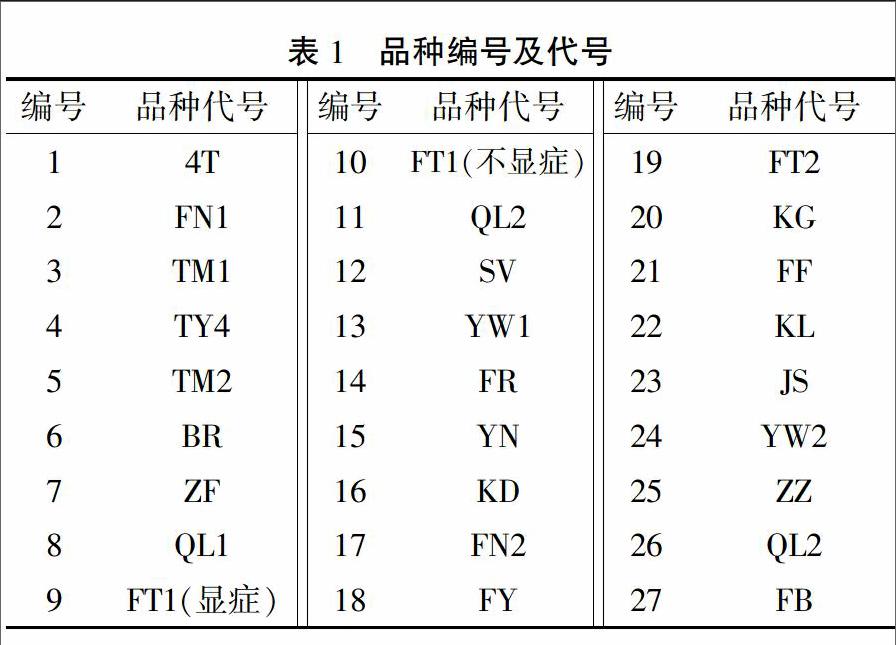
2015年12月6日,从山东寿光市蔬菜种业集团示范园采集27个番茄品种的样品,编号为1~27号(表1)。其中编号为2、3、27号的材料表现较好,无明显疑似ToCV症状,而编号为1、11、23号的材料表现较差,其叶片明显变黄,具有明显的疑似ToCV症状。部分材料症状有较为明显的分离,如编号为9、10号的植株。同时采集了显症明显的9号和未显症状的样品10号,全部样品保存在-80℃冰箱中备用。
1.2 试验方法
①样品总RNA的提取 采用Trizol法提取样品的总RNA。样品在液氮中研磨成粉,用Trizol充分提取之后离心,上清液转移至新离心管后用氯仿充分抽提,再次离心,上清液转移至新离心管后用异丙醇沉淀RNA。得到的RNA沉淀用75%乙醇洗涤,离心、干燥后用无RNA酶的超纯水溶解。提取得到的RNA样品用甲醛变性的1%琼脂糖凝胶快速电泳,检测RNA的完整性,用NanoDrop测定RNA浓度。
②RT-PCR扩增 用DNase去除RNA样品中的DNA后,进行反转录(RT)反应,体系如下(20 μL):RNA样品2.2 μL、HiScriptII逆转录酶2 μL、2×缓冲液10 μL、Actin基因的正向和反向引物(10 μmol/L)各0.3 μL、六碱基随机引物5.2 μL。RT反应在PCR仪上进行,程序如下:25℃ 5 min,50℃ 15 min,85℃ 5 min。反转录完成后得到的cDNA加入40 μL ddH2O稀释,保存于-20℃备用。
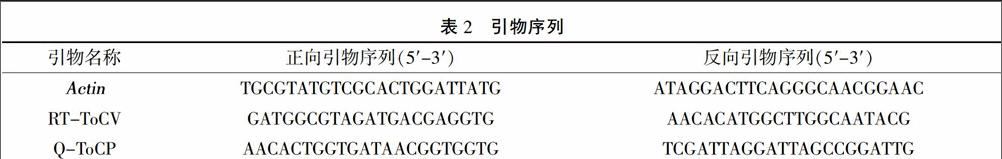
利用Actin基因的引物检测RT反应的质量,利用ToCV的CP基因引物RT-ToCV检测ToCV的存在与否。PCR扩增体系如下(15 μL):ddH2O 10.42 μL、10×缓冲液 1.5 μL、dNTPs 1.2 μL、正向和反向引物(10 μmol/L)各 0.4 μL、Taq DNA聚合酶0.08 μL,模板cDNA 1 μL。PCR反应程序为:95℃预变性2 min;95℃变性30 s,65℃退火30 s,72℃延伸 30 s,扩增30个循环;72℃延伸10 min。PCR扩增产物进行1%琼脂糖凝胶电泳并利用凝胶成像系统记录结果。本研究所用引物序列见表2。
③实时荧光定量PCR扩增 以上述cDNA作模板,以番茄Actin基因为内参,利用CP基因的定量PCR引物Q-ToCP进行扩增,检测CP基因的相对表达量。采用罗氏480实时荧光定量PCR仪进行PCR扩增,PCR反应体系为(10 μL):2×SYBR Green荧光定量PCR混合液5 μL、正向和反向引物(10 μmol/L)各0.5 μL、cDNA模板 4 μL。定量PCR反应程序为:95℃预变性60 s;95℃ 10 s,57℃ 15 s,72℃ 20 s,共扩增40个循环,每次循环结束采集荧光信号;之后进行溶解曲线的采集与分析。循环阈值(Ct)由机器自动读取。根据公式REL=Average[power(2,-CtCP)/power(2,-CtActin)]计算样品中CP基因的相对表达量。
④叶绿素含量测定 叶绿素的提取方法如下:取0.1 g经液氮研磨的样品粉末于2 mL的离心管中,加入2 mL 95%丙酮-无水乙醇(2∶1)提取液。将离心管放入25℃生化培养箱中过夜提取直至肉眼观察到样品粉末变白为止。取200 μL样品放入多功能酶标仪中,以提取液作为空白对照,测定645、663 nm波长下的吸光度。利用Arnon公式计算叶绿素含量,叶绿素总含量(mg/g)=(20.29A645+8.05A663)×v/w×1 000。
2 结果与分析
2.1 RT-PCR检测ToCV的感染情况
将采集到的27份样品叶片提取总RNA,反转录后得到cDNA,利用Actin基因的特异引物扩增样品以检测cDNA的质量,发现cDNA质量符合RT-PCR要求。进一步利用CP基因的特异引物进行PCR扩增,结果如图1。
从图1可以看出,有19个样品能扩增出CP基因的清晰条带,4个样品的条带较浅,另外有4个樣品看不到条带。从RT-PCR的结果来看,27个样品中有23个检测出ToCP,检出率高达85%。
2.2 实时荧光定量PCR检测CP基因的相对表达量
对RT-PCR中扩增出条带的23个样品利用实时荧光定量PCR进一步检测ToCV病毒的CP基因的相对表达量,同时设置了田间抗性表型良好、RT-PCR中无可见条带的27号样品作为参照系。以Actin为内参基因,利用ToCV的CP基因特异引物Q-ToCP-F和Q-ToCP-R对样品cDNA进行定量PCR扩增,获得Ct值,计算得到CP基因的相对表达量,结果见图2。
从图2可以看出,CP的相对表达量在11号样品中最高,表明其感染程度最严重。根据CP基因的表达量高低排序,其中9、23、20、1、6、18、19、7、21、15、24号样品明显感染了不同程度的ToCV;22号样品相对表达量最低,感染程度最轻;其余样品CP基因的表达量均较低,包括作为参照的27号样品。
2.3 叶绿素含量
从图3可以看出,样品中叶绿素含量差异较大。15号样品的叶绿素含量最高,为0.818 mg/g,13号和4号样品次之;1号样品的叶绿素含量最低,为0.063 mg/g, 5号和12号等样品的叶绿素含量也很低。结合图2、3结果可看出,仅凭叶绿素含量无法判断ToCV的感染程度。
3 讨论与结论
ToCV的鉴定技术主要包括表型鉴定、血清学鉴定和分子生物学鉴定,其中实时荧光定量PCR技术[12]和反转录环介导等温扩增检测技术[3]是目前较为高效、快速、准确的鉴定方法。本研究从山东寿光蔬菜种业集团示范园采集27个番茄品种的样品,通过RT-PCR检测确定染病品种多达23个,比率为85%。从这个结果可以推测当前生产上的绝大部分番茄品种对ToCV是感病的。进一步对RT-PCR检测判断为明显染病的品种进行实时荧光定量PCR,检测CP基因的相对表达量,其中有12个品种CP基因相对表达量较高,如11、23号样品,可以判断其感染程度较为严重,推断这些品种对ToCV的抗性较差,在ToCV暴发的地区不宜推广或者要做好严格的防控措施。尽管2、3、12、27号样品在RT-PCR检测中没有扩增出CP基因的条带,表现为未受ToCV感染,但由于缺乏严格的接种鉴定,尚不能推断这些品种对ToCV具有抗性。实际上,以27号样品作为参照进行实时荧光定量PCR检测时,仍然能够检测到荧光信号,即表明仍然有ToCV感染的迹象。从这里也可以看出,实时荧光定量PCR比传统的RT-PCR更为灵敏。总之,对未检测到明显ToCV感染的品种,可以进一步进行多茬多点观察。
通过测定样品中叶绿素含量发现,无论是检测为感染了ToCV还是没有感染ToCV的品种,叶绿素含量有高有低,表现出明显的品种差异。同时,感病品种中,较难通过叶绿素含量高低判断ToCV的感染程度。
在ToCV的防控方面,由于现在没有抗病商业品种可以选择,可以优先选择在发病条件下表现良好、分子检测CP基因含量低的耐病品种。同时,对病原的传播进行严格的防控,包括采用防虫网、粘虫板和杀虫剂严防粉虱,严禁从病区调运种苗等。此外,对疑似感染了ToCV的苗子,及时进行拔除处理,并对生产田进行抗病毒防治。
当然,防治病虫害的根本办法是种植抗性优良的品种,并配合正确的田间管理。因此,培育抗番茄褪绿病毒的优良品种应该作为育种家们未来重点研究的课题。
随着烟粉虱在全世界范围内的大规模扩散,由烟粉虱传播的病毒病日趋严重。由烟粉虱传播的ToCV在世界范围内相继暴发,也在我国山东省多个地区发生并且造成严重为害。建立严格的防控体系和尽快选育出抗病品种是当前重要的任务。目前,西班牙科学家已从野生番茄中鉴定出2份抗褪绿病毒的番茄材料[13],尽快将其中的抗性基因转育到栽培品种中是将来一段时间的重要研发目标。
参考文献
[1] 高利利,孙国珍,王勇,等.天津地区番茄褪绿病毒的分子检测和鉴定[J].华北农学报,2015(3):211-215.
[2] 孙国珍,高利利,陆文利,等.河北省设施番茄褪绿病毒分子检测和鉴定研究[J].北方园艺,2015(9):95-98.
[3] 赵黎明,李刚,刘永杰,等.侵染番茄的番茄褪绿病毒山东泰安分离物的分子鉴定和序列分析[J].植物保护,2014
(5):34-39.
[4] Kataya A R A, Stavridou E, Farhan K, et al. Nucleotide sequence analysis and detection of a Greek isolate of tomato chlorosis virus[J]. Plant Pathology, 2008, 57: 819-824.
[5] Wintermantel W M, Wisler G C, Anchieta A G, et al. The complete nucleotide sequence and genome organization of tomato chlorosis virus[J]. Archives of Virology, 2005, 150:
2 287-2 298.
[6] Wisler G C, Li R H, Liu H Y, et al. Tomato chlorosis virus: a new whitefly-transmitted, phloem-limited, bipartite closteroviruses of tomato[J]. Phytopathology, 1998, 88: 402-409.
[7] Freitas D M S, Nardin I, Shimoyama N, et al. First report of tomato chlorosis virus in potato in Brazil[J]. Virology, 2014, 464: 365-374.
[8] Font M I, Juarez M, Martinez O, et al. Current status and newly discovered natural hosts of tomato infectious chlorosis virus and tomato chlorosis virus in Spain[J]. Plant Disease, 2004, 88: 82.
[9] Jacquemond M, Verdin E, Dalmon A, et al. Serological and molecular detection of tomato chlorosis virus and tomato infectious chlorosis virus in tomato[J]. Plant Pathology, 2009, 58: 210-220.
[10] Tiberini A, Tomassoli L, Barba M, et al. Oligonucleotide microarray-based detection and identification of 10 major tomato viruses[J]. Journal of Virological Methods, 2010, 168: 133-140.
[11] Moriones E, Nabas-Castillo J. Tomato yellow leaf curl virus, an emerging virus complex causing epidemics worldwide[J]. Virus Research, 2000, 71: 123-134.
[12] Papayiannis L C, Harkou I S, Markou Y M, et al. Rapid discrimination of tomato chlorosis virus, tomato infectious chlorosis virus and co-amplification of plant internal control using real-time RT-PCR[J]. Journal of Virological Methods, 2011, 176: 53-59.
[13] García-Cano E, Navas-Castillo J, Moriones E, et al. Resistance to tomato chlorosis virus in wild tomato species that impair virus accumulation and disease symptom expression[J]. Phytopathology, 2010, 100: 582-592.

