2型糖尿病合并骨质疏松危险因素Logistic回归分析
曾锦辉 王晓云 宋渊浩 罗芳涛 林志华
糖尿病全球发病率呈上升趋势,其慢性并发症严重威胁患者的健康。糖尿病慢性并发症,诸如血管病变、神经病变以及眼底病变等已经被普遍认识。但是糖尿病并发骨质疏松症近年来才开始为医学界所知。事实上,骨质疏松是常见的,但却易被忽视的糖尿病慢性并发症。糖尿病合并骨质疏松如没有得到及时有效的治疗,骨折风险显著增加,严重影响患者的生活质量[1]。糖尿病合并骨质疏松可能与高血糖抑制钙、磷重吸收以及氧化应激状态、糖基化终末代谢产物的堆积等诸多因素相关。脆性骨折是糖尿病合并骨质疏松的严重并发症,一旦发生,不仅给患者带来严重的身心伤害,而且给其家庭、甚至社会带来沉重的经济负担。本研究旨在探讨糖尿病合并骨质疏松相关危险因素,以期早期识别危险因素,提前预防、尽早干预可控因素,降低骨质疏松发病率,减少脆性骨折等严重并发症,提高患者生活质量。
1 资料与方法
1.1 一般资料
选取2019 年9 月—2022 年9 月在厦门医学院附属第二医院内分泌科住院且符合纳入标准的 2 型糖尿病患者298 例。其中男160 例,女138 例。纳入标准:所有入选的2 型糖尿病患者均符合1999 年世界卫生组织(World Health Organization,WHO)诊断标准[2]:(1)糖尿病症状+空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L。(2)随机血糖≥11.1 mmol/L。(3)口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)2 h 血浆葡萄糖(2 hours plasma glucose,2 hPG)≥11.1 mmol/L,无症状者须重复确认。骨质疏松的诊断标准符合原发性骨质疏松症诊治指南(2011 年)[3]。根据双能X线骨密度仪检测的T 值、Z 值结果,确定骨密度分组。正常BMD 定义为T ≥ -1.0 标准差(SD),骨量减少(低骨量)定义为-2.5 SD < T < -1.0 SD,骨质疏松症定义为T ≤-2.5 SD 或Z≤-2 SD(绝经前女性及50 岁以下男性)。根据T 值或Z 值将患者分为两组: 骨质疏松组93 例(T ≤-2.5 SD 或Z ≤-2 SD),非骨质疏松组205 例(包括骨量减少及骨量正常组,即T >-2.5 SD 或Z>-2 SD)。本研究经医院医学伦理委员会批准。
排除标准:(1)1 型糖尿病、妊娠期高血糖、特殊类型糖尿病。(2)可引起继发性骨质疏松的疾病(甲状腺功能亢进症、甲状旁腺功能亢进症、库欣综合征、肝硬化、结缔组织病、癫痫、肝肾疾病等)。(3)恶性肿瘤患者。(4)应激状态、重度感染、创伤患者。(5)长期应用影响骨代谢药物(糖皮质激素、肝素、华法林、巴比妥类、甲氨蝶呤、影响性腺功能的药物等)患者。(6)长期卧床患者。(7)严重心、肺等重要脏器疾病者。
1.2 观察指标
(1) 临床资料:收集入组病例的性别、年龄、2 型糖尿病病程、身体质量指数(body mass index,BMI)、血压。(2)相关检验指标:对入组病例的空腹血糖(fasting blood glucose,FBG)、空腹C 肽(fasting c-peptide,FCP)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、同型半胱氨酸、血脂、尿微量白蛋白/肌酐比值(albumin creatinine ratio,ACR)等进行检测。血脂异常根据中国成人血脂异常防治指南(2016年修订版)定义为:总胆固醇≥ 5.2 mmol/L,低密度脂蛋白≥ 3.4 mmol/L,三酰甘油≥ 1.7 mmol/L,高密度脂蛋白<1.0 mmol/L[4]。空腹血糖、血脂采用美国贝克曼全自动生化分析仪检测,糖化血红蛋白采用离子交换高效液相色谱法检测;C 肽采用化学发光法检测;血浆Hcy 水平采用循环酶法检测;UACR 采用免疫比浊法测定。(3)骨密度( bone mineral density,BMD):采用美国GE 公司生产的GE-LUNARDPS 骨密度仪对两组患者进行腰椎(L1~4、左髋部、右髋部)BMD 检测。
1.3 统计学方法
所有数据均采用S P S S 2 3.0 统计学软件进行统计分析,呈正态分布计量资料采用(±s)表示,组间比较采用t检验;非正态分布计量资料采用[M(P25,P75)]进行统计描述,组间比较采用Mann-WhitneyU检验;计数资料采用n(%)表示,组间比较采用χ2检验。糖尿病合并骨质疏松的危险因素分析采用二元Logistic 回归分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组病例的临床资料及实验室指标比较
两组糖尿病病程、有无血脂异常比例、FBG、FCP、HbA1c 比较,差异无统计学意义(P> 0.05);两组男女比例、年龄、有无吸烟比例、BMI、有无高血压比例、UACR、Hcy 差异有统计学意义(P<0.05)。见表1。
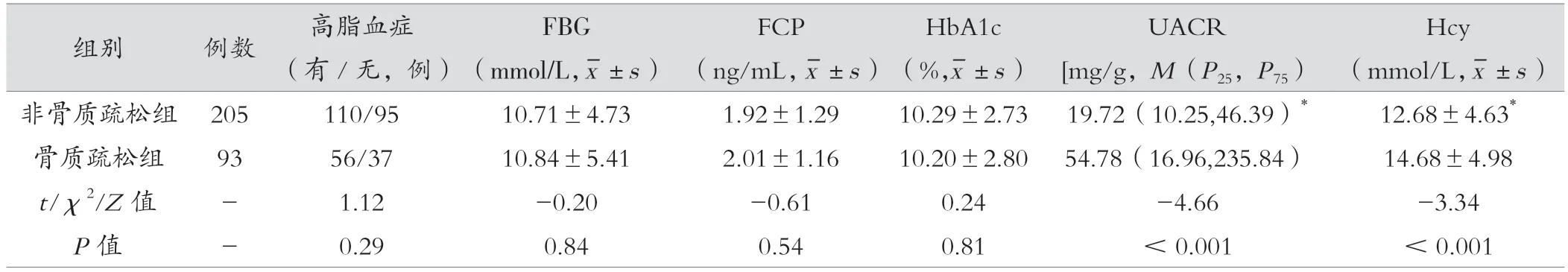
表1 (续)
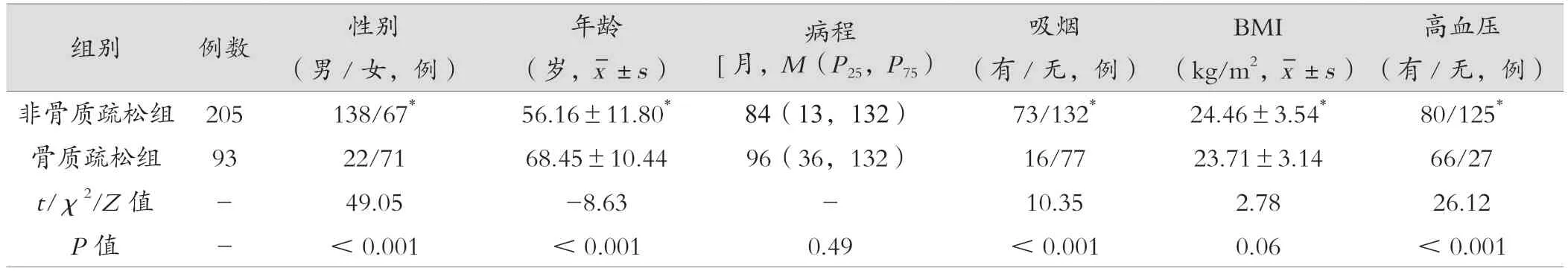
表1 非骨质疏松及骨质疏松组患者临床资料及实验室指标比较
2.2 2 型糖尿病合并骨质疏松危险因素二元Logistics回归分析
单因素分析中两组糖尿病病程、糖化血红蛋白比较无统计学差异,但临床上认为糖尿病病程、糖化血红蛋白与骨质疏松相关,为避免遗漏影响因素,故仍将其纳入回归分析中。糖尿病合并骨质疏松影响因素自变量赋值见表2。以2 型糖尿病是否合并骨质疏松为因变量(是 =1 ,否 =0 ), 经多因素分析显示, 性别男性、年龄、吸烟、高血压、ACR >300 mg/g 为 2 型糖尿病合并骨质疏松的独立危险因素(OR>1,P< 0.05),BMI 为其保护因素(OR< 1,P< 0.05)。见表 3 。

表2 糖尿病合并骨质疏松影响因素Logistic 回归自变量赋值

表3 2 型糖尿病患者合并骨质疏松的多因素Logistic 回归分析
3 讨论
人体正常的骨代谢过程包括骨吸收和骨形成,其过程极其复杂。在骨代谢过程中,破骨细胞分泌有机酸及蛋白酶吸收陈旧的骨组织,而成骨细胞通过合成、分泌骨基质并使其矿化促进新骨形成,两者维持动态平衡以保证正常骨量。当平衡被破坏,如骨形成不足或骨吸收超过骨形成就会导致骨质疏松,进而引起骨折。骨质疏松是糖尿病骨代谢失衡导致的严重慢性并发症。糖尿病患者由于血糖控制差,持续的高胰岛素血症及高糖状态,使得胰岛素样生长因子-1(insulin-like growth factor,IGF-1)和晚期糖基化终末产物(advanced glycosylation end products,AGESs)等物质不同程度蓄积在骨组织,因此糖尿病合并骨质疏松主要表现为骨质量受损,骨骼脆性增加[5]。骨质疏松症为代谢性骨病,主要特征为骨强度下降和骨折风险增加[6]。诊断骨质疏松的“金标准”公认为双能X 线骨密度检查。但是,测量部位软组织、骨骼几何形态等因素均能影响双能X 线检测结果[7]。此外,患者骨微结构比如骨小梁间距、皮质骨多孔性和骨材料特性的变化也不能被它检测到[8]。而糖尿病合并骨质疏松的主要表现为骨强度的下降,其影响因素除骨密度外还有骨质量。双能X 线骨密度仪评估的是面积骨密度,无法反映复杂的3D 骨特征等骨质量指标[9]。X 线片是一种定性检查的方法,简单易行,可以通过观察骨皮质厚薄及骨小梁形态判断是否有骨质疏松。但当X 线有阳性发现时,患者的骨量丢失已在30%以上。因此,X 线片不适合早期骨质疏松的评价,对于骨质疏松诊断存在一定的滞后性。在疾病的早期,临床医师不应只依赖骨密度来诊断骨质疏松,更需结合相关危险因素,对骨质疏松进行早期的筛查和预判。本研究发现,相对男性,女性增加骨质疏松的风险,差异有统计学意义(OR=17.40,95%CI6.062 ~49.945,P<0.05)。一般女性青春发育期早于男性,较早出现骨量增长,但男性骨量获得的持续时间相对较长,导致男性峰值骨量大于女性。加之绝经后女性失去雌激素的保护作用,骨量急剧下降。此外男性相对女性运动量较大,且女性为保持身材常导致BMI 过低等因素导致了骨质疏松的性别差异。年龄是骨质疏松症危险因素(OR=1.086,95%CI1.049 ~1.124,P<0.05)。最 近 发 表的一项多中心大规模研究的数据显示,基于DEXA 检测的腰椎股骨颈总股骨的骨密度,在中国人群中,55 岁后男性和女性的骨质疏松症随着年龄的增加而显著增加[10]。本研究发现,吸烟增加糖尿病合并骨质疏松的风险(OR=4.064,95%CI1.326 ~12.455,P<0.05),其机制可能与炎症反应相关[11]。另有研究发现,吸烟降低骨密度、增加骨折风险,即使被动吸烟对骨密度也有不良影响[12]。烟草中有害物质可以直接或间接作用于破骨细胞,导致破骨细胞生成增多、活性增强,从而增加骨吸收。同时,还会抑制成骨细胞的增殖、分化,降低其活性,减少骨形成。不论男性还是女性,BMI 均为骨质疏松的保护因素(OR=0.842,95%CI0.754 ~0.940,P<0.05),与既往研究相符[13]。较高的BMI 可能弥补绝经期低雌激素状态对骨密度的负面影响。BMI 低的患者营养差,骨细胞活性低下,胰岛素样生长因子1 分泌减少,骨吸收活跃。动物研究显示,适度的BMI 可能通过机械和生物学等物理因素刺激调控骨量[14],此外还能通过分泌细胞因子或激素促进骨量增长[15]。此外,BMI 高的患者因较低的血浆性激素结合球蛋白,使得游离睾酮及雌激素水平升高,有利于骨量维持、减少骨质疏松风险[16]。本研究发现,高血压为骨质疏松的危险因素(OR=2.527,95%CI1.209 ~5.280,P<0.05),与董莹莹等[17]的研究报道相符,说明血压在2 型糖尿病患者骨质疏松的发生、发展过程中起着至关重要的作用。分析原因,随着血压的升高,加上长期高血糖对血管内膜的损伤形成微小动脉硬化,造成骨骼血管床变性,骨髓微循环障碍,骨组织及神经失营养,进而导致骨质疏松。长期高糖环境下,2 型糖尿病患者可出现骨组织结构紊乱,进而出现骨量减少,乃至骨质疏松;同时,高糖毒性使得成骨细胞和破骨细胞对25 羟维生素D3反应下降,使骨形成减少。此外,动物研究证实当间充质祖细胞暴露在高糖环境下可激活Notch2 信号通路抑制骨形成[18]。在高糖化血红蛋白水平的患者中,骨胶原蛋白发生糖基化反应,引发结构改变,影响骨矿物质沉积,诱发骨质疏松[13]。但本研究单因素分析中非骨质疏松组与骨质疏松组空腹血糖、糖化血红蛋白无统计学差异。多因素分析中发现与糖化血红蛋白≤7% 相比,糖化血红蛋白>7% 其发生骨质疏松的OR为1.660,但P=0.292,差异无统计学意义。分析与样本量偏少,以及本研究中非骨质疏松组中男女比例明显高于骨质疏松组,且年龄均值56 岁左右,而此年龄段男性往往由于应酬多以及不健康的饮食生活习惯影响血糖控制,导致上述结果出现,与袁飞等研究相符[19]。本研究证实,尿微量白蛋白肌酐比值增高为骨质疏松的危险因素。与ACR <30 mg/g 相比,ACR >300 mg/g 增加骨质疏松风险(OR=4.404,95%CI1.648~11.767,P<0.05)。然而,与ACR <30 mg/g 相比,ACR 在30 ~300 mg/g 并没有增加骨质疏松的风险(OR=1.199,95%CI0.585 ~2.457,P>0.05)。尿微量白蛋白肌酐比值反映糖尿病肾病患者肾小球基底膜内皮功能障碍严重程度,内皮功能障碍影响一氧化氮的生物利用度,促进动脉粥样硬化的发生发展。动脉粥样硬化已被证实对骨密度及骨代谢存在不良影响[20]。动脉粥样硬化时,C-反应蛋白、肿瘤坏死因子-α、白介素6 等炎症因子水平增高,这些炎症因子促进了骨吸收,导致骨质疏松的发生。此外,单因素分析中,Hcy 水平在非骨质疏松组与骨质疏松组中存在统计学差异,而多因素分析中差异并无统计学意义,分析为Hcy 受性别、年龄等因素影响所致。
综上所述,女性、年龄大、吸烟、高血压、高尿微量白蛋白肌酐比值为糖尿病合并骨质疏松的危险因素,高BMI 为保护因素。因此,对糖尿病患者,尤其对于老年女性糖尿病患者,要培养并坚持健康的生活方式,戒烟,维持正常体质量,控制血压、血糖、降低尿微量白蛋白肌酐比值。

