原发性纵隔巨大卵黄囊瘤伴肺转移一例
陈宁 朱振龙
原发性纵隔卵黄囊瘤(primary mediastinal yolk sac tumor)是一种包括卵黄囊、尿囊及外胚间充质等多种组织特点的高度恶性生殖细胞肿瘤。曾用名为内胚窦瘤(endodermal sinus tumor),目前已不推荐使用[1]。本病临床罕见,好发于婴幼儿及青年男性,肿瘤位于前纵隔[2],常因胸痛、胸闷、咳嗽、发热、上腔静脉综合征等症状或体检发现[3]。血清甲胎蛋白(alpha-fetoprotein,AFP)水平明显升高,而β-人绒毛膜促性腺激素(β-subunit of human chorionic gonadotropin,β-hCG)正常[4]。肿瘤迅速生长及早期转移是其主要临床特征[2]。河北医科大学第一医院2022年7月2日收治1例纵隔卵黄囊瘤患者,现将相关临床诊疗情况报告如下。
临床资料
患者,男,32岁,因“咳嗽咳痰、胸闷气短,上腹不适1个月”于2022年7月2日入院。入院后进行胸部CT扫描(图1~2):前纵隔占位性病灶,侵袭性胸腺瘤伴心脏及纵隔内大血管受侵?双肺多发小结节;转移瘤?行正电子发射计算机断层显像PET-CT+高分辨率骨显像:(1)前纵隔恶性肿瘤。(2)双肺多发不均匀高代谢及微小结节及结节;第2骶椎右侧高代谢影。考虑可能为转移瘤。患者7月15日用力咳痰后突发一过性晕厥,急查肺动脉血管造影检查(CTA):前纵隔占位,侵及右心室及肺动脉?右肺动脉干受压变细。
入院血生化检查:AFP>3000 ng/ml(正常值0.00~9.00 ng/ml),β-hCG 0.60 mIU/ml(正常值0~5 mIU/ml),丙氨酸氨基转移酶ALT 3346.8 U/L(正常值9.0~50.0 U/L),乳酸脱氢酶LDH 4157.0 U/L(正常值120.0~250.0 U/L)。
穿刺病理诊断:(前纵隔包块)生殖细胞肿瘤,考虑卵黄囊瘤。免疫组织化学检测报告:CK(+),Vimentin(-),SALL4(+),CD30(-),Glypican-3(+),α-Inhibin(-),HMB45(-),CD45(-),CD31(-),S-100(-),Hepatocyte(-),Ki-67(+,60%~70%),AFP(+),ALK(+/-),CD117(-)(图3~10)。
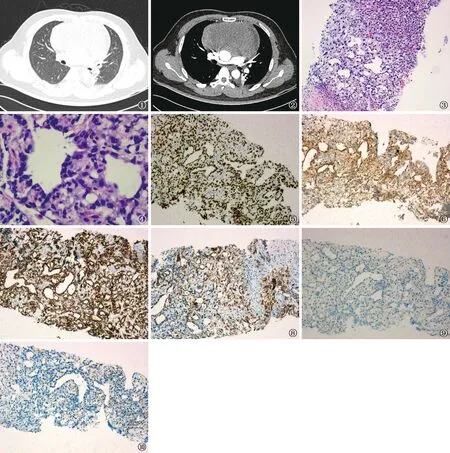
图1~2 患者,男,32岁。胸部CT扫描结果。图1为肺窗:双肺可见多发小结节影,边缘光滑,最大者位于右肺下叶,最大截面约1.7 cm×1.1 cm;图2为纵隔窗:前纵隔可见肿块影,大小约13.8 cm×7.7 cm,增强呈均匀强化,心脏及纵隔内大血管明显受压移位,且分界不清 图3~10 患者,男,32岁。穿刺组织病理结果。图3显示左下微囊型(网状型)结构,右上显示实体型(HE ×100);图4显示高倍镜观察微囊腔是由胞质少的扁平或立方样细胞衬覆形成,进而构成布满空隙和小管的疏松网状结构HE ×400;图5显示SALL4呈弥漫强阳性,阳性部位定位于细胞核;图6~8显示AFP、CK和Glypican-3均呈阳性表达,阳性部位定位于细胞浆;图9~10显示CD30和CD117均呈阴性 IHC ×100
临床联合肿瘤科、胸外科、病理科、影像科、重症医学科副主任医师及主任医师进行多学科会诊,最终诊断:符合卵黄囊瘤Ⅳ期,肺部继发性恶性肿瘤,骨继发性恶性肿瘤。由于患者已出现肺内及骨多发转移,且肿物巨大,与周围心脏及大血管粘连,不主张进行外科手术切除。鉴于该患者病情较重,7月15日曾因用力咳痰突发一过性晕厥,考虑为肿瘤压迫肺动脉导致梗阻性休克及呼吸衰竭,先转入ICU进行治疗。入ICU后给予酌情补液、纠酸降钾等治疗,患者病情好转,故转入肿瘤科给予患者扶正抗肿瘤、保肝等对症治疗。由于患者肝功能差,ALT 3346.8 U/L(正常值9.0~50.0 U/L),而肿瘤进展快,建议先行放射治疗,待肝功能改善后再进行化疗。于2022年7月19日至7月28日行放射治疗。靶区:肿瘤靶区为纵隔肿瘤,均匀外扩0.5 cm为计划靶区;放疗剂量:95%计划靶区20Gy/2Gy/10F。放疗过程顺利无严重不良反应发生。患者放疗结束,复查AFP>3000 ng/ml,7月29日进行胸部CT扫描:与2022年7月4日胸部CT扫描结果比较,前纵隔恶性肿瘤病变,局部较前密度降低,双肺多发转移瘤,部分较前新见,部分较前增大。肝功能检查较前明显改善(ALT降至222.8 U/L),于2022年8月1日开始以博来霉素+依托泊苷+顺铂(BEP)方案化疗 4 个周期,每21 d为1个周期,具体方案为依托泊苷0.1 g第1~5天静脉滴注,顺铂40 mg第1~3天静脉滴注,博来霉素1.5万单位分别于化疗第1、8天和第15天肌肉注射。8月21日完成第1周期化疗,患者当前病情较平稳,肝功能明显改善(ALT降至41.3 U/L),无胸闷、喘憋等不适,准予出院。9月4日复查AFP仍然>3000 ng/ml,进行胸部CT扫描:与2022年7月4日胸部CT扫描结果比较,前纵隔恶性肿瘤病变较前范围减小;双肺多发转移瘤,较前体积减小,数量减少。化疗有一定效果,目前继续进行第2周期化疗,仍在积极治疗中。
讨 论
生殖细胞肿瘤起源于原始生殖细胞,颅内的松果体区及鞍区、纵隔、腹膜后以及骶尾部这些中轴线附近的区域是性腺外生殖细胞肿瘤的好发部位[5]。纵隔是生殖细胞肿瘤的常见发病部位之一,占所有性腺外生殖细胞肿瘤的 50%~70%[4]。原发纵隔卵黄囊瘤发病年龄群分布呈现双峰模式,分为婴幼儿及青春期后两个年龄段[6]。青春期后几乎仅发生于男性患者,发病年龄15~59岁,平均年龄为30岁左右[7]。由于纵隔卵黄囊瘤生长迅速,很容易侵犯周围邻近组织,且在发病时已伴有转移(转移至肺、肝及脑),导致原发病灶的难以切除且预后极差[8]。90%的患者出现AFP水平升高,且AFP是诊断和评估预后的关键指标[9]。
纵隔卵黄囊瘤病理组织学结构多种多样,微囊型(网状型)是最常见的组织学结构。透明小滴十分常见,由多种蛋白组成,PAS反应阳性并抗淀粉酶消化。常位于网状结构的间隙内或瘤细胞内,经免疫组织化学检测证实,其实是α抗胰蛋白酶和甲胎蛋白[10]。除了形态学特征外,免疫组织化学检测也是诊断卵黄囊瘤的重要手段。最敏感的免疫组织化学检测指标包括CK、AFP、Glypican-3、SALL4[11]。
本例患者为青年男性,32岁,影像学显示前纵隔巨大占位伴双肺转移瘤,穿刺病理呈现典型微囊状结构,免疫组织化学检测CK、AFP、Glypican-3、SALL4均呈阳性,血清AFP>3000 ng/ml,β-hCG正常。结合患者的性别、年龄、发病部位、影像学、病理学检查及血清AFP水平,基本诊断纵隔恶性生殖细胞肿瘤,符合卵黄囊瘤。同时还应与精原细胞瘤、胚胎性癌、绒毛膜癌、畸胎瘤及混合性生殖细胞肿瘤等其他纵隔原发生殖细胞肿瘤、纵隔胸腺瘤、胸腺癌、淋巴瘤以及转移性癌等相鉴别。
根治性手术+化疗仍是目前最重要的治疗手段[12]。但由于瘤体巨大,容易侵犯邻近器官及远处转移,又由于直接手术风险高、创伤大,多数患者难以完整切除肿瘤。因此,以铂类(顺铂、卡铂)为主的联合化疗方案正逐渐成为本病的首选治疗方式。目前常用化疗方案有:博来霉素+依托泊苷+顺铂、异环磷酰胺+依托泊苷+顺铂[13]。由于纵隔卵黄囊瘤恶性程度高,超过半数的青春期后纵隔卵黄囊瘤在发病时都已伴有转移,并导致大部分患者死亡。化疗早期阶段AFP水平降低不理想及出现肺转移常提示预后不良[2,8]。今后将继续对患者的治疗情况和预后进行不间断随访,以期为纵隔卵黄囊瘤的治疗及预后提供更多参考依据。
利益冲突所有作者均声明不存在利益冲突
作者贡献陈宁:收集资料 撰写论文;朱振龙:审阅修改论文

