3D打印PBS/CS房间隔缺损补片材料表征和细胞学测试
夏颖慧,邱水玮,孙江东,邢泉生
(1 青岛大学附属妇女儿童医院心脏中心,山东 青岛 266034; 2 青岛大学医学部神经再生与康复研究院)
房间隔缺损(ASD)是常见的先天性心脏病之一,占先天性心脏病的13%~18%[1]。ASD通常的治疗方法是使用镍钛合金封堵器经导管封堵,该法的好处是创伤小、住院时间短,但从长远来看,镍钛合金封堵器不可降解,且有增加心律失常、血栓等并发症的风险[2-3]。因此,开发生物可降解材料制作心脏缺损封堵装置是当前需要解决的问题。聚丁二酸丁二醇酯(PBS)是脂肪族聚酯类材料,具有高结晶度,制成补片可以提供较好的硬度,从而起到支撑作用。同时,PBS还具有良好的可加工性,可以通过挤出、注射成型等方法进行加工[4-5]。但由于该材料降解时间较长,且其高疏水性不适合细胞附着,目前较少应用于医学领域[6]。有研究发现,当PBS与壳聚糖(CS)复合时,不仅不影响各材料的性能,还可在一定程度上起到互相促进的作用[7]。CS作为一种天然来源的半合成氨基聚糖,具有良好的生物相容性、可降解性以及生物黏附性[8-10]。CS通过与聚酯类材料复合改性,可应用于组织再生和细胞支架等领域[11-12]。同时,3D打印CS水凝胶目前在医学领域(如组织工程、纳米载药、伤口敷料等)也得到广泛的研究[13-16]。为了探究PBS/CS用于3D打印加工的可行性以及该复合材料作为医疗植入物的理化性能,本研究对PBS/CS进行材料表征和细胞学测试,为开发新型可用于3D打印制作心脏补片的可降解材料提供理论依据。
1 材料与方法
1.1 主要材料
PBS(注塑级,上海麦克林生化科技有限公司);CS(脱乙酰度≥95%,黏度100~200 mPa·s,上海麦克林生化科技有限公司);NIH/3T3细胞株(武汉普诺赛生命科技有限公司);DMEM高糖培养液(北京索莱宝科技有限公司);活性氧(ROS)检测试剂盒(Beyotime,S0033S);Annexin V-FITC凋亡检测试剂盒(Beyotime,C1062S);Phalloidin-iFluor 555抗体(ab176756,Abcam,美国)。
1.2 复合材料的制备及表征分析
1.2.1PBS/CS材料的制备 将PBS真空干燥4 h(温度50 ℃,真空度-0.1 MPa)。按投料质量比9∶1、8∶2称取PBS和CS,分别命名为PCS1和PCS2,依次倒入转矩流变仪密炼模块,设置密炼模块的前、中、后温度均为160 ℃,转速30 r/min,密炼共混10 min。室温冷却后封装入预先干燥除水处理的密封罐中。
1.2.2扫描电镜观察表面形貌 为了观察添加CS对PBS结构的影响,通过模具注塑将PBS/CS、PBS制作成哑铃状拉伸测试样条,液氮冷脆1 h后脆断截取其断面。将断面真空干燥后用导电胶固定在样品台上,断面喷金处理,使用日本日立公司生产的Regulus 8100型场发射扫描电子显微镜对断面进行观察,获取图片。
1.2.3傅立叶变换红外光谱测试结构表征 PBS、PCS1、PCS2和CS样品使用美国赛默飞公司生产的Nicolet iN10MX型傅立叶变换红外光谱仪进行分析。分辨率为4 cm-1,扫描次数32次,扫描范围4 000~400 cm-1。
1.3 3D打印ASD补片的制备
使用熔融挤出式3D打印机进行PBS/CS心脏补片的制作。将20 g真空干燥后的PCS1和PCS2颗粒料倒入3D打印机挤出筒内,加热至175 ℃,待材料呈熔融状态后以7.5 mm/s匀速挤出。打印参数:喷头直径0.35 mm,打印厚度5 mm,打印层数2,网孔间隔5 mm。
1.4 细胞学测试
1.4.1细胞培养与材料浸提液的准备 NIH/3T3细胞在37 ℃、体积分数0.05 CO2、饱和湿度条件下,使用含体积分数0.10小牛血清和体积分数0.01青霉素/链霉素的DMEM高糖培养液进行培养。当细胞密度在每个培养皿达80%~90%时,应用2.5 g/L的胰蛋白酶在37 ℃条件下消化细胞,直至细胞从培养皿中脱落,将细胞收集进离心管中,以1 200 r/min离心5 min,弃上清,加入磷酸盐缓冲液以1 200 r/min离心5 min,弃上清后用DMEM培养液重悬细胞,并按每培养皿(直径10 cm)1×105个细胞的密度定殖新培养皿,放入培养箱培养,选择密度为60%~70%的细胞进行后续实验。
根据国家医疗器械生物学评价标准(GB/T 16886.5-2017)制备材料浸提液,以检测材料浸提液对细胞影响。3D打印补片进行环氧乙烷灭菌后,按照每平方厘米材料加入1 mL培养液的比例,无菌环境下在10 cm培养皿中加入含体积分数0.10小牛血清的DMEM培养液,在37 ℃浸提24 h,之后在无菌环境下将培养液转移到新的无菌离心管中,封口后置于-20 ℃备用。
1.4.2CCK-8法检测细胞增殖 收集对数生长期的NIH/3T3细胞,计数后在96孔板中按照每孔5 000个种植细胞,每孔加入细胞培养液至100 μL,在含体积分数0.05 CO2细胞培养箱中37 ℃恒温培养24 h后,每孔加入10 μL CCK-8溶液,在细胞培养箱中37 ℃恒温孵育2 h,应用酶标仪测定波长450 nm处的吸光度值,根据吸光度分析每组细胞增殖情况。
1.4.3细胞形态检测 使用Phalloidin-iFluor 555抗体对肌动蛋白细丝(f-肌动蛋白)进行染色。将用材料浸提液培养24 h后的NIH/3T3细胞以磷酸盐缓冲液清洗2次,用40 g/L的多聚甲醛固定细胞10 min,以磷酸盐缓冲液洗3次,每次5 min;添加含体积分数0.003 Triton X-100和20 g/L BSA的磷酸盐缓冲液对细胞进行破膜,10 min后应用磷酸盐缓冲液清洗细胞3次,每次5 min;加入适量的Phalloidin-iFluor 555抗体稀释液(1∶1 000),室温孵育60 min后,应用磷酸盐缓冲液洗细胞3次,每次5 min;最后,应用含DAPI的封片剂封片,使用倒置荧光显微镜,在Ex/Em分别为 556 nm/574 nm(Phalloidin-iFluor 555)和360 nm/460 nm(DAPI)条件下观察细胞。
1.4.4细胞氧化应激水平检测 使用ROS检测试剂盒检测含有ROS的细胞。NIH/3T3细胞在材料浸提液中培养24 h后,以磷酸盐缓冲液洗2次,加入适量稀释的DCFH-DA(用无血清培养液稀释至10 μmol/L)充分覆盖细胞,在37 ℃细胞培养箱中孵育20 min。用无血清细胞培养液洗涤细胞3次,充分去除细胞外的DCFH-DA,之后用2.5 g/L的胰蛋白酶消化细胞,以1 200 r/min离心收集细胞,使用流式细胞仪检测FITC通道阳性细胞,使用FlowJo分析数据。
1.4.5细胞凋亡检测 使用Annexin V-FITC凋亡检测试剂盒检测细胞凋亡程度。NIH/3T3细胞用不含EDTA的2.5 g/L胰蛋白酶消化后,在4 ℃下以1 200 r/min离心5 min。用预冷磷酸盐缓冲液洗涤细胞2次,以1 200 r/min 4 ℃离心5 min,收集细胞。然后用300 μL的1×染色缓冲液重悬细胞,并添加5 μL Annexin V-FITC试剂轻轻混合,在室温、避光条件下孵育15 min,之后加入10 μL的PI试剂混合,并添加200 μL的1×染色缓冲液,混匀后置于冰上,5 min内使用流式细胞仪检测FITC通道和PE通道的凋亡细胞,用FlowJo分析数据。
1.5 统计学分析
采用GraphPad Prism统计软件(Version 9 for Windows,San Diego,California,USA)进行统计学分析,两组计量资料的比较采用Studentt检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 扫描电镜观察
通过电镜观察材料的表面形貌,可以看出CS在PBS材料中的分散情况。从图1a~c可以看出,纯PBS的断口表面非常光滑;当添加CS的质量分数为0.10时, PCS1断裂表面的光滑度下降,CS分散比较均匀,同时出现少量裂纹(图1d~f);当添加CS的质量分数为0.20时,PCS2断裂表面粗糙,裂纹数量和宽度显著增加(图1g~i)。
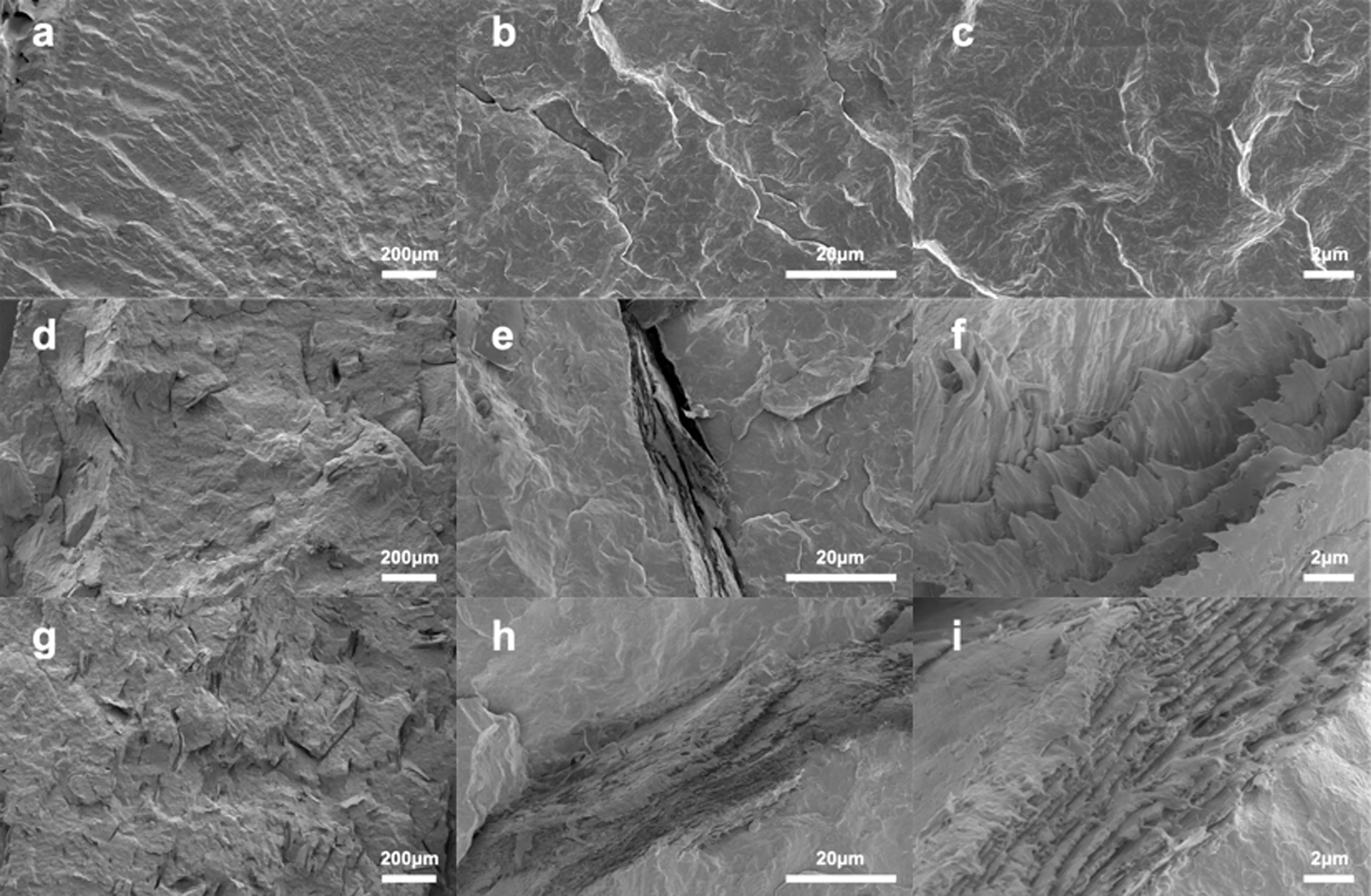
a~c:PBS;d~f:PCS1;g~i:PCS2。图1 PBS和PBS/CS的扫描电镜观察
2.2 傅立叶变换红外光谱测试
CS的红外特征峰如图2a所示:3 420 cm-1为O-H与N-H伸缩振动的叠加,1 654 cm-1为乙酰基中C=O伸缩振动(酰胺Ⅰ),1 153 cm-1为C6位上C-OH伸缩振动,1 078 cm-1和1 027 cm-1均为糖环骨架伸缩振动[17-18]。PBS的红外特征峰见图2b:2 942 cm-1为CH2的对称伸缩振动,1 713 cm-1为羰基伸缩振动,1 152 cm-1为C-O-C反对称伸缩振动,803 cm-1为OC(CH2)2COO中CH2的面内摇摆振动。添加不同含量的CS所制备的PBS/CS共混材料的红外图谱(图2c、d)与纯PBS的红外图谱总体上是相似的,图谱中所出现的2 942 cm-1、1 713 cm-1、1 152 cm-1、803 cm-1峰均对应于纯PBS基体的峰[19];然而,在3 420 cm-1处的吸收峰是O-H与N-H伸缩振动的叠加,是CS的特征峰,说明CS已成功地掺入到 PBS基体中。
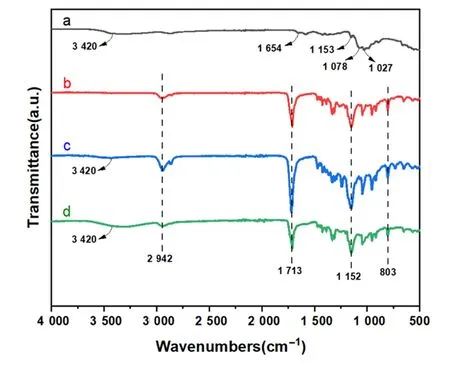
a:CS;b:PBS;c:PCS1;d:PCS2。图2 傅立叶变换红外光谱测试
2.3 3D打印心脏补片
本研究成功打印出多孔ASD补片。为了打印出易于内皮细胞攀附、促进组织再生的ASD补片,将补片的孔隙大小设置为5 mm,打印成尺寸大小为40 mm×40 mm的方形或者直径40 mm的圆形。在试打印过程中发现PCS2存在挤出不均匀的问题,成型困难,严重影响了补片的打印精度,故选用PCS1进行ASD补片的打印。由于PCS1结晶速度较慢,打印时无法瞬时结晶,所以在尺寸上存在一定的误差。PCS1材料3D打印实际测量到的补片孔径约为1 mm,厚度为0.67 mm。另外,PCS1材料3D打印出的补片具有良好的弹性,可弯折,且对折后可以恢复到原来的形状。因此,选用PCS1材料进行下一步细胞相容性测试。见图3。

a:补片打印中;b~d:不同形态ASD补片的尺寸测量;e:补片弯折测试。图3 PCS1打印ASD补片及补片尺寸测量
2.4 细胞学测试
为了评价PCS1对细胞的影响,对PCS1的浸提液进行NIH/3T3细胞实验。通过测定细胞内ROS水平,确定细胞对PCS1浸提液的氧化应激程度。结果显示,PCS1组(用PCS1浸提液培养)细胞与对照组(未用PCS1浸提液培养)细胞ROS水平差异无显著性(t=1.054,P>0.05)(图4a~c)。用phalloidin和DAPI孵育细胞,细胞骨架被phalloi-din染为红色,细胞核被DAPI染为蓝色,将细胞骨架和细胞核图像合并后,细胞骨架出现在细胞核的位置,然后观察细胞形态的变化。结果显示,对照组和PCS1组细胞形态没有显著差异(图4d)。
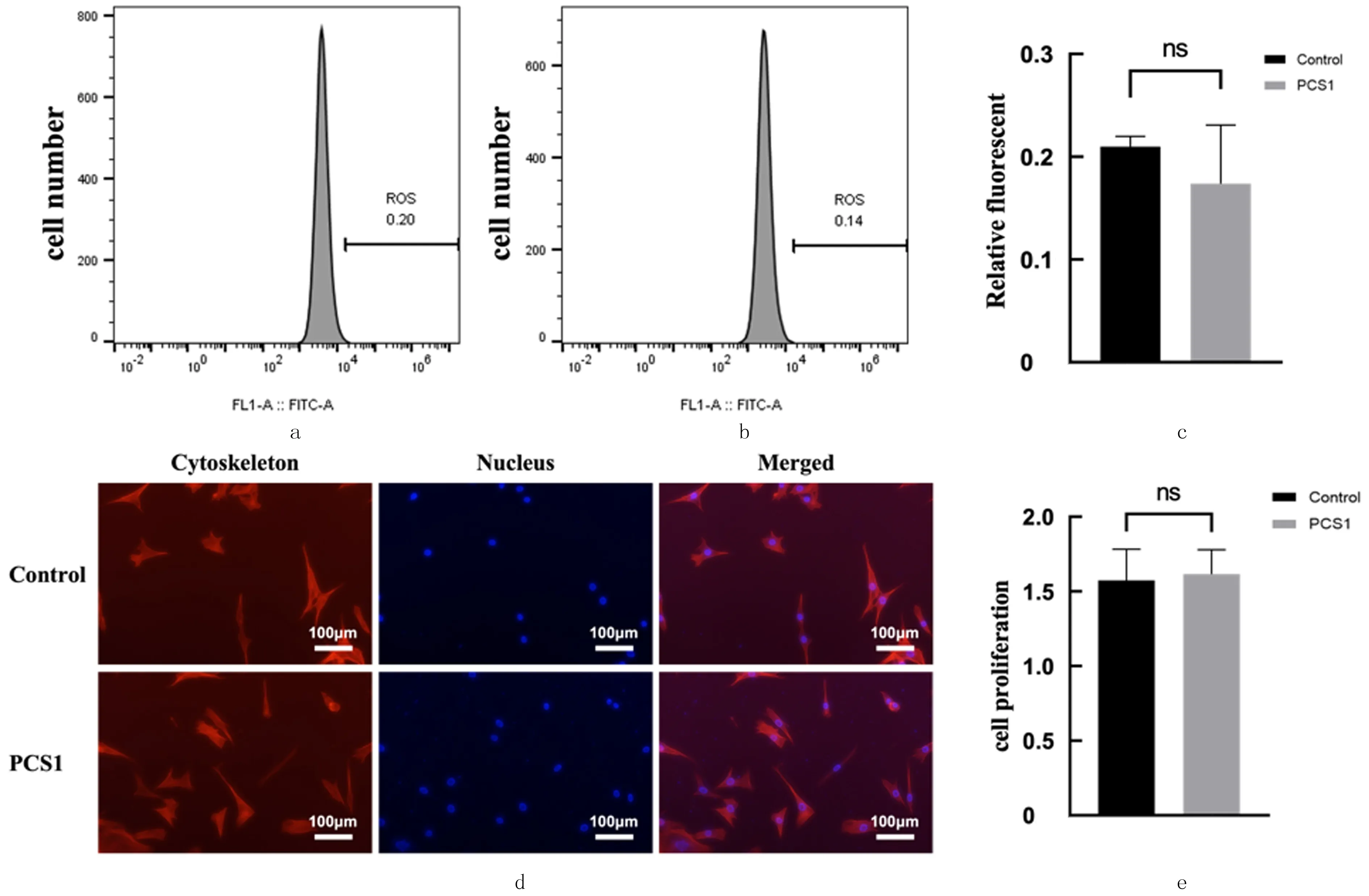
a:对照组ROS检测;b:PCS1组ROS检测;c:对照组与PCS1组ROS水平比较;d:phalloidin染色(细胞骨架,红色)和DAPI染色(细胞核,蓝色)观察细胞形态;e:对照组与PCS1组细胞增殖比较。图4 PCS1对NIH/3T3细胞影响的氧化应激、细胞增殖检测及细胞形态观察
CCK-8法检测结果显示,两组细胞的吸光度比较差异无显著性(t=0.363,P>0.05),表明PCS1材料浸提液对NIH/3T3细胞增殖无显著影响(图4e)。Annexin V-FITC/PI法检测NIH/3T3细胞凋亡,结果显示,在早期对照组细胞凋亡很难检测到,而且对照组与PCS1组细胞凋亡没有明显差异(t=0.256,P>0.05);在晚期PCS1组细胞凋亡也很难检测到,且对照组与PCS1组细胞凋亡差异无统计学意义(t=0.312,P>0.05)。见图5。

a:对照组细胞凋亡流式分析;b:对照组与PCS1组早期凋亡分析;c:PCS1组细胞凋亡流式分析;d:对照组与PCS1组晚期凋亡分析。图5 PCS1对NIH/3T3细胞影响的凋亡程度检测
3 讨 论
近10年来,采用镍钛合金封堵器经导管封堵治疗先天性心脏病具有操作简便、安全性高和早期并发症少等优点,因而得到广泛的应用。但随着对该类手术病人的长期随访发现,其不良反应和并发症的发生风险显著增高,开发可降解封堵器具有必要性和前瞻性,可为医学组织再生和修复领域提供更多的可能性[20]。
最近的研究结果表明,聚酯类高分子材料在医学中具有广泛的应用前景,其中最为常见的聚酯类材料为脂肪族聚酯,例如聚乳酸(PLA)、聚己内酯和PBS等,因其降解产物安全无毒,可随人体代谢排出体外,故被广泛用于骨和软骨的修复以及其他组织再生等领域研究[21-22]。可降解高分子材料的降解过程复杂,尤其是体内降解,是降解与吸收同步进行的过程,常伴随机体不同程度的免疫炎症反应。目前关于材料降解的研究大多还停留在植入部位的观察和检测阶段,并未深入研究其代谢、吸收、分布等的影响,仅有少数可降解材料,如PLA、聚己内酯被美国食品药品监督管理局认证可作为医学植入物进入人体。本研究选用PBS作为基体材料进行材料学和细胞学的测试,为扩大生物可降解材料的应用种类及范围提供了必要支持。
CS已被证明是一种安全无毒的生物多糖。目前,大量研究表明,CS在医疗领域具有广泛的应用前景。将生物多糖添加到聚酯材料中对于提高聚酯材料的生物相容性和降解率、促进细胞黏附等起到至关重要的作用。PBS单体可由石油基材料合成,也可由生物基材料发酵获得,其主要降解产物是琥珀酸,琥珀酸是人体三羧酸循环的中间产物,最终降解为二氧化碳和水[23]。由于降解产物的安全性,PBS目前也被广泛应用于食品包装等领域[24]。尽管PBS具有优异的综合性能,但同时也具有结晶速度慢和拉伸强度低的缺点,因此对PBS进行改性或多种材料与PBS复合是目前PBS应用的主要方式。当PBS用作药物释放载体时,可制成PBS/PLA包覆二水合酒石酸钠盐微胶囊,实现短周期内的扩散释放;也可采用溶剂挥发法来制备聚(丁二酸丁二醇酯-共-己二酸丁二醇酯)肠吸收胰岛素颗粒,为糖尿病病人的治疗提供新的方向[25-26]。除此之外,PBS还可用于软组织修复以及组织工程支架材料等领域,在与CS混合后可加工成支架材料,CS具有促进伤口愈合、抑制感染、调节免疫等功效[27]。
本研究初步测试PBS/CS共混后3D打印ASD补片的可行性,对PBS、PBS/CS的材料表征进行测试分析,扫描电镜观察到复合材料表面平整度有所差异。当CS质量分数为0.10时,在熔融共混过程中,分子内链和分子间链之间的氢键断裂,CS与PBS基体之间形成新的氢键,使材料具有更好的相容性。当CS含量进一步增加时,由于CS的聚集,PCS2复合材料的断裂表面观察到CS呈不均匀分布。由于PBS聚合物是疏水材料,亲水性的CS在PBS基体中的聚集是不可避免的。当CS的含量较高时,熔融过程中产生的剪切力不足以促进CS在PBS基体中的均匀分散。CS的聚集现象和非均相分散会导致复合材料力学性能的退化。由于CS的加入,该复合材料的热学性能如结晶性和熔融温度也有所改变。相较于纯PBS的加工温度,PBS/CS共混后熔点降低,且加工时扭矩降低,表明材料在高温下流动性较好。与PCS1相比,PCS2分散的较不均匀,这是由于CS在高温下大量聚集,与PBS出现相分离现象,两者无法均匀混合。将PCS1与PCS2分别打印,由于PCS2中CS含量较多,导致打印过程中材料无法快速结晶成型,打印尺寸误差较大。
在细胞相容性测试中,对细胞进行氧化应激水平检测尤为关键。ROS包括超氧自由基(O2-)、过氧化氢(H2O2)和羟基自由基(-OH),在人的正常代谢和病理过程中发挥重要作用。ROS产生过多,可能会引起炎症、坏死和瘢痕形成,导致皮肤伤口愈合时间延长,并抑制受损组织的再生[28]。通过检测细胞内ROS水平,可以判断材料浸提液是否影响细胞的氧化应激。本文结果显示,PCS1组细胞与对照组细胞ROS水平差异无显著性。而且,PBS与CS熔融共混后不会产生新的物质,PCS1共混材料如纯PBS和纯CS一样,不会影响细胞的凋亡和增殖。
3D打印技术近年来得到很大的发展,尤其是生物打印,在制作仿生材料领域已成为主流的加工方式。随着数字科技的发展,3D打印也更加多样化,从传统的热熔沉积打印到数字投影打印,实现了高效、精准制作的一大进步[29]。本研究采用热熔沉积打印发现,该技术在应用于PBS/CS复合材料时存在一些局限性。例如,熔融材料在挤压后的结晶速度较慢,导致打印尺寸与理论尺寸有误差;长时间高温打印可能使CS在高温下分解,从而降低材料性能。因此,改进打印方式、进一步提高打印精度是今后研究的重点。
综上所述,本研究创新性地将PBS与CS熔融共混后3D打印制作ASD补片,经材料表征测试发现两者具有一定的材料相容性,CS的加入改善了PBS的热学性能和亲水性,证明通过3D打印技术将PBS/CS共混材料制作成ASD补片是可行的,并且细胞实验显示该材料浸提液对细胞无明显毒性。

