复杂性肝癌手术治疗的效果及相关影响因素分析
巴 雪 裴理辉 柴宇霞
(ThePracticalJournalofCancer,2023,38:0092~0094)
肝癌是国内外常见的恶性肿瘤,据相关资料显示,全世界每年有45~100万人死于肝癌,而我国约占其中的43.7%[1]。肝癌起病隐匿、病情进展迅速,一旦发展至中晚期,会错失最佳手术治疗时间,且对放化疗耐受差,导致患者生存率下降。随着医疗水平的提高及国民对健康的重视程度,早期肝癌检出率得以提高。目前,外科手术是治疗早期肝癌首选方法,通过切除患有肿瘤的肝脏组织,可有效控制疾病发展。大量研究显示,行肝癌切除术的患者5年生存率可达40%[2-3]。近年来,国内外在肝癌外科领域取得较大的进展,对于复杂性肝癌和病情较为严重的肝癌均可进行治疗,但手术风险仍然存在。鉴于此,本研究探讨复杂性肝癌切除术的治疗效果,并分析其相关影响因素。现报告如下。
1 资料与方法
1.1 一般资料
选取2017年5月至2019年5月我院收治的90例复杂性肝癌患者。纳入标准:年龄≥30岁;经病理学和临床诊断确诊;均符合手术指征;术前肝功能Child-Pugh分级A级或B级;预计生存期>6个月;临床资料完整;患者或家属知情同意。排除标准:精神疾病者;合并重要脏器功能障碍者;肝内及远处转移者;合并其他恶性肿瘤者;合并血液系统、内分泌疾病及心脑血管疾病者。
1.2 方法
所有患者均行肝癌切除术,术后随访2年,统计患者生存情况,按照生存情况分为生存组和死亡组。收集患者临床资料,包括性别、年龄、术前Child-Pugh分级、肝硬化程度、肿瘤包膜、肿瘤最大直径、术前甲胎蛋白(AFP)、乙肝表面抗原(HBsAg)、门静脉癌栓、胆管癌栓、第一肝门阻断次数、麻醉时间、术中出血量、术中输血量等,采用单因素及多因素Logistic分析影响患者生存的相关影响因素。
1.3 统计学分析
2 结果
2.1 生存情况
术后随访2年,90例复杂性肝癌患者中有42例生存,占46.67%,死亡48例,占53.33%。
2.2 复杂性肝癌切除术后生存情况单因素分析
两组性别、年龄、术前Child-Pugh分级、术前AFP、HBsAg、胆管癌栓、第一肝门阻断次数、麻醉时间、术中输血量比较,差异无统计学意义(P>0.05);生存组中度或重度肝硬化、肿瘤最大直径>5 cm、合并门静脉癌栓、术中出血量>700 ml比率低于死亡组,差异有统计学意义(P<0.05),见表1。
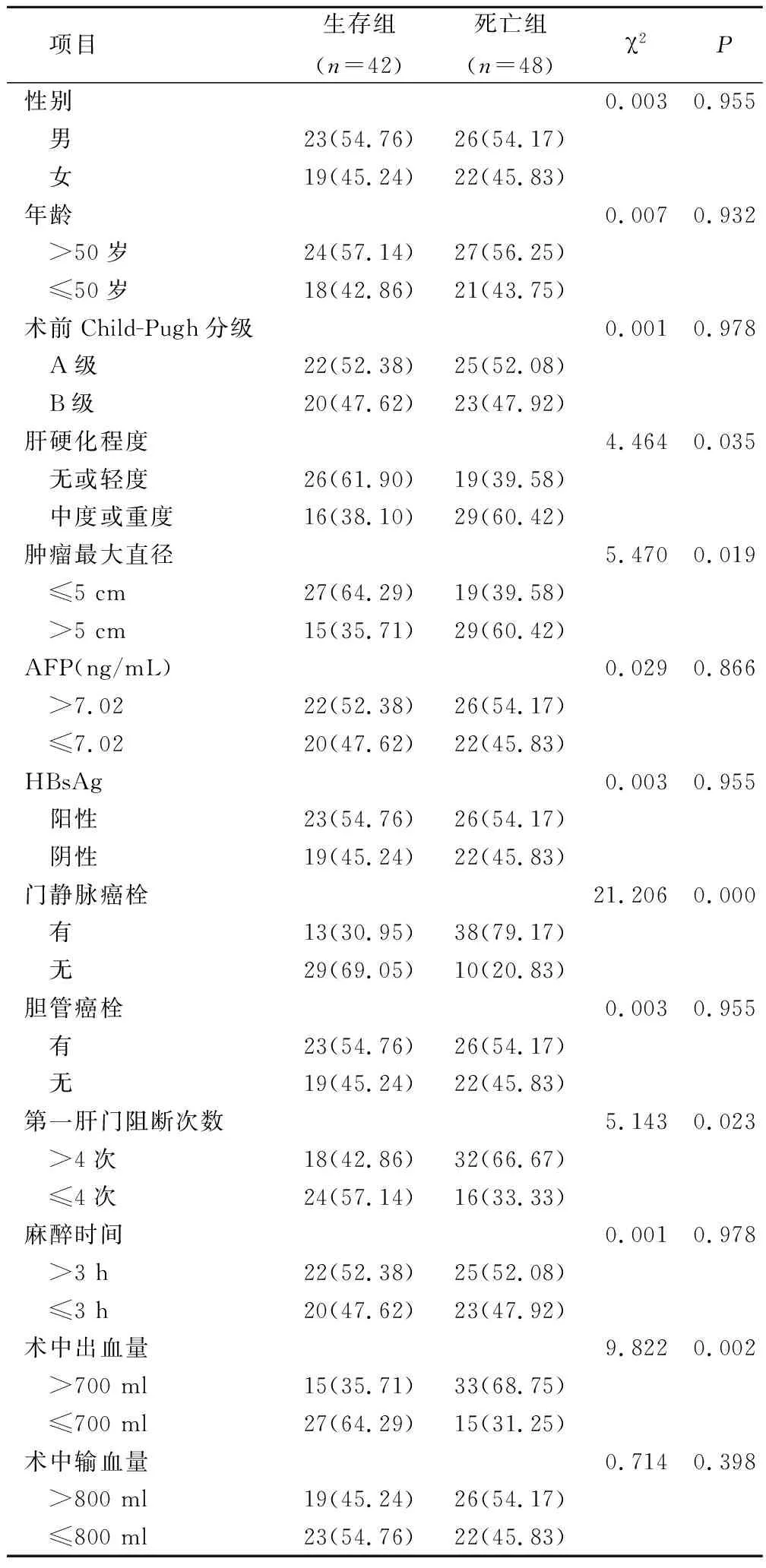
表1 复杂性肝癌切除术后生存情况单因素分析(例,%)
2.3 复杂性肝癌切除术后生存情况多因素Logistic回归分析
多因素Logistic回归分析显示,中度或重度肝硬化、肿瘤最大直径>5 cm、合并门静脉癌栓、术中出血量>700 ml均是复杂性肝癌切除术后生存情况的独立危险因素。见表2。

表2 复杂性肝癌切除术后生存情况多因素Logistic回归分析
3 讨论
肝癌发病机制尚不十分明确,多认为与遗传、饮水及食物、病毒性肝炎等因素有关,其是发病率仍呈上升趋势[4-5]。手术切除是现阶段治疗肝癌最有效方法,随着普外科各种技术的发展,其安全性和有效性得到提高[6-7]。然而对于复杂性肝癌,其病灶位置较为特殊,术后预后不佳。复杂性肝癌预后与多种因素有关,故了解预后相关影响因素,对延长患者生存时间、改善预后具有重大意义。
本研究对我院90例行复杂性肝癌切除术患者的临床资料进行分析,结果显示,中度或重度肝硬化、肿瘤最大直径>5 cm、合并门静脉癌栓、术中出血量>700 ml均是复杂性肝癌切除术后生存情况的独立危险因素。分析原因在于:①中度或重度肝硬化:肝脏实质损伤对肝癌患者预后具有重大影响,中重度肝硬化患者肝功能损害严重,会进一步加重肝癌进程,增加死亡风险,故治疗效果差,预后亦不理想[8-9]。②肿瘤最大直径>5 cm:肿瘤直径与肝癌转移、侵袭能力密切相关,肿瘤直径越大,肿瘤微血管侵犯、多发的比例越大,手术治疗难度增加,无法彻底清除肿瘤组织,导致术后复发率较高,降低患者生存率[10-11]。③合并门静脉癌栓:肝癌属恶性程度较高的肿瘤,多合并门静脉癌栓,发生率约为20%~70%[12]。门静脉癌栓可引起肝功能恶化、门静脉高压症、肝外转移及肝内广泛播散等,是导致术后复发的重要因素,故临床治疗效果、预后均较差。④术中出血量>700 ml:术中出血量大一方面会增加术后并发症发生率,另一方面会造成输血量增多,使外周血液中淋巴细胞数量下降,引起细胞毒性T功能和自然杀伤细胞抑制,影响免疫功能,增加术后感染和肿瘤复发率[13]。因此,术前应对复杂性肝癌患者进行充分评估,重视肝周韧带解剖,充分游离肝脏,控制术中出血量,加强随访,及时发现肿瘤转移和复发,并加以治疗,以提高患者生产率。
综上所述,中度或重度肝硬化、肿瘤最大直径>5 cm、合并门静脉癌栓、术中出血量>700 ml均是复杂性肝癌切除术后生存情况的独立危险因素,临床治疗应高度重视上述危险因素的识别,积极控制术中出血量,提高手术效果,以改善患者预后。

