miR-371a-5p靶向BTG3对结直肠癌细胞放射敏感性的影响
陈公安 王 刚 王贺玲 张 伟
(ThePracticalJournalofCancer,2023,38:0011~0015)
结直肠癌(colorectal cancer,CRC)约占所有癌症病例和死亡人数的10%,并且5年生存率低于50%[1]。外科手术、放射治疗和化学疗法是治疗CRC的基石,但放射抗性的存在是CRC治疗的一大障碍[2]。在过去的几十年中,发现微小RNA(microRNA,miRNA)是CRC发病、进展和放射抗性的关键调节剂或潜在生物标志物[3-4]。miRNA是一类小的非编码RNA,包含18~24个核苷酸,在转录后起调节剂的作用。最近基于miRNA调控网络的生物标志物预测结直肠癌对新辅助放化疗的反应的研究发现,miR-371a-5p可用于预测CRC对术前放化疗的反应,且miR-371a-5p在结直肠癌HT-29细胞中上调表达[5]。然而,miR-371a-5p对结直肠癌HT-29细胞放射敏感性的影响及机制仍不十分清楚。miRNA通常通过与靶基因的3'-非翻译区(3'-UTR)特异性结合而导致翻译抑制或RNA降解,参与调节不同癌症的放射反应,以增加敏感性或保护细胞免受放射作用[6]。B细胞转位基因3(B-cell translocation gene 3,BTG3)属于ErbB2家族成员,据报道,BTG3是候选的肿瘤抑制剂,其可抑制细胞增殖和迁移,并调节肿瘤的细胞周期进程[7]。有研究显示,缺氧诱导的BTG3的下调赋予了对CRC放射治疗的抵抗力[8]。本研究前期通过生物信息学预测发现,BTG3是miR-371a-5p的潜在靶基因。因此,本研究旨在研究miR-371a-5p靶向BTG3对CRC细胞放射敏感性的影响,以期为增强CRC患者放疗敏感性提供新的方向。
1 材料与方法
1.1 细胞和主要试剂
人结直肠癌细胞HT-29(中国科学院上海细胞库);Lipofectamine 2000转染试剂(美国Invitrogen);DMEM培养基、胎牛血清、青-链霉素双抗(美国Gibco);RNA提取试剂盒(北京索莱宝);SYBRTMGreen Master Mix试剂盒和M-MLV逆转录试剂盒(赛默飞生物);Annexin V-FITC/PI细胞凋亡试剂盒(大连宝生物);miR-371a-5p mimics、mimics control、miR-371a-5p inhibitors、inhibitors control、BTG3 siRNA、siRNA control、BTG3-Wt和BTG3-Mut重组荧光素酶报告基因载体质粒(上海吉玛制药);双荧光素酶报告基因检测试剂盒(美国Promega);BTG3单抗和IgG二抗(北京中杉金桥生物),BCA蛋白定量检测试剂盒(上海碧云天);CCK-8(日本同仁)。
1.2 细胞培养和转染
结直肠癌HT-29细胞培养在含10%胎牛血清和双抗(100 U/mL青-链霉素)的DMEM培养基中,放置在5%CO2、37℃培养箱进行培养,根据细胞生长状况更换新鲜培养液,采用0.25%胰蛋白酶消化细胞进行传代培养。
取对数期的HT-29细胞于转染前24 h种植到24孔板中,培养细胞至60%汇合时进行转染处理。使用opti-MEM培养液分别稀释BTG3 siRNA、siRNA control、miR-371a-5p inhibitors、inhibitors control,另外,采用等量opti-MEM培养液稀释转染试剂Lipofectamine 2000,均孵育5 min,随后将两种混合物混匀,室温孵育20 min,将混合液添加到24孔板细胞中,培养6 h后更换成完全培养液,继续培养48 h进行后续功能实验。其中转染miR-371a-5p inhibitors的HT-29细胞记为anti-miR-371a-5p组,转染inhibitors control的HT-29细胞记为anti-miR-NC组,共转染miR-371a-5p inhibitors和BTG3 siRNA的HT-29细胞记为anti-miR-371a-5p+si-BTG3组,转染miR-371a-5p inhibitors和siRNA control的HT-29细胞记为anti-miR-371a-5p+si-NC组。转染48 h后采用qPCR检测转染效率。
1.3 qPCR实验检测miR-371a-5p的表达
收集转染48 h后anti-NC组和anti-miR-371a-5p组各组HT-29细胞,根据说明手册,使用RNA提取试剂盒从各组HT-29细胞中提取总RNA,即收集约106个细胞,向细胞中加入1 mL细胞裂解液,室温孵育5 min,再加入0.2 mL氯仿,振荡15 s,室温静置5 min,4 ℃ 12000 rpm离心10 min,上清转移至新的离心管,洗涤后加无酶ddH2O溶解,即得到RNA。然后,按照制造商的说明,使用M-MLV逆转录酶进行逆转录实验,向无酶离心管中加入2 μg总RNA,2 μL Oligo(dT)引物,加无酶ddH2O至14.5 μL,70 ℃孵育5 min,取出冰上冷却2 min,向离心管中加入4 μL 5×M-MLV Buffer、1 μL dNTPs、0.5 μL Rnasin、1 μL M-MLV,42 ℃孵育60 min,待反应完成取出产物,并使用SYBRTMGreen Master Mix进行qPCR分析,反应体系:2×SYBR Green Master Mix 10 μL、上下游引物各1 μL,cDNA 4 μL加ddH2O至20 μL,程序设为:95 ℃热启动10 min,随后设40个循环,95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸10 s。以U6作为内部对照,采用2-ΔΔCt法量化miR-371a-5p的表达。引物序列如下:miR-371a-5p F 5'-ACTCAAACTGTGGGGGCACT-3';R 5'-CAGCCGCCACTCAAACTGTGGGG-3';U6 F 5'-GCAAGGATGACACGCAAATTC-3';R 5'-TGCGGGTGCTCGCTTCGGCAGC-3'。
1.4 CCK-8实验检测细胞增殖能力
将转染的细胞以5×103个/孔接种到96孔板中,并在37 ℃下孵育24 h。以模拟照射(0 Gy)或4 Gy X射线照射后,将10 μL的CCK-8溶液添加到每个孔中,孵育3 h。最后,在450 nm处测定细胞吸光度(OD)值。
1.5 流式细胞术检测细胞凋亡率
将转染的细胞以5×103个/孔接种到96孔板中,并在37 ℃下孵育24 h,以模拟照射(0 Gy)或4 Gy X射线照射后,收集约106个细胞,采用400 μL binding buffer重悬细胞,向细胞悬液中分别加入5 μLAnnexin V-FITC和PI染液,室温避光孵育20 min,再向细胞悬液中加入100 μL binding buffer,立即使用流式细胞仪测量细胞凋亡率。
1.6 克隆形成实验检测细胞的放射敏感性
将转染的各组HT-29细胞以5×103个/孔接种于6孔板中,并在37 ℃下孵育24 h。模拟照射(0 Gy)或用不同剂量(2、4、6、8、8 Gy)的X射线照射后,将细胞在37 ℃下培养约2周,待克隆形成,将菌落用4%多聚甲醛固定15 min,并用0.1%结晶紫溶液染色15 min,最后,计数包含50个以上细胞的阳性菌落的数量,分析细胞存活率。
1.7 双荧光素酶报告基因实验
将生物信息学软件TargetScan预测的含有miR-371a-5p靶位点的BTG3的3'UTR部分序列及含突变位点的序列亚克隆到psiCHECK-2载体中,分别构建BTG3-Wt和BTG3-Mut重组载体质粒。然后将重组载体分别miR-371a-5p mimics或mimics control共转染HT-29细胞。48 h后,收集细胞并用双荧光素酶报告基因测定系统裂解细胞以进行荧光素酶活性测定。
1.8 Western blot检测BTG3的表达水平
使用补充有蛋白酶抑制剂混合物的预冷RIPA裂解缓冲液裂解细胞,将细胞在4 ℃下以12 000 rpm离心15 min,收集含有蛋白质的细胞上清液。通过BCA蛋白质测定法确定蛋白质浓度,向蛋白质中加入等体积上样缓冲液,沸水浴加入10 min致蛋白变性。随后,通过SDS-PAGE电泳分离每个泳道中的30 μg蛋白质样品,浓缩胶电压80 V,分离胶电压120 V,将其转移到硝酸纤维素膜上,转膜电压120 V,用5%脱脂牛奶室温封闭2 h,采用TBST洗膜3次,每次15 min,将膜与抗BTG3的一抗(1∶800稀释)在4 ℃孵育过夜,采用TBST洗膜3次,每次15 min,在室温下用标记有辣根过氧化物酶(HRP)的二抗室温孵育1 h。采用TBST洗膜3次,每次15 min,使用ECL底物将蛋白质信号可视化,使用Image J软件进行定量。
1.9 统计学分析

2 结果
2.1 转染miR-371a-5p inhibitors的干扰效果
qPCR检测转染48 h各组HT-29细胞中miR-371a-5p的表达水平,与anti-NC组相比,anti-miR-371a-5p组中miR-371a-5p的表达水平明显下降(1.00±0.09 vs 0.35±0.04,t=11.431,P<0.05)。
2.2 下调miR-371a-5p或/和照射对HT-29细胞增殖和凋亡的影响
如图1和表1,与anti-NC组相比,anti-miR-371a-5p组、4 Gy组和4 Gy+anti-miR-371a-5p组细胞增殖能力明显降低(P<0.05),细胞凋亡率明显升高(P<0.05);与anti-miR-371a-5p组相比,4 Gy+anti-miR-371a-5p组细胞增殖能力降低(P<0.05),凋亡率升高(P<0.05);与4 Gy组相比,4 Gy+anti-miR-371a-5p组细胞增殖能力降低(P<0.05),凋亡率升高(P<0.05)。
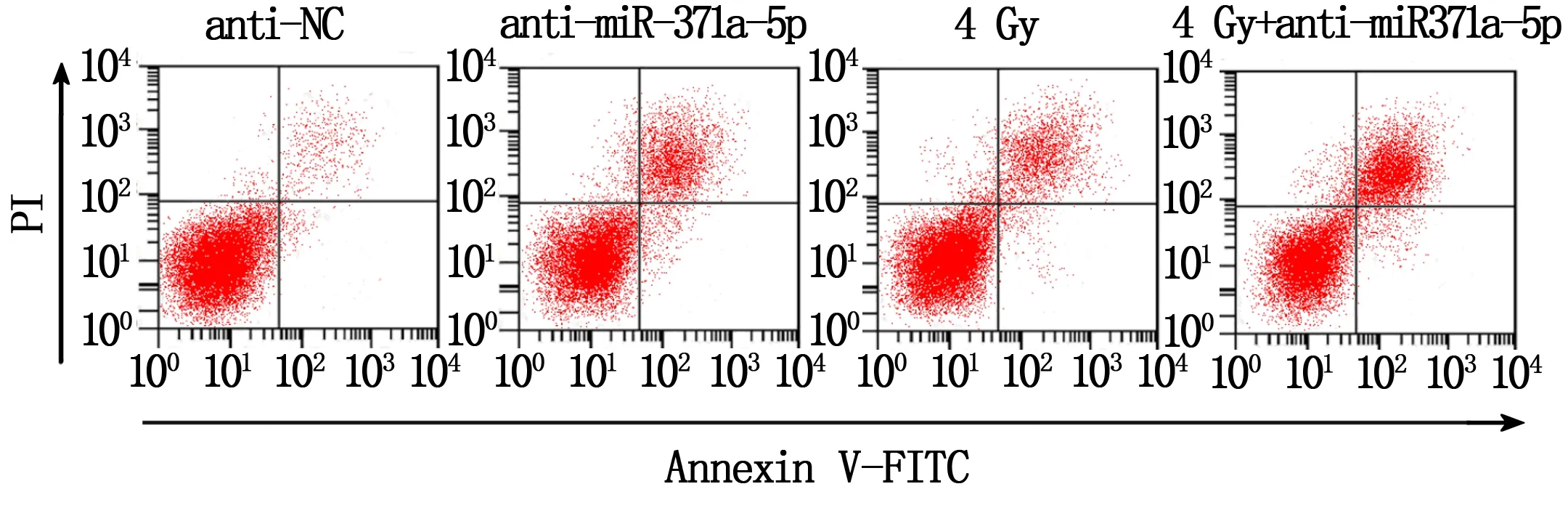
图1 流式细胞术检测HT-29细胞凋亡率
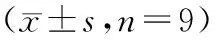
表1 各组HT-29细胞OD值和凋亡率比较
2.3 下调miR-371a-5p对HT-29细胞放射敏感性的影响
如表2,与anti-NC组相比,anti-miR-371a-5p组细胞在接受2、4、6、8 Gy剂量X射线照射后细胞存活率均明显降低(P<0.05),提示下调miR-371a-5p能够增加HT-29细胞的放射敏感性。
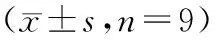
表2 X射线对下调miR-371a-5p的HT-29细胞存活率的影响
2.4 miR-371a-5p靶向负调控BTG3
如图2和表3,生物信息学在线软件TargetScan分析miR-371a-5p和BTG3 3'UTR存在互补结合位点。双荧光素酶检测系统结果显示,与miR-NC组相比,共转染BTG3-Wt的miR-371a-5p组细胞相对荧光素酶活性明显降低(P<0.05),而共转染BTG3-Mut的miR-371a-5p组细胞相对荧光素酶活性无明显改变(P>0.05)。Western blot检测结果显示,与anti-NC组相比,anti-miR-371a-5p组细胞中BTG3的表达明显升高(P<0.05),见图3、表4。

图2 生物信息学预测miR-371a-5p和BTG3的靶向结合位点
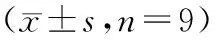
表3 双荧光素酶检测系统鉴定细胞的相对荧光素酶活性

图3 Western blot检测各组HT-29细胞中BTG3的表达
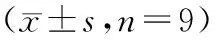
表4 各组HT-29细胞中BTG3表达水平比较
2.5 抑制BTG3对HT-29细胞放射敏感性的影响
为验证miR-371a-5p靶向BTG3调控HT-29细胞的放射敏感性,本实验在HT-29细胞中同时抑制miR-371a-5p和BTG3,将共转染miR-371a-5p inhibitors和BTG3 siRNA的HT-29细胞记为anti-miR-371a-5p+si-BTG3组,转染miR-371a-5p inhibitors和siRNA control的HT-29细胞记为anti-miR-371a-5p+si-NC组,随后以4 Gy的射线照射,结果如图4和表5,与4 Gy+anti-miR-371a-5p+si-NC组相比,4 Gy+anti-miR-371a-5p+si-BTG3组HT-29细胞增殖能力升高(P<0.05),细胞凋亡率降低(P<0.05),细胞存活率上升(P<0.05),可见抑制BTG3降低了HT-29细胞的放射敏感性。
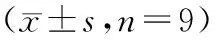
表5 各组HT-29细胞OD值、凋亡率和细胞存活率比较

图4 流式细胞术检测共转染组细胞的凋亡率
3 讨论
CRC是世界上最常见的癌症之一,对人类健康和生命构成巨大威胁,每年估计有180万新病例和90万例死亡[9]。新辅助疗法放疗是局部晚期CRC患者的标准治疗策略,然而许多CRC患者具有放射抵抗性,预后较差[10]。因此,对与放射抵抗有关的分子机制进行深入了解有助于改善放射治疗的结果。miRNA通常通过结合靶基因的3'-UTR引起翻译抑制。越来越多的证据表明,miRNA的表达失活与肿瘤放射抗性之间密切相关[11]。例如,miR-142-3p在体外可减弱乳腺癌干细胞的特性并降低其放射抗性[12]。外泌体miR-93-5p通过下调FOXA1和上调TGFB3的表达降低CRC细胞的放射抗性[13]。miR-107增强了辐射诱导的G1/S期细胞周期阻滞,并通过抑制p21和CHK2的磷酸化来抑制凋亡,该研究结果提示miR-107介导的GRN调节对电离辐射的应答,并可能促进前列腺癌治疗的治疗策略[14]。有研究发现在抗辐射的CRC细胞系中失调了一些miRNA,这些miRNA的上调或下调可以保护细胞免受辐射作用[15]。但是,需要更多新颖的miRNA生物标志物来阐明CRC放射抗性的潜在机制。
已有研究发现,miR-371a-5p在某些恶性肿瘤中与肿瘤的发生、进展和放射抵抗密切相关[16]。同样,Zhu等[5]的研究表明,miR-371a-5p在CRC中表达上调,且可以作为CRC细胞放化疗抗性的调节剂,而其对CRC细胞放射敏感性的影响和机制尚不明确。因此本实验以CRC细胞HT-29为研究对象,通过转染miR-371a-5p inhibitors干扰miR-371a-5p的表达,结果发现,干扰miR-371a-5p的表达后,HT-29细胞增殖能力降低,凋亡率升高,且对放射的敏感性增加。这些结果表明,抑制miR-371a-5p能够有效提高HT-29细胞的放射敏感性。此外,本实验通过TargetScan在线网站进行的生物信息学分析显示,BTG3和miR-371a-5p之间存在互补位点,表明BTG3是miR-371a-5p的潜在靶标。据报道,BTG3是ErbB2家族成员,与某些癌症(例如食管癌和宫颈癌等)的肿瘤发生、进展和放射抵抗有关[17-18]。此外,miR-371a-5p在CRC中的表达明显升高,而BTG3在CRC细胞系和患者肿瘤样品中被下调。另外,BTG3在低氧诱导的CRC细胞的辐射抵抗中起着至关重要的作用[19]。这些研究结果提示,miR-371a-5p可能通过靶向负调控BTG3的表达参与CRC细胞对放射敏感性的影响。在HT-29细胞中通过抑制miR-371a-5p和BTG3的表达,结果发现,抑制BTG3能够逆转下调miR-371a-5p对HT-29细胞放射敏感性的提高。这就证实了下调miR-371a-5p是通过上调BTG3的表达增加HT-29细胞的放射敏感性。
总之,本实验证明了干扰miR-371a-5p通过直接相互作用促进BTG3的表达,提高CRC细胞的放射敏感性。本研究提供了对miR-371a-5p在调节CRC肿瘤发生和放射抵抗中的作用和分子基础的深刻见解,并提出了miR-371a-5p在CRC的预后、治疗和放射抵抗中的潜在价值。但是,本实验的结论需要通过体内实验来进一步验证。

