子宫内膜癌组织中Ki-67、p16蛋白的表达及其对手术治疗预后的评估价值
司小丽 苏宝珍
(ThePracticalJournalofCancer,2023,38:0016~0020)
手术治疗是子宫内膜癌(endometrial carcinoma,EC)患者常规治疗手段,可解除肿瘤占位效应,延长患者生存期[1]。但是,由于多种因素的影响,EC患者在手术切除后可能会出现肿瘤复发转移情况,影响预后[2]。因此,早期诊断及早期治疗,对改善EC患者预后具有积极意义。目前,肿瘤复发转移的常规诊断方法是影像学检查,诊断准确度较高,但是难以预测复发、转移的风险,在EC患者预后预测方面存在一定的局限,因此,需要寻找与EC患者预后有关的预测指标,为后续个体化治疗方案的实施提供参考。增殖细胞核抗原-67(Ki-67)是一种与细胞增殖相关的核抗原,主要存在于组织增殖核基因的核蛋白,与细胞增殖活性有关[3]。Ki-67半衰期较短,脱离细胞周期后降解较快,因而被广泛用于肿瘤细胞增殖活性检查中。研究证实,Ki-67表达与EC患者临床分期有关,Ki-67影响EC细胞的迁移、转移[4]。由此可见,Ki-67可能通过对EC患者癌细胞的增殖、迁移的影响,进一步影响患者术后预后。抑癌基因p16是近年来肿瘤组织中发现的抑癌基因,在多种恶性肿瘤中都有存在,如卵巢癌、乳腺癌等[5]。p16蛋白甲基化可促进癌细胞增殖,诱发或加重癌症[6]。由此推测,p16可能通过促进EC细胞增殖,对EC患者手术预后情况产生不利影响。基于此,本研究就Ki-67、p16在EC组织中的表达情况进行分析,总结两者对手术治疗预后的评估价值。
1 材料与方法
1.1 一般资料
经医院医学伦理委员会审核通过,选择2018年10月至2021年10月长葛市人民医院妇产科137例实施手术治疗的EC患者作为研究对象,患者与家属均签署同意书。研究对象年龄37~68岁,平均(53.31±5.68)岁;EC分型:Ⅰ型86例,Ⅱ型51例。国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)分期[7]:Ⅰ期38例,Ⅱ期45例,Ⅲ期40例,Ⅳ期14例;分化程度:高分化63例,中分化62例,低分化12例。
1.2 入选标准
纳入标准:①符合《子宫内膜癌诊断与治疗指南(第四版)》[8]中EC诊断标准;②经子宫内膜活检确诊;③初次确诊;④首次接受EC手术治疗;⑤预计生存期>3个月;⑥获得随访,且随访时间≥2年。排除标准:①术前淋巴结转移;合并子宫肌瘤、子宫腺肌症等子宫良性疾病;②合并其他部位恶性肿瘤;③合并先天性心脏病、肝肾衰竭等重要脏器疾病;④合并感染性疾病;⑤术前有放、化疗史;⑥术前有免疫制剂、性激素使用史。
1.3 方法
1.3.1 实验室指标检查方法 (1)糖类抗原(carbohydrate antigen,CA)125:采集患者空腹静脉血1 ml,以4 000 r/min转速离心10 min,离心半径为10 cm,采用全自动生化分析仪(美国雅培,i2000型),以电化学发光法测定CA125;(2)Ki-67:收集EC组织标本,甲醛溶液固定,石蜡包埋处理、切片、脱蜡水化、孵育,加入相应单抗(均购自美国abcam公司),观察染色结果,标记Ki-67(以EC细胞核内出现棕黄色颗粒为阳性染色),每张切片检测高倍镜视野(40×),计算Ki-67染色阳性细胞数所占百分比并作为Ki-67指数;(3)p16:采集EC组织标本,采用荧光定量PCR法测定抑癌基因p16表达,对标本进行两项分离,紫外吸收法检测RNA溶液纯度,合成cDNA样品后逆转录,使用实时荧光聚合酶链式反应分析仪(赛默飞,FQD-96A型),设定抑癌基因p16表达量为100,计算抑癌基因p16表达。
1.3.2 资料调查方法 入院时收集患者基线资料,包括年龄、EC分型、FIGO分期、肿瘤细胞分化程度等。
1.3.3 预后评估方法和分组方法 EC根治术后随访2年,第1年,间隔3个月复查1次;第2年间隔6个月复查1次。CT或MRI等影像学检查EC复发转移情况,复发:原病灶切除处出现新病灶;转移:淋巴结肿大(有3个及以上直径<8 cm淋巴结簇集,或单个淋巴结直径≥8 cm),且淋巴结内可见成团异型细胞。将复发或转移的患者均纳入预后不良组,未复发且未转移的患者纳入预后良好组。
1.4 统计学方法

2 结果
2.1 EC患者手术预后情况
随访2年,137例EC患者中,17例复发、4例转移,预后不良发生率为15.33%(21/137)。
2.2 不同预后的EC患者基线资料与实验室指标
预后不良组EC患者FIGO分期高于预后良好组,CA125表达、Ki-67表达高于预后良好组,p16表达低于预后良好组,差异有统计学意义(P<0.05);其余资料对比,差异无统计学意义(P>0.05)。见表1。
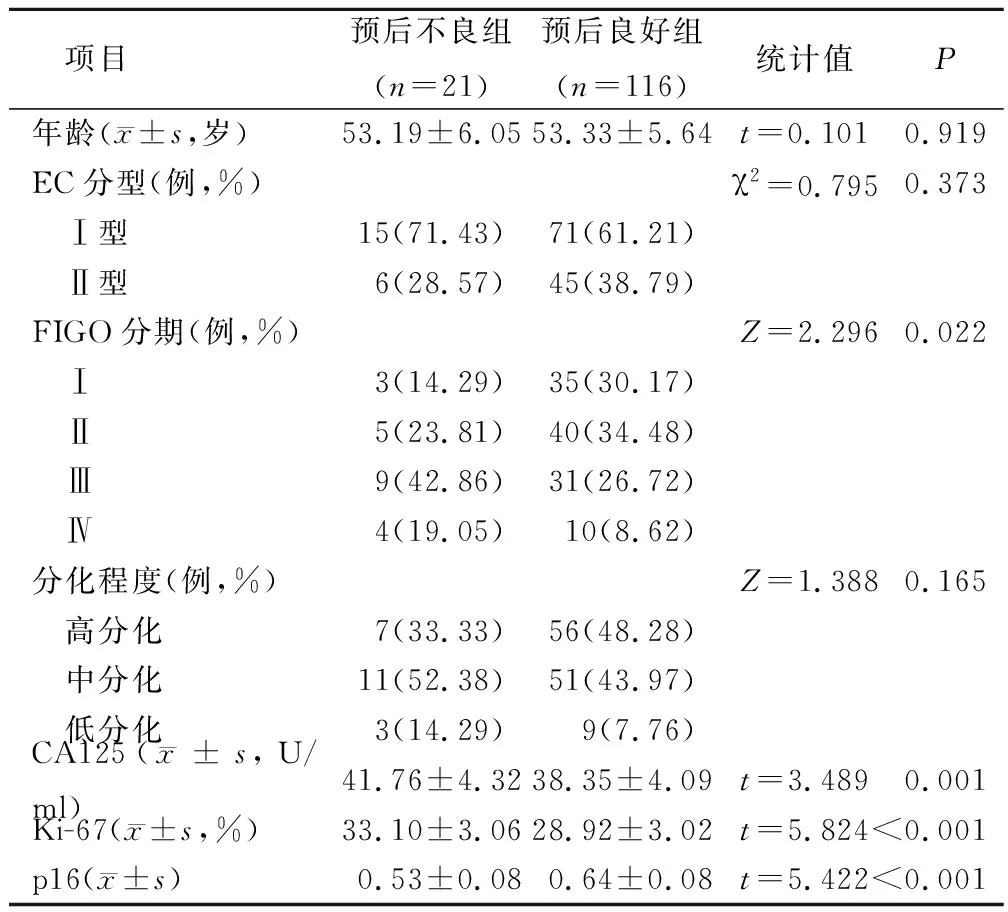
表1 不同预后的EC患者基线资料与实验室指标
2.3 EC患者手术治疗预后相关因素Logistics回归分析
将FIGO分期、CA125、Ki-67、p16作为自变量,将EC患者手术治疗预后情况作为因变量(1=预后不良,0=预后良好),经Logistic回归分析结果显示,FIGO分期高、Ki-67表达高可能是EC患者淋巴结转移的风险因子(OR>1,P<0.05),p16表达高可能是EC患者手术治疗预后的保护因子(OR<1,P<0.05)。见表2。
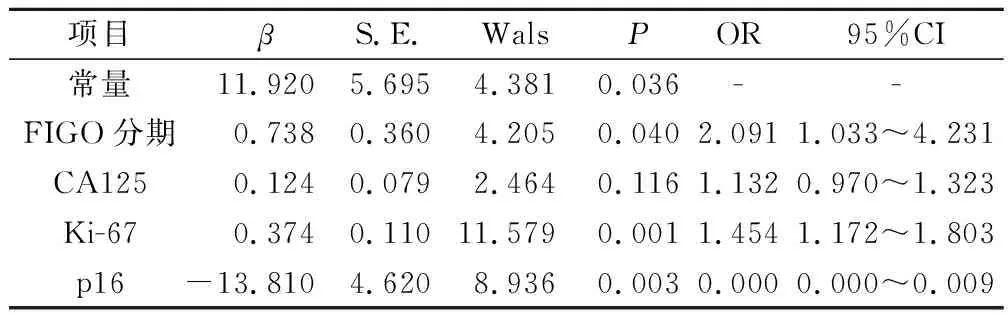
表2 EC患者手术治疗预后相关因素Logistics回归分析
2.4 子宫内膜癌患者组织中Ki-67、p16蛋白表达预测手术治疗预后的ROC曲线
将EC患者手术治疗预后情况作为状态变量(1=预后不良,0=预后良好),将子宫内膜癌组织中Ki-67、p16蛋白表达作为检验变量,绘制ROC曲线图(图1),结果显示,Ki-67、p16蛋白表达预测EC患者手术治疗预后不良的AUC分别为0.833、0.827,均有一定预测价值。相关参数见表3。
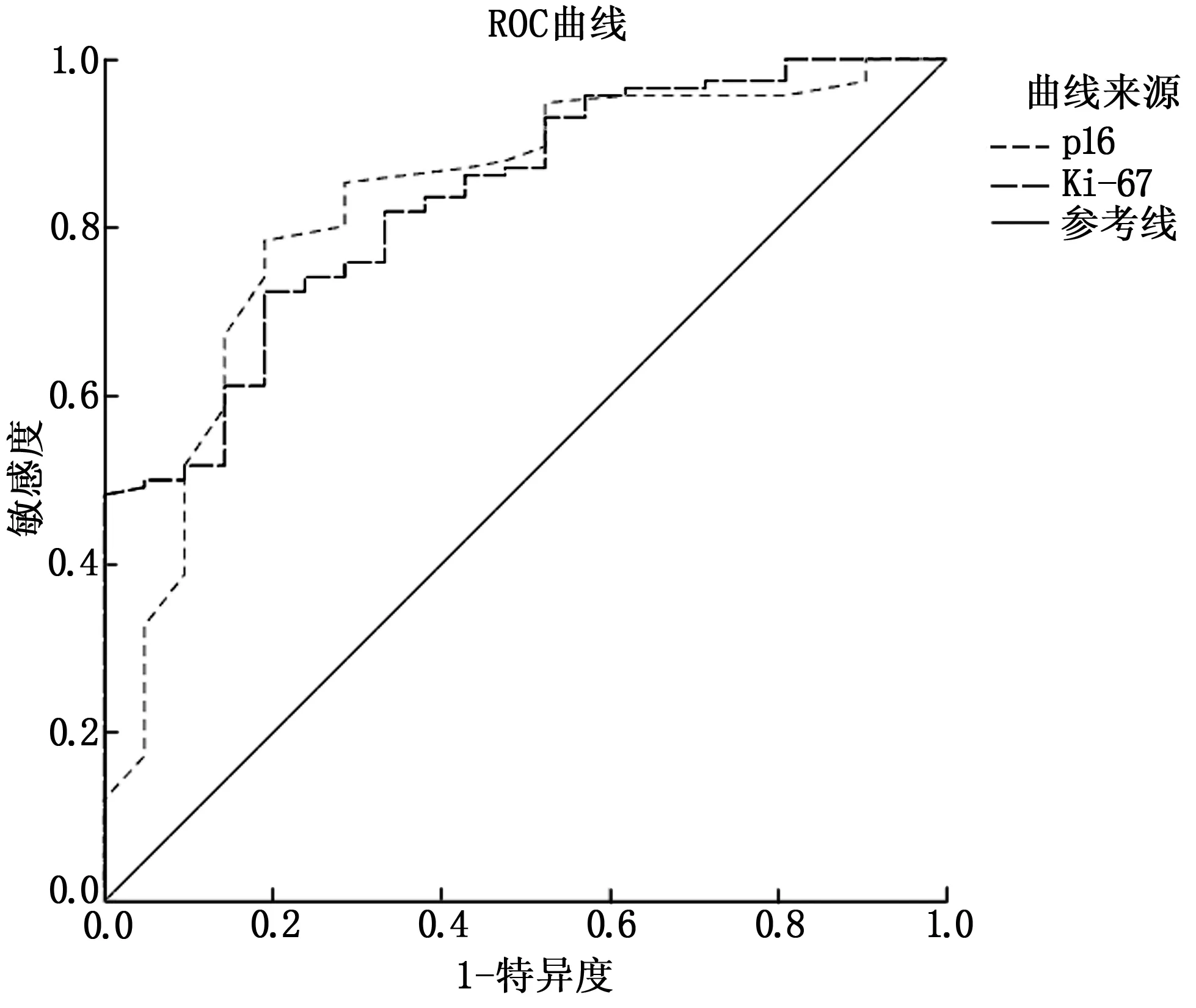
图1 子宫内膜癌患者组织中Ki-67、p16蛋白表达预测手术治疗预后的ROC曲线

表3 子宫内膜癌患者组织中Ki-67、p16蛋白表达预测手术治疗预后的ROC分析
2.5 联合子宫内膜癌患者组织中Ki-67、p16蛋白表达预测手术治疗预后的决策曲线
以净受益率为纵坐标,高风险阈值为横坐标,绘制决策曲线(图2),结果显示,在阈值0.2~1.0范围内,联合子宫内膜癌患者组织中Ki-67、p16蛋白表达预测EC患者手术治疗预后不良的净受益率优于单独某一指标,且在高风险阈值0.0~1.0内的净受益率始终大于0,始终有临床意义,净受益率最大值为0.153。
3 讨论
EC治疗目前以手术为主,手术治疗可有效遏制疾病进展,延长患者生存时间[9]。但是,患者术后仍可能会出现肿瘤复发转移情况,增加预后不良风险[10]。因此,积极找出可预测EC患者手术治疗后预后不良的相关指标,对早期干预尤为重要。
本研究结果显示,随访2年,本研究内137例EC患者中,17例复发,4例转移,预后不良发生率为15.33%。说明, EC患者术后存在较高的预后不良风险,有必要分析相关指标,指导后续EC患者预后改善。原癌基因、抑癌基因在EC的发生发展中起到重要的作用,且影响着预后情况,其中,Ki-67是一种细胞核相关抗原,在增殖细胞中表达,在有丝分裂后迅速降解[11]。Ki-67作为核增殖标志基因,能反映癌细胞的增殖状态,是目前判断肿瘤恶性程度、增殖活性、预后不良的可靠指标[12]。研究表明,Ki-67表达与肿瘤的恶性程度、浸润深度关系密切,其高表达表明EC患者肿瘤级别较高[13]。可见,Ki-67表达与EC患者手术治疗预后情况可能有关。p16属于多重肿瘤抑制基因,通过细胞周期调节蛋白,抑制癌细胞过度增殖[14]。p16作为高危型HPV感染的重要检测抗体,宫颈病变中表达异常,可能与EC患者手术治疗预后不良有关[15]。同时,有研究证实,p16在恶性肿瘤组织中表达异常[16]。
本研究结果进一步经Logistic回归分析显示,FIGO分期高、Ki-67表达高可能是EC患者复发转移的风险因子,p16表达高可能是EC患者手术治疗预后的保护因子。分析原因可能为:Ki-67作为有丝分裂磷蛋白单克隆抗体抗原,参与细胞周期的调控,和细胞分裂增殖联系紧密,可能通过促进手术治疗后残余EC癌细胞增殖,诱导EC病灶发生复发或转移,增加手术治疗预后不良的发生风险[17-18]。Ki-67诱导驱动蛋白家族15抗体进入有丝分裂,维持纺锤体的稳定,是维持DNA结构必需的支架蛋白,Ki-67表达异常会影响癌细胞增殖,增加癌细胞侵袭、迁移的可能,从而影响EC患者手术治疗预后情况[19-20]。p16结合细胞周期蛋白依赖性激酶,抑制有丝分裂,使癌细胞停止增生和恶性转化,EC患者癌组织中p16低表达,而缺少p16可能造成癌细胞增殖,加快恶性转化,影响临床预后[21]。p16表达p16蛋白,抑制细胞周期蛋白依赖性激酶活性,负调控细胞周期进展,抑制癌基因磷酸化,当p16基因发生缺失,对细胞增殖的抑制作用降低,导致EC癌细胞过度增殖,诱发肿瘤,造成EC术后复发、转移,增加不良预后的风险[22-23]。
另外,本研究绘制ROC曲线图,结果显示,Ki-67、p16蛋白表达预测EC患者手术治疗预后不良的AUC分别为0.833、0.827,均有一定预测价值;绘制决策曲线结果显示,在阈值0.2~1.0范围内,联合子宫内膜癌患者组织中Ki-67、p16蛋白表达预测EC患者手术治疗预后不良的净受益率优于单独某一指标,且在高风险阈值0.0~1.0内的净受益率始终大于0,始终有临床意义,净受益率最大值为0.153。
综上所述,子宫内膜癌患者组织中Ki-67、p16蛋白表达与手术治疗预后有关,用于预测预后不良具有一定的价值,且联合预测获得的净受益率更高。

