宫颈癌组织中Survivin、ICAM-3的表达及与放疗敏感性的关系
朱瑞霞 侯永利 李齐羽 齐 林
(ThePracticalJournalofCancer,2023,38:0021~0024)
宫颈癌作为临床常见的恶性肿瘤,发病率在中国女性恶性肿瘤中排第二,严重危害着女性的生命健康[1]。目前的治疗手段主要以放、化疗以及手术为主[2]。 临床常使用手术为主,结合化疗、放疗、免疫等综合治疗手段,其中放疗是通过射线抑制肿瘤细胞的生长,患者的存活时间受放疗敏感性的影响[3-4]。临床常使用手术为主,结合化疗、放疗、免疫等综合治疗手段,其中放疗是通过射线抑制肿瘤细胞的生长,患者的存活时间受放疗敏感性的影响[5-6]。Survivin 基因是近年新发现的凋亡抑制蛋白(inhibitor of apoptosis protein,IAP),能够抑制细胞凋亡、促进细胞增殖,其与肿瘤的发生、发展有密切关系[7]。细胞间黏附因子(ICAM)-3 在肿瘤的增殖、浸润及转移中扮演着重要角色,其表达上调可显著抑制放射后细胞凋亡,增加肿瘤的放射抗拒性[8-9]。因此本研究通过检测Survivin、ICAM-3在宫颈癌中表达水平,探究其与放疗敏感性的关系,为临床制定合理的治疗方案提供参考依据。
1 材料与方法
1.1 研究对象
选取2018年2月至2019年2月本院收治的宫颈癌患者50例,年龄28~71岁,平均(48.39±5.87)岁。纳入标准:①患者符合《宫颈癌及癌前病变规范化诊疗指南(试行)》中关于宫颈癌的诊断标准[10],经病理检查确诊为宫颈癌;②入院前患者未接受手术、放疗以及化疗等;③患者住院后行宫颈癌根治术,并配合放、化疗辅助治疗;④患者的临床资料完整;⑤患者及家属已签署知情同意书。排除标准:①合并患有妇科炎症患者;②合并其他恶性肿瘤;③合并肝肾功能异常者。
1.2 治疗方法
所有患者均给予根治性放射治疗及以铂类为基础的同步化疗方案治疗。放射治疗方案:采用直线加速器外照射全盆腔,总剂量DT 50 Gy/25 次/5 w(DT 25~30 Gy时中线遮挡4 cm);3 w时,高剂量率内照射(铱-192),DT 6 Gy/次,1次/w;5~7 w时A点剂量:内照射2/3,外照射1/3;B点剂量,内照射1/3,外照射2/3。所有患者放疗同时,给予以铂类为基础的化疗方案同步化疗。
1.3 放疗敏感性评价
根据实体肿瘤疗效评定标准,可将患者分为完全缓解(CR):病灶完全消失;部分缓解(PR):病灶最长径比化疗前减少≥30%;稳定(SD):病灶最长径比化疗前减少<30%或者增大<20%;进展(PD):病灶最大径比化疗前增大≥20%。CR+PR为放疗敏感组,SD+PD为放疗抵抗组。
1.4 Survivin、ICAM-3检测
所有患者手术切除病灶并按常规固定制作石蜡标本,切成厚约4 μm薄片,采取SP法来进行免疫组化染色(试剂盒购自美国Santa Cruz公司),所有步骤均参考说明书进行操作。染色判读,若Survivin、ICAM-3胞核或胞质出现棕黄色颗粒即为阳性细胞。结果均由两位病理科医师在双盲条件下独立判断,其中(-)和(+)为阴性,(++)为弱阳性,(+++)为强阳性,弱阳性和强阳性均为阳性。
1.5 统计学分析

2 结果
2.1 疗效
50例宫颈癌患者,经放疗治疗后,CR 10例,PR 18例,SD 16例,PD 6例,其中放疗敏感28例(CR+PR)、放疗抵抗组22例(SD+PD)。
2.2 放疗敏感性与临床病理资料的关系
统计学分析放疗敏感性与临床病理资料的关系,发现2组的FIGO分期差异无统计学意义(P>0.05),放疗抵抗组肿瘤的分化程度更低、肿瘤直径更大,差异有统计学意义(P<0.05),见表1。

表1 宫颈癌放疗敏感性与临床病理资料的关系/例
2.3 放疗敏感性与Survivin、ICAM-3水平的关系
放疗敏感组Survivin、ICAM-3的阳性表达率明显低于放疗抵抗组,差异有统计学意义(P<0.05),见表2。

表2 放疗敏感性与Survivin、ICAM-3水平的关系/例
2.4 多因素分析宫颈癌临床特征以及Survivin、ICAM-3表达与放疗敏感性的关系
多因素分析结果发现,分化程度、肿瘤直径与放疗敏感性无关(P>0.05),Survivin、ICAM-3表达水平与放疗敏感性有关(P<0.05)。见表3。
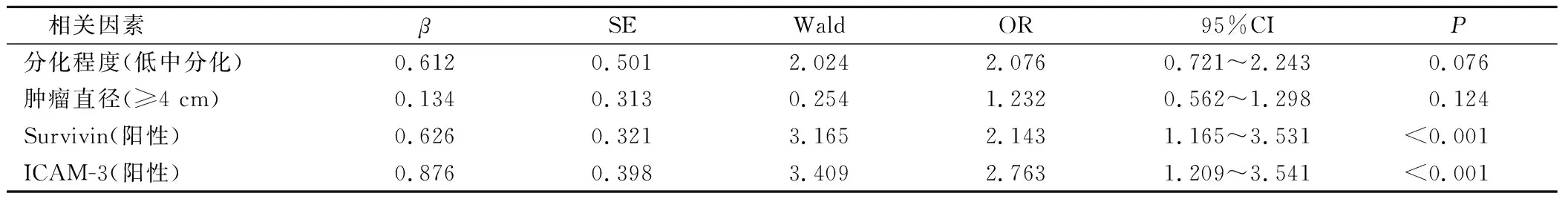
表3 宫颈癌临床特征、Survivin、ICAM-3与放疗敏感性关系
3 讨论
宫颈癌是最常见的妇科恶性疾病,也是死亡率最高的妇科癌症。据全球癌症统计,2012年临床诊断宫颈癌新发病例约527,600例,导致全球约265,700例宫颈癌死亡病例[11]。宫颈癌包括 2 种主要的组织学亚型:鳞状细胞癌(SCC)(占85%~90%),腺癌 (AC)(占10%~25%)[12-13]。近几十年来,手术和放疗一直是宫颈癌治疗的主要方式,但其治疗效率没有显着提高,5年生存率仍然很低[14]。此外,在诊断时,大多数宫颈癌患者有明显的侵袭和转移。因此,不受控制的局部肿瘤进展和远处转移仍是宫颈癌患者死亡的主要原因。放疗是针对恶性肿瘤的辅助治疗之一,子宫内膜癌患者使用放疗后可在短时间起效果,包括单纯放疗、术前放疗和术后放疗[15-16]。放疗容易造成患者厌食、恶心、呕吐、免疫力下降,破坏正常组织等毒副作用[17]。在临床上,放疗敏感性常表现为肿瘤的变小或稳定[18]。在细胞水平上,表现为增殖速度变缓或肿瘤细胞凋亡[19]。因此,研究宫颈癌放疗抵抗的影响因素,对于增强放疗敏感性及改善患者预后有重要意义。
Survivin作为细胞凋亡蛋白家族抑制剂中最重要和最小的成员,在使肿瘤细胞避免细胞凋亡的同时增加其增殖率方面发挥着积极作用[20]。Survivin 在癌症和胚胎组织中高度表达;然而,它在正常终末分化的成体组织中的表达水平较低[21]。据报道,Survivin的表达与多种类型的癌症的预后有关,例如食管癌、乳腺癌、肺癌、胃癌、结直肠癌、神经胶质瘤,以及survivin高表达的患者生存率普遍较低[22-23]。因此,Survivin作为单独或与其他治疗策略组合的癌症治疗的靶点受到广泛关注。ICAM 既可作为粘附受体,又可作为信号受体,并具有部分重叠的功能[24]。β2整联蛋白 LFA-1 与 ICAM-1、ICAM-2 和 ICAM-3 特异性结合[25],优先与 2 个额外的配体相互作用,整合素 αDβ2和 DC-SIGN;此外,它是一种在树突细胞中表达的新型 C 型凝集素,与 ICAM-3 具有高亲和力[26]。ICAM-3-DC-SIGN 相互作用似乎在免疫反应启动过程中起关键作用[27]。有研究发现,在实体瘤中观察到基质内皮上 ICAM-3 表达增加[28]。然而,迄今为止,关于 ICAM 与辐射反应性的关系知之甚少。本研究结果显示,放疗抵抗组肿瘤的分化程度更低,肿瘤直径更大。放疗敏感组Survivin、ICAM-3的阳性概率明显低于放疗抵抗组。多因素分析结果显示,Survivin、ICAM-3表达水平与放疗敏感性有关。
综上所述,本研究通过对宫颈癌Survivin、ICAM-3表达水平与放疗敏感性的关系,发掘出关于宫颈癌放疗敏感性的新预测因子,对提高宫颈癌的预后效果、制定个体化治疗有积极的意义。但是本研究存在局限性,首先它是针对单一中心的研究,其次样本量不足,因此在今后的研究中注意扩大样本量以及多中心调查,以此弥补本次研究的不足。

