COL7A1基因双杂合突变致母子同患胫前型显性营养不良型大疱性表皮松解症的研究
廉佳,王莹,林杨杨,李钦峰
(天津市儿童医院,天津 300074)
大疱性表皮松解症(Epidermolysis bullosa,EB)是一组以摩擦后起疱为临床特点的单基因遗传病,根据透射电镜下水疱的位置分为单纯型、交界型、营养不良型和Kindler综合征。营养不良型大疱性表皮松解症(DEB)由编码Ⅶ型胶原的COL7A1基因发生突变所致,目前共发现基因突变位点841个,通常有种族和家族特异性,仅个别为复发性突变[1]。DEB根据遗传方式分为常染色体显性DEB(DDEB,OMIM 131750)和常染色体隐性 DEB(RDEB,OMIM 226600),两型临床表现相似,均以皮肤黏膜受轻微摩擦后出现水疱、大疱,愈后形成瘢痕为主要特点,相同分型有泛发型、胫前型、痒疹型和新生儿EB四型[2]。胫前型 DEB(Pretibial dystrophic epidermolysis bullosa,DEB-Pt,OMIM 131850) 的临床特点是胫前区为主的瘙痒性水疱和萎缩性瘢痕,是DEB的一种罕见亚型,母子同患胫前型DEB更为罕见,现报道如下。
1 资料与方法
1.1 临床资料 患儿男,7岁,因双下肢摩擦后反复出现水疱、破溃、瘢痕,伴瘙痒7年,就诊于我院。患儿自生后双侧足踝摩擦、搔抓或磕碰后出现水疱,水疱易破;膝部、手指伸侧关节处摩擦后出现水疱,水疱破溃愈合后留有瘢痕;皮疹范围逐渐扩展至小腿、膝部、腰背部等,以足踝及膝部为重,皮疹瘙痒明显,部分指(趾)甲变形。体格检查:发育正常,营养中等,各系统检查未见异常。辅助检查:血尿便常规、肝肾功能、电解质未见异常;心电图、胸片、腹部B超未见明显异常;甲真菌镜检阴性。皮肤科检查:腰背部、膝部、足踝部淡红色增生性瘢痕,瘢痕中间和边缘可见散在粟丘疹;手指伸侧关节处大小不等的紫红色丘疹、萎缩性瘢痕;部分水疱破溃后出现糜烂、结痂;指(趾)甲甲板表面凹凸不平,部分甲板增厚、变形,呈黑褐色,见图1。口腔黏膜未见异常,牙齿无明显异常。患儿父母非近亲结婚,其父及姐姐表型正常,其母有类似病史。先证者母亲临床表现与先证者类似,自幼双下肢反复出现水疱、破溃,愈后形成瘢痕,现双下肢伸侧自膝关节至足背弥漫暗红色斑片,胫前皮肤萎缩如羊皮纸样,足踝部、腰部、右肘部瘢痕部分融合呈斑块,趾甲增厚;皮疹上有较多米粒至指甲盖大糜烂面,部分结血痂,见图2。
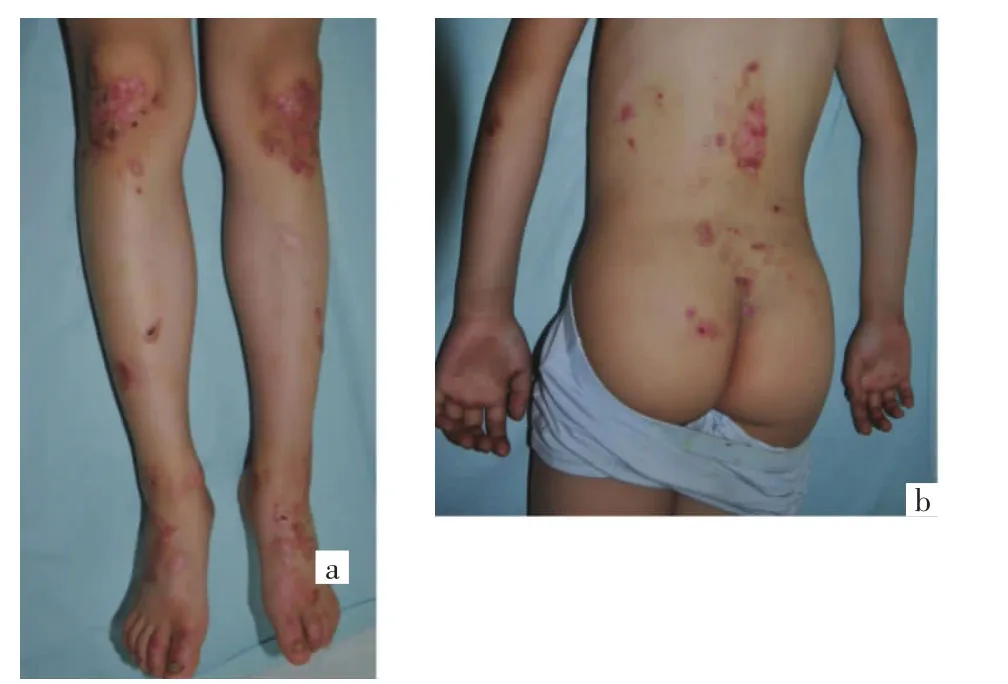
图1 先证者临床图片
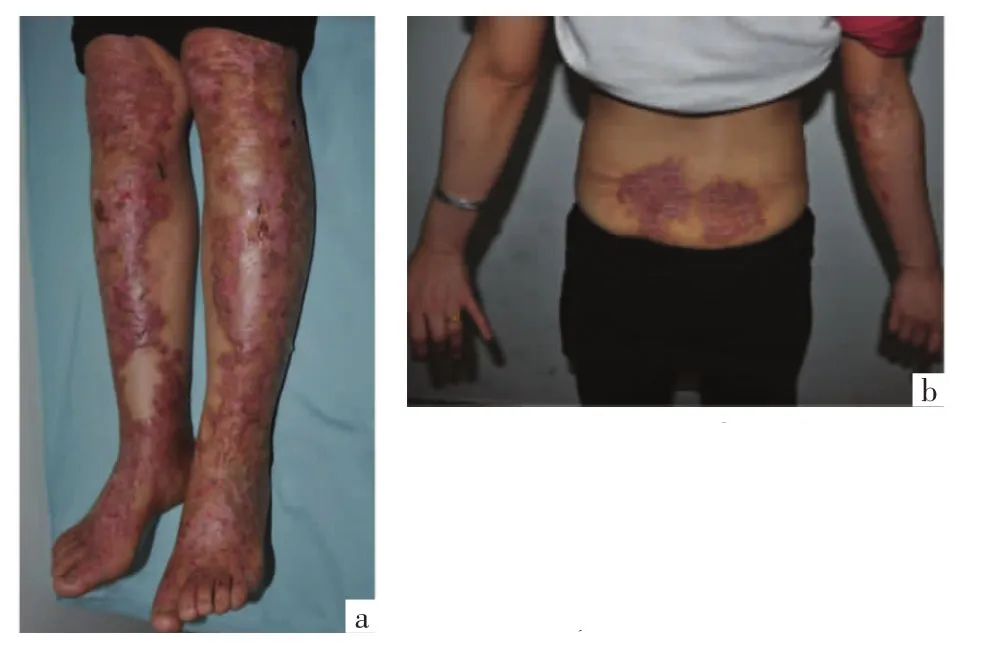
图2 先证者母亲临床图片
1.2 家系调查 先证者家族中无近亲婚配史,5代28名家庭成员中10例发病,男女各5例,无性别差异,家系图见图3;家系中每代均有发病,发病患者双亲必有一方是患者,未患本病者与正常人结婚后其子代不发病,符合常染色体显性遗传特点。
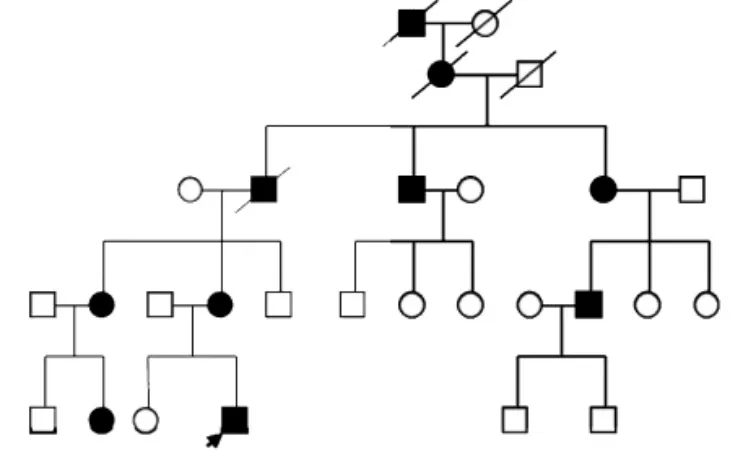
图3 先证者家系图
1.3 基因检测方法 经患者及家属签署知情同意书后,用乙二胺四乙酸(EDTA)抗凝管抽取患儿及其父母和姐姐外周静脉血2 mL,采用QIAampDNA提取试剂盒(GIAGEN公司)提取基因组DNA,并测量其吸光度值及浓度(基因检测由广州金域医学检验中心有限公司完成)。
1.3.1 第二代高通量测序技术进行医学全外显子组检测 提取的DNA用DNA酶片段化后用磁珠法进行纯化,纯化后的产物按照Illumina测序说明书进行文库构建,构建好的文库在Nexseq500测序仪(Illumina Inc,USA)上进行测序。
1.3.2 数据分析 所有数据用Burrow-Wheeler Aligner(BWA)算法比对到参考序列(UCSC hg19),采用仪器默认设置,使用文献报道方法对数据进行注释。经筛选流程筛选,并结合患儿临床资料和生物信息学软件(PolyPhen2、LRT、Mutation Taster等)预测结果,对各个基因的功能、变异情况以及遗传模式进行分析,得到可疑候选突变。
1.3.3 Sanger测序验证 对可以候选突变的位点设计PCR引物进行扩增及进行Sanger测序验证,对患儿父母和姐姐相应位点进行检测。
2 结果
2.1 目标基因捕获和高通量测序结果 测序结果对扩增的PCR产物直接测序进行分析,先证者COL7A1基因携带2个杂合变异,均位于74号外显子上。第6 181-1位点至6 197位点发生重复突变,预计使编码蛋白质的2 061位氨基酸Lys至2 066位氨基酸Glu发生重复,见图4;同时第6 199位点发生甘氨酸(Gly)替换突变,鸟嘌呤(G)变为腺嘌呤(A),使得三螺旋区第2 067位密码子由GCT变成ACT,预计编码蛋白质第2 067位氨基酸由Gly变为精氨酸(Arg),见图5。
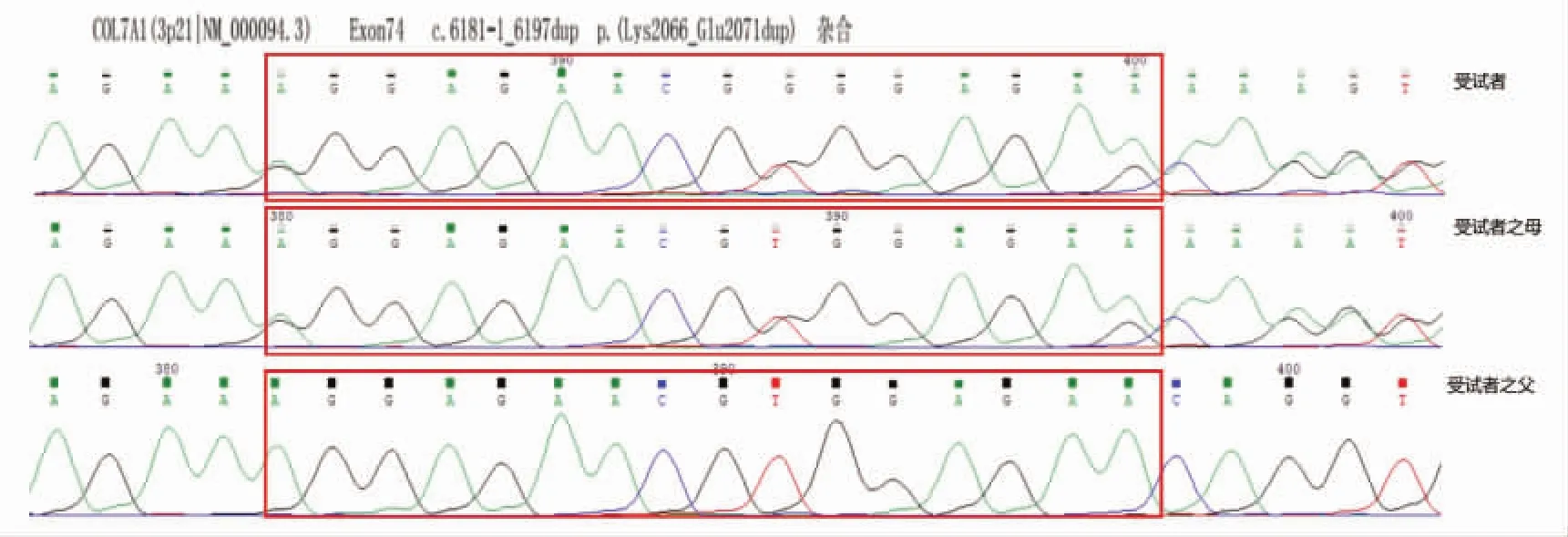
图4 先证者及母COL7A1基因第74号外显子上c.6181-1_6197dup杂合突变
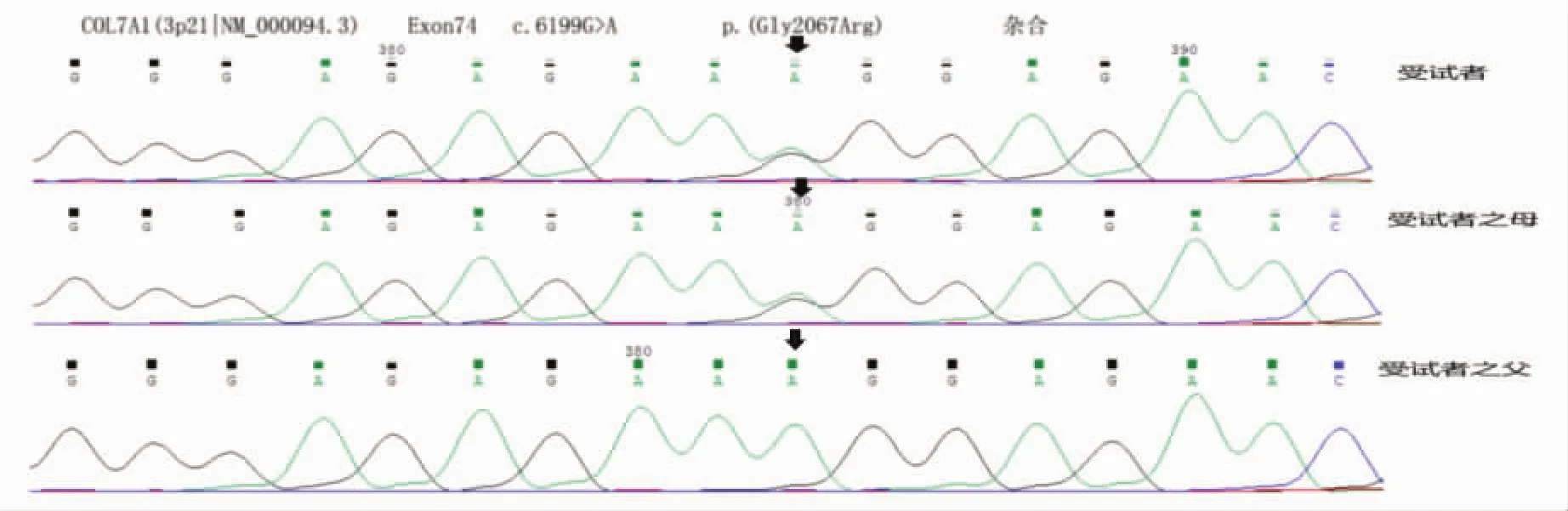
图5 先证者及母COL7A1基因第74号外显子上c.6199G>A杂合突变
2.2 Sanger测序验证结果 先证者携带COL7A1基因第74号外显子上c.6181-1_6197dup和c.6199G>A 2个杂合突变。先证者母亲携带COL7A1基因第74号外显子上这个双杂合变突变,其父亲未检测到相关突变,先证者的突变全部来源于其母,结合家系调查,该家系遗传方式符合常染色体显性遗传。
2.3 结果分析 c.6199G>A为点突变,c.6181-1_6197dup为内含子和外显子交界处的重复突变,这2个杂合突变均位于COL7A1基因74号外显子上。先证者和其母同时存在这2个杂合突变,先证者父亲和姐姐及100名无关正常对照者未检测到此突变。查阅人类基因组突变数据库(Human Genome Mutation Database)、dbSNP147数据库、千人基因组等数据库,仅有文献报道c.6199G>A;未报道c.6181-1_6197dup突变;也未报道c.6181-1_6197dup与c.6199G>A同时出现杂合突变。先证者及其母突变位点相同,结合相似的临床表现,推断c.6181-1_6197dup与c.6199G>A这个双杂合突变可能是引起该患者家系临床表型的特异突变。
2.4 诊断 本例患者根据病史、临床表现、家系图分析,结合基因结果,可以诊断为胫前型显性DEB。
3 讨论
目前DEB基因型-表型相关性尚未完全阐明,COL7A1突变的性质及其位置被认为与DEB表型的严重程度有关[3]。COL7A1基因是锚纤维的主要成分,含118个外显子,是迄今为止所发现的含有最多外显子的基因,其每一个功能区(三螺旋区、铰链区、启动子区、剪接位点、增强子区等)均可发生突变。Ⅶ型胶原中央为特征性Gly-X-Y重复序列构成的三螺旋区,其中包含39个氨基酸组成的较大片段(被称为铰链区)。既往研究表明RDEB的基因突变多为终止密码的提前出现,可由错义突变、无义突变、小片段缺失、剪切位点突变等导致,突变集中于外显子72-74,靠近Ⅶ型胶原的“铰链”区;DDEB多为Gly替代错义突变导致,簇集发生于G1982W至G2079E范围内,紧靠“铰链”区下游[4],RDEB和DDEB的基因突变均集中在此范围,提示“铰链”区可能是维持三螺旋结构稳定的重要区域。
胫前型DEB(DEB-Pt)的突变包括错义突变(73.68%)、缺失突变(10.53%)和剪接突变(15.79%)等[5]。本患儿74号外显子上同时出现2个突变c.6181-1_6197dup与c.6199G>A。这2个杂合突变均位于同一等位基因上,c.6181-1_6197dup位于外显子和内含子交界部位,重复出现了c.6181-1_6197这一段氨基酸片段,紧邻的位点6199鸟嘌呤(G)变为腺嘌呤(A),即2 061位氨基酸Lys至2 066位氨基酸Glu发生重复的同时2 067位氨基酸由Gly变为Arg发生Gly错义突变,这2个连续的突变靠近维持三螺旋结构稳定的铰链区,导致三螺旋结构不稳定,从而干扰Ⅶ胶原结构异常而致病。先证者与其母基因突变位点一致,在家族正常人及正常对照中均未检测到,故推测c.6181-1_6197dup与c.6199G>A这个双杂合突变为本家系的特异突变。
先证者母亲与先证者临床表现类似,下肢皮肤摩擦或磕碰后出现水疱,愈合后留有萎缩性瘢痕,伴明显瘙痒,家系调查中5代均有发病遗传,符合常染色体显性遗传模式,结合COL7A1基因突变结果,诊断胫前型显性DEB。DEB-Pt与痒疹型DEB部分临床表现有重叠,故需鉴别;二者均为DEB的特殊类型,且皮疹以胫前为主,但痒疹型DEB临床表现为紫红色丘疹或结节,极难发现水疱,皮损范围较DEB-Pt更为广泛,且瘙痒更为剧烈。同时本病还需与其他EB亚型及扁平苔藓、结节性痒疹等有相似临床表现的疾病鉴别[4,6]。
DEB-Pt既往报道显性占2/3,隐性占1/3,临床以双腿反复出现水疱、溃疡、瘢痕且伴明显瘙痒为特征,但皮疹范围不局限在胫前区[7],同一家系中临床表型轻重差异也可很大。显性皮损出现比隐性晚[8],婴幼儿期少见,常于儿童期发病,病情呈慢性进行性发展,进入青春期临床症状加重。先证者及其母出生后即出现皮疹,发病年龄早于典型显性胫前型DEB,且腰背部等非胫前区也出现相似皮疹,皮损面积较典型显性胫前型DEB大。推测可能是胫前型DEB以单一杂合突变为主,但本研究中先证者及其母在同一等位基因上连续出现2个不同类型的杂合突变,这一特异性双杂合突变造成其临床表现的特异性。
现先证者9岁,日常注意护理,保护易受摩擦部位,防止水疱发生,对于伴有渗出性伤口使用新型非黏连性硅胶敷料,减轻局部皮肤的摩擦,保持一个适当的伤口愈合环境,阻止渗液浸渍伤口周围皮肤。目前对于DEB的治疗尚无有效方法,也无法治愈。DEB-Pt的治疗方法同其他类型DEB,主要是止痒、减少创伤、预防继发感染等对症治疗[9]。Chen等[10]认为口服盐酸奥洛他定配合局部外用维生素E等传统的治疗方法可有效控制局部瘙痒。近年来新的治疗方法以补充Ⅶ型胶原蛋白,从而恢复真表皮的正常黏附功能为研究方向,同时高浓度的皮内骨髓间充质干细胞注射,异体成纤维细胞、间充质基质细胞移植等其他细胞疗法也是研究热点[11]。笔者研究扩展了COL7A1基因突变数据库,为遗传咨询、产前诊断、进一步的靶向治疗等提供了依据。

