鼠李糖乳杆菌LR-ZB1107-01的培养基优化及益生特性评价
许喜林 赵思博 郑柳青 刘冬梅
(华南理工大学食品科学与工程学院,广东 广州 510640)
鼠李糖乳杆菌(Lactobacillus rhamnosus)是目前研究最深入和应用最广泛的益生菌之一,被广泛应用在乳制品、食品添加剂等领域。高纯度的鼠李糖乳杆菌对过敏体质有良好的缓解作用[1-2],在医药领域也有广泛的应用和研究价值。试验结果表明,鼠李糖乳杆菌在肠内长久定殖和生存,能够有效预防由细胞因子所引起的胃肠道疾病[3],不会对人体产生不良反应和副作用。此外,鼠李糖乳杆菌还具有一些自身的优势,比如,耐胆汁、耐胃酸并且可寄存于机体的肠内,终极产品(如鲜奶)保质期内的活菌数可以维持在一定范围内等[4],其在调节肠道功能[5]、降低胆固醇[6-8]、增强免疫力[9]、预防儿童营养不良[10]、预防和治疗结直肠癌、缓解抑郁焦虑情绪[11]等方面都表现出良好的益生性能。因此,鼠李糖乳杆菌相关产品的种类不断增多,其功效也备受关注。益生菌发挥其益生性能的前提是定殖在人体肠道内,很多研究强调定殖在肠道内的益生菌需达到一定数目才能发挥益生菌的功效[12-13],所以,新开发的益生菌资源投入商业应用的首要条件是提高菌体密度。文中从1月龄婴儿粪便中筛选得到了一株性能良好的鼠李糖乳杆菌LR-ZB1107-01,为将该菌株进行商业化使用,丰富我国本土益生菌资源,需要对该菌株进行安全性评价,并探索该菌株与肠道菌群的相互作用等。文中针对该菌株的增殖培养基进行优化,同时对其体外安全性做了初步探究,以期为开发益生菌制剂及其相关产品提供菌株资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和细胞
鼠李糖乳杆菌LR-ZB1107-01,由笔者所在课题组从婴儿粪便中筛选获得,于2019年4月16日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏编号为CGMCC NO.5172。
大肠杆菌ATCC25922由华南理工大学食品科学与工程实验室提供。
1.1.2 材料与试剂
MRS肉汤培养基、PCA培养基,广东环凯生物有限公司生产;氯化钠,分析纯,上海润捷化学试剂有限公司生产;蔗糖、氢氧化钠、盐酸,分析纯,广州化学试剂厂生产;无水葡萄糖,分析纯,天津市大茂化学试剂厂生产;琼脂粉、细菌学蛋白胨、酵母粉,广州环凯微生物科技有限公司生产;硫酸锰、维生素B1、叶酸,杭州麦克林试剂有限公司生产;硫酸镁、维生素C,天津致远化学试剂有限公司生产;硝酸盐培养基,广州环凯微生物科技有限公司生产;KI,阿拉丁试剂有限公司生产。
BASM培养基的制备:胰蛋白胨5.0 g/L、酵母膏5.0g/L、牛肉膏5.0g/L、氯化钠2.5g/L、葡萄糖0.5 g/L、吐温-80 1 g/L、碳酸钙1 g/L、硫酸亚铁0.04 g/L、硫酸镁0.2 g/L、硫酸锰0.2 g/L、柠檬酸铵5.0 g/L、硫胺素0.01 g/L、磷酸氢二钾2.0 g/L、5-磷酸吡哆醇0.05 g/L、溴甲酚紫0.06 g/L、琼脂20 g/L,加蒸馏水1 000 mL,调pH值为5.3后,于121℃下灭菌10 min。稍冷却后分装,分别加入1%的精氨酸、鸟氨酸。
MRS肉汤培养基的制备:蛋白胨10.0 g/L、牛肉膏10.0 g/L、酵母膏4.0 g/L、酪蛋白酶消化物10.0 g/L、柠檬酸三铵2.0 g/L、乙酸钠5.0 g/L、硫酸镁(MgSO4·7H2O)0.2 g/L、硫酸锰(MnSO4·4H2O)0.05g/L、磷酸氢二钾2.0g/L、葡萄糖20.0g/L、吐温-80 1.0 g/L,调节pH终值为5.7±0.2后,于121℃下灭菌20min。
1.2 主要仪器设备
MP502B型电子天平,上海精科仪器公司生产;JA2003型电子分析天平,上海精科仪器公司生产;HY300型超净工作台,苏州华科净化设备有限公司生产;SW-CJ-1FD型超净工作台,苏州华科净化设备有限公司生产;GI36TW型全自动高压灭菌锅,致微(厦门)仪器有限公司生产;LHS-80型恒温恒湿培养箱,上海百典仪器设备有限公司生产;Dragon Med型手动单道可调式移液器,上海大龙医疗设备有限公司生产;GR-207E(G)型冰箱,东芝有限公司生产;ES-1000W型功率调节电炉,南海明辉五金电器厂生产;XW-80A型微型漩涡混合仪,上海沪西分析仪器厂生产;PH400型pH计,安莱立思ALALIS仪器科技(上海)有限公司生产。
1.3 实验方法
1.3.1 菌株活化方法
将-20℃下保存的鼠李糖乳杆菌LR-ZB1107-01甘油冻存管取出化冻后,按3%的比例(体积分数,下同)接种于MRS液体培养基,于37℃下恒温静置培养24 h,进行二次活化,活化后的种子液用于后续实验。
1.3.2 活菌计数方法
采用平板稀释法计算鼠李糖乳杆菌LR-ZB1107-01的活菌数。
1.3.3 菌株生长规律分析方法
将活化后的鼠李糖乳杆菌LR-ZB1107-01以3%的接种量接入100 mL MRS基础液态培养基中,于37℃下恒温培养,每隔2 h分别测定其活菌数及pH值。以时间为横坐标,绘制菌株的生长曲线和pH值变化曲线。
1.3.4 营养物质单因素优化方法
碳源的选择:以MRS培养基为基础骨架,分别添加质量分数为0%、2%、3%、4%、5%、6%、7%、8%的葡萄糖,灭菌后分别接种3%(体积分数)的活化后的鼠李糖乳杆菌LR-ZB1107-01,于37℃下恒温培养22h,测定其活菌数。
氮源的选择:分别向MRS基础培养基中添加质量分数为0.0%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%的酵母粉或添加相同倍数的蛋白胨,灭菌后分别接种3%的活化后的鼠李糖乳杆菌LR-ZB1107-01,于37℃下恒温培养22h,测定其活菌数。
生长因子的优化:分别向基础培养基中添加以下物质:①质量分数为0、0.005%、0.010%、0.015%、0.020%、0.025%、0.030%的硫酸锰;②质量分数为0、0.02%、0.04%、0.06%、0.08%、0.10%、0.12%的硫酸镁;③质量分数为0、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%的D-异抗坏血酸;④与D-异抗坏血酸相同质量分数的维生素B1;⑤与D-异抗坏血酸相同质量分数的维生素C;⑥与D-异抗坏血酸相同质量分数的叶酸。接种3%(体积分数)的活化后的鼠李糖乳杆菌LR-ZB1107-01,于37℃下恒温培养22h,测定其活菌数。
1.3.5 Plackett-Burman实验设计
在单因素实验结果的基础上,采用Plackett-Burman实验设计方法,对1.3.4节所述影响因素进行优化。每个因素取低(-1)和高(+1)两个水平,共12个实验组。每个实验组重复3次,取平均值。
1.3.6 Box-Behnken实验设计
在Plackett-Burman实验结果的基础上,利用响应面分析法进一步对Lactobacillus rhamnosusZB1107-01培养基培养条件进行优化,利用Design-Expert 8.0.5b软件,采用Box-Behnken建立三因素三水平数学模型。
1.3.7 硝基还原酶活性检测
将活化后的培养液按照3%的接种量接入到灭菌后的硝酸盐培养基中,于37℃下培养48h后,先滴加5%的KI溶液10滴,再滴加5%的淀粉溶液10滴,充分振荡混匀培养基后,观察培养基的颜色变化,同时设置空白对照组。
1.3.8 氨基脱羧酶活性检测
将活化后的LR-ZB1107-01菌株接种于MRS液体培养基中培养过夜,然后按照3%的接种量接入含1%(质量分数)前体氨基酸(鸟氨酸、赖氨酸)的MRS培养基,于37℃下培养72h。取LR-ZB1107-01发酵液100μL涂布于BASM培养基,于37℃下培养24 h,观察培养基的颜色变化并记录,以大肠杆菌ATCC25922为阳性对照菌株,同时设置空白对照。
1.4 数据处理
利用Origin 8.0绘制菌株的生长曲线,利用Design-Expert 11软件进行Plackett-Burman和Box-Behnken实验设计与数据分析。
2 结果与讨论
2.1 LR-ZB1107-01的生长规律
图1所示为鼠李糖乳杆菌LR-ZB1107-01的生长曲线及pH值变化曲线。结果表明:鼠李糖乳杆菌LR-ZB1107-01在接种后0~6 h适应培养基中的新环境,经历迟滞期;接种后6~18h为对数增长期,菌数上升最快,与此同时,pH值也在不断下降,细菌代谢产生的有机酸等物质积累并开始抑制其繁殖;接种后18~22 h菌体数量保持稳定,接种22 h后,随着营养物质逐步消耗,活菌数开始下降。从图1中可以看出,菌体在生长过程中的最大活菌数F达7.97×107CFU/mL。
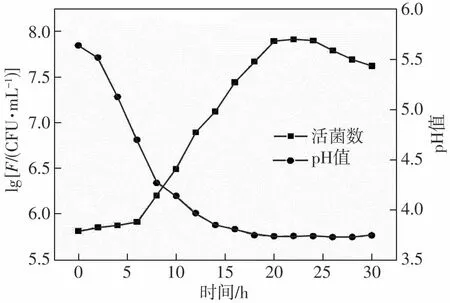
图1 LR-ZB1107-01活菌数及pH值变化曲线Fig.1 Variation curves of viable count and pH value of LRZB1107-01
2.2 LR-ZB1107-01营养物质的单因素优化
2.2.1 碳源(葡萄糖)添加量对LR-ZB1107-01活菌数的影响
葡萄糖添加量对LR-ZB1107-01生长的影响如图2所示。
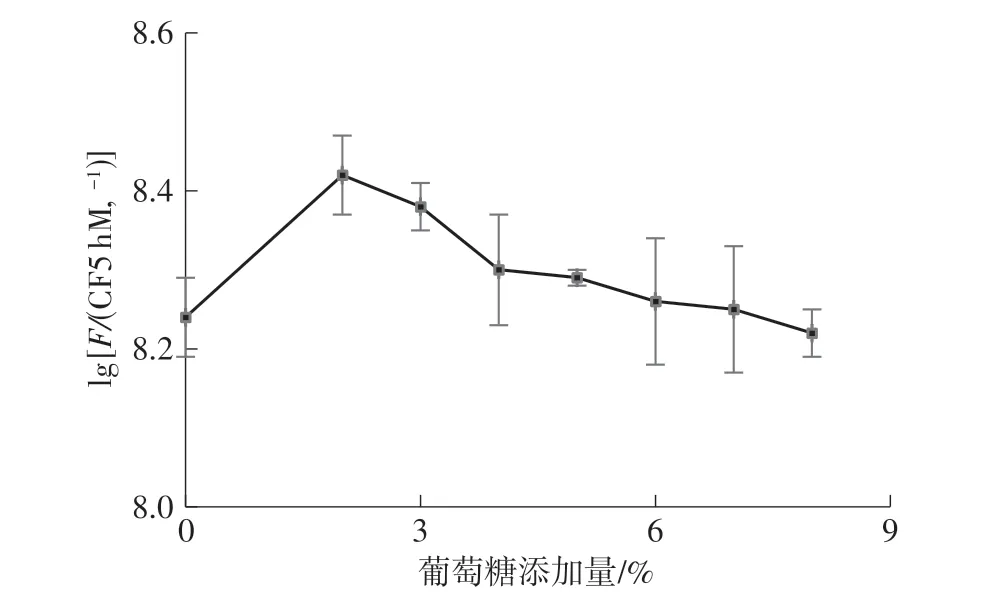
图2 葡萄糖添加量对LR-ZB1107-01活菌数的影响Fig.2 Effect of glucose dosage on viable count of LR-ZB1107-01
当葡萄糖添加量低于2%时,LR-ZB1107-01的活菌数随着葡萄糖添加量的增大而增加;当葡萄糖添加量继续增大时,LR-ZB1107-01活菌数下降。根据方差分析结果,葡萄糖的添加量对LR-ZB1107-01活菌数的影响显著(P<0.05)。很显然,LR-ZB1107-01可以利用葡萄糖作为碳源进行生长代谢,但是当葡萄糖添加量达到一定值时,菌体利用率已达极限,继续添加对其生长没有帮助。因此,确定葡萄糖的最佳添加量为2%,此时LR-ZB1107-01活菌数为(2.67±0.29)×108CFU/mL。
2.2.2 氮源添加量对LR-ZB1107-01活菌数的影响
氮源(酵母粉和蛋白胨)对LR-ZB1107-01活菌数的影响如图3所示。

图3 氮源添加量对LR-ZB1107-01活菌数的影响Fig.3 Effect of nitrogen source dosage on viable count of LRZB1107-01
从图3(a)可以看出:当酵母粉添加量为3.5%时,获得的LR-ZB1107-01活菌数最多,此时酵母粉作为氮源适宜该菌株的生长,活菌数达(1.03±0.02)×108CFU/mL。当酵母粉添加量大于3.5%时,活菌数开始下降,说明过多的酵母粉会产生一定的底物抑制作用,从而抑制菌株的生长。从图3(b)可以看出:当蛋白胨添加量为3.5%时,获得的LRZB1107-01活菌数最多,此时菌株的生长状况最佳,活菌数达(4.07±0.69)×108CFU/mL;当蛋白胨添加量过大时,氮源利用效率降低。
2.2.3 生长因子添加量对LR-ZB1107-01活菌数的影响
硫酸锰、硫酸镁、D-异抗坏血酸、维生素B1、维生素C、叶酸等生长因子的添加量对活菌数的影响如图4所示。
结果表明:在基础培养基中添加0.020%的硫酸锰时,LR-ZB1107-01的活菌数最多,达(5.07±0.37)×108CFU/mL(如图4(a)所示);添加0.10%的硫酸镁时,活菌数达(3.87±0.19)×108CFU/mL(如图4(b)所示);添加0.03%的D-异抗坏血酸时,活菌数最多,达(4.10±0.14)×108CFU/mL(如图4(c)所示);添加0.06%的维生素B1时,活菌数达(4.43±0.65)×108CFU/mL(如图4(d)所示);添加0.03%的维生素C时,活菌数达(3.80±0.29)×108CFU/mL(如图4(e)所示);添加0.04%的叶酸时,活菌数达(2.04±0.16)×108CFU/mL(如图4(f)所示)。
2.3 Plackett-Burman实验结果及分析
使用Design Expert 11软件进行培养基优化实验设计。选择葡萄糖、酵母粉、蛋白胨、硫酸锰、硫酸镁、D-异抗坏血酸、维生素B1、维生素C、叶酸这9种单因素进行分析,实验结果表明,当培养基中分别含有(以MRS培养基为基础培养基)2%葡萄糖、3.5%酵母粉、3.5%蛋白胨、0.020%硫酸锰、0.10%硫酸镁、0.03%D-异抗坏血酸、0.06%维生素B1、0.03%维生素C、0.04%叶酸时,获得的菌悬液活菌数最多,因此选择这几个添加量作为基准,进行Plackett-Burman实验和Box-Behnken优化实验。
利用Design Expert 11软件对表1中的数据进行分析,结果见表2。
由表2可知,在促进LR-ZB1107-01生长方面,D-异抗坏血酸、硫酸镁和蛋白胨的贡献度最高,分别为40.963%、21.449%和13.138%。说明在这9种促进因子中,加入D-异抗坏血酸、硫酸镁和蛋白胨,对于LR-ZB1107-01的生长促进作用较其他更为明显,相应的贡献值远高于其他因子。因此,选择D-异抗坏血酸、硫酸镁和蛋白胨作为研究对象进行下一步的Box-Behnken优化实验。
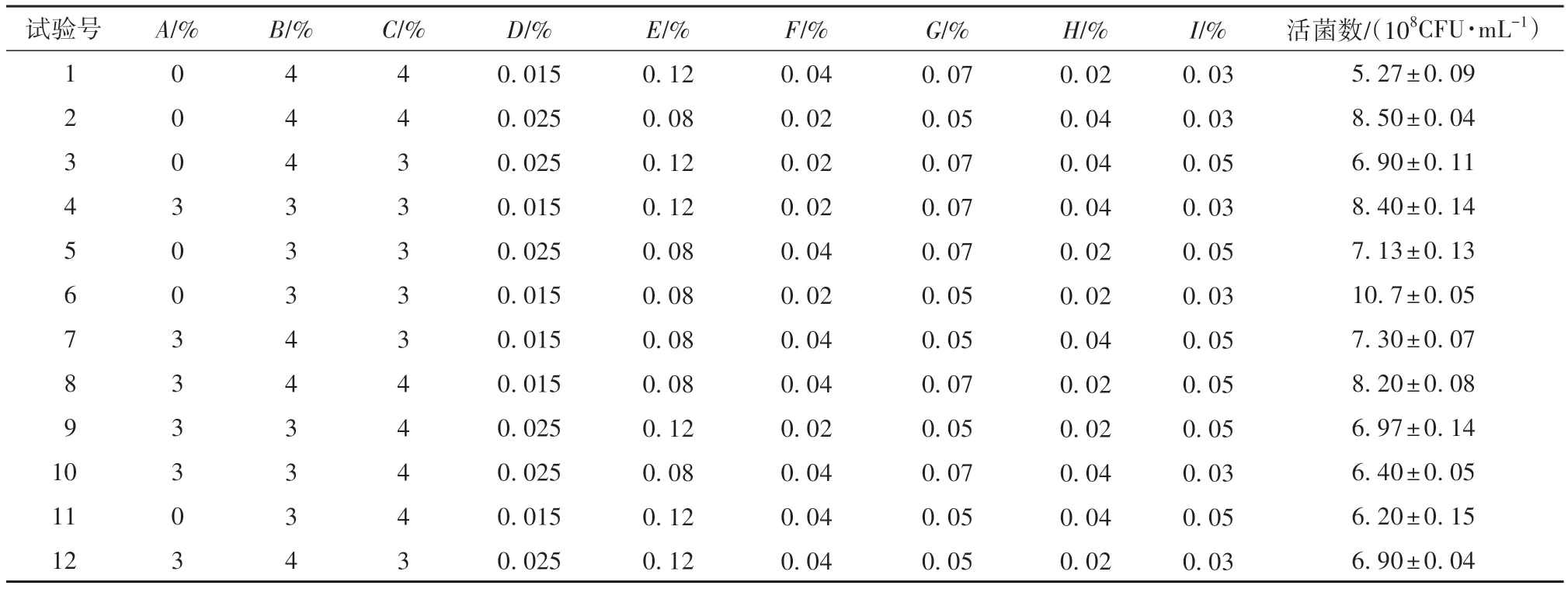
表1 Plackett-Burman实验结果1)Table 1 Results of Plackett-Burman experiment
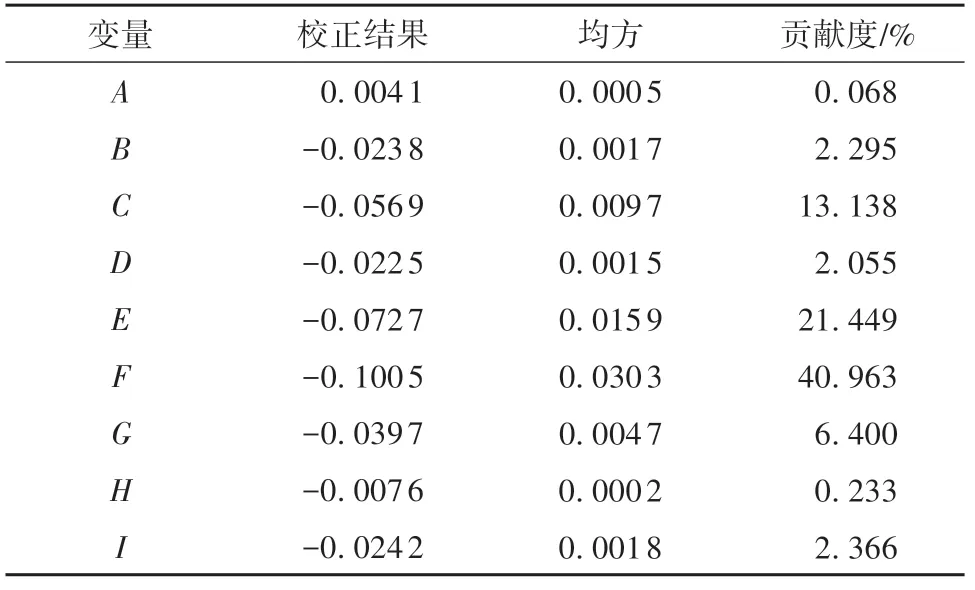
表2 Plackett-Burman实验结果分析Table 2 Analysis of Plackett-Burman experiment results
2.4 Box-Behnken实验结果及分析
表3列出了Box-Behnken实验结果。由表4分析可知,拟合模型的P=0.0065<0.05,拟合项显著,失拟项F值为5.74,P=0.0622>0.05,失拟项不显著,说明模型与实际情况拟合较好。根据以上分析可知,活菌数Y对自变量D-异抗坏血酸添加量(A)、硫酸镁添加量(B)、蛋白胨添加量(C)的多元回归方程为

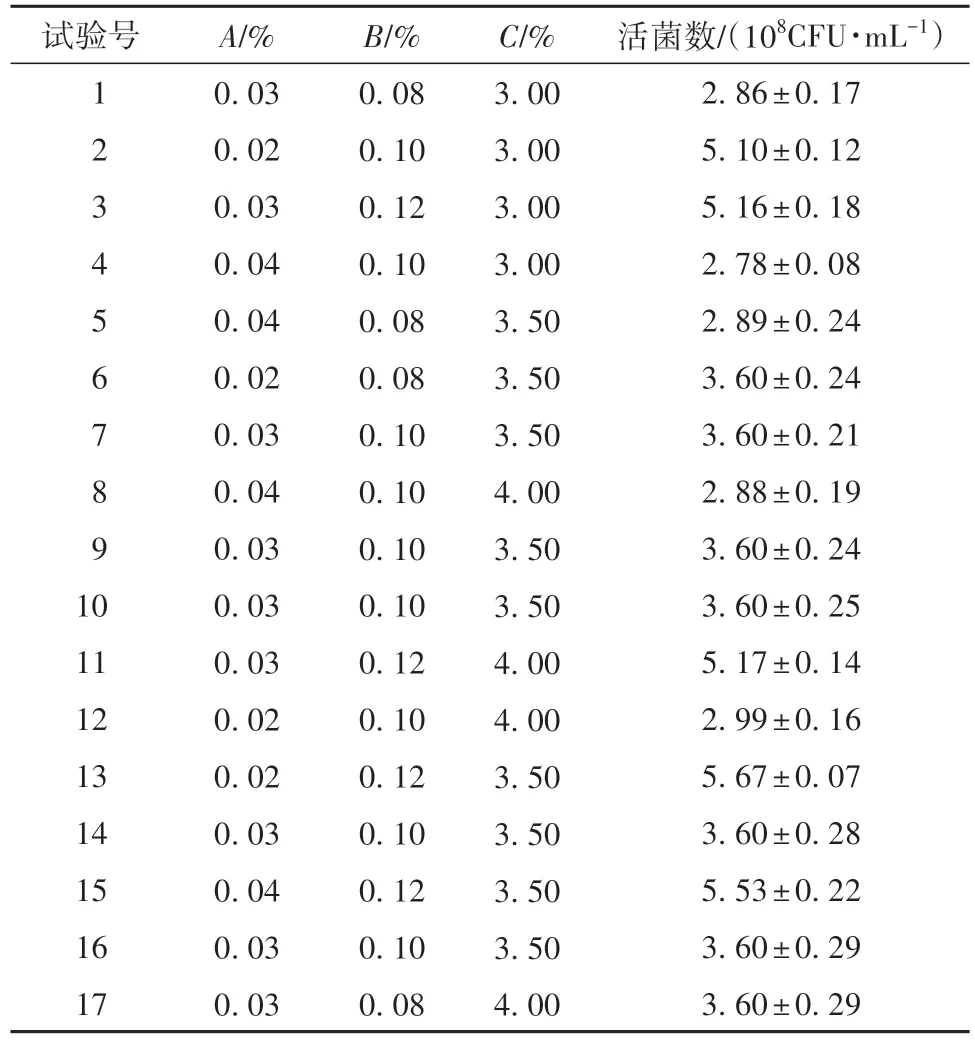
表3 Box-Behnken实验结果1)Table 3 Results of Box-Behnken design
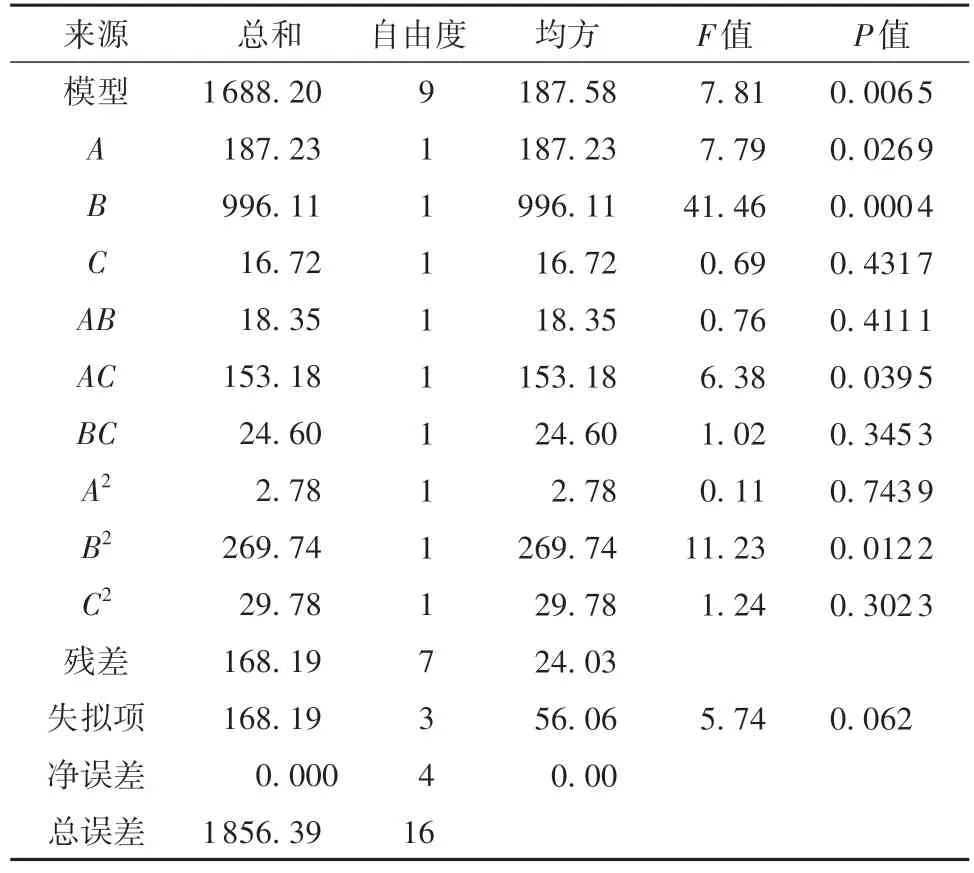
表4 Box-Behnken实验结果分析Table 4 Analysis of Box-Behnken design results
该方程表示了LR-ZB1107-01发酵液中活菌数和3个影响因子之间的显著线性关系。根据回归方程,一次项系数比较大,交互项系数中AC的交互系数较大,说明D-异抗坏血酸和蛋白胨之间的交互效应最大,而BC的交互系数较小,说明硫酸镁和蛋白胨之间的交互效应较小,这与图5所示的3种因素两两交互影响结果一致。
为了检验该方程的有效性,对建立的LRZB1107-01发酵液中活菌数模型进行方差分析,并对3个因子的偏回归系数进行检测。一次项中B的回归系数高度显著,P值为0.0004,说明硫酸镁添加量对LR-ZB1107-01的生长有着最显著的促进作用。拟合度r2=0.9094,说明该方程对LR-ZB1107-01的实际生长情况拟合较好,具有较好的可信度。
对二阶方程求一阶偏导,当响应值Y(活菌数)达最大时,各因子水平如下:D-异抗坏血酸添加量(A),0.02%;硫酸镁添加量(B),0.12%;蛋白胨添加量(C),3.0%。此时理论预测LR-ZB1107-01的活菌数为8.84×108CFU/mL,对该配方所获得的培养基进行验证实验,实际活菌数为8.56×108CFU/mL,比在基础MRS培养基中提高了约10.7倍。Dong等[14]通过响应面法优化了一株唾液乳杆菌的生长培养基,使最大活菌数比在基础MRS培养基中提高了3倍。谢为天等[15]也以MRS培养基为基础,通过优化碳源、氮源以及其他组分,使得一株鼠李糖乳杆菌LT22的最大活菌数提高了6.7倍,达8.17×1012CFU/mL。因此,LR-ZB1107-01仍有优化空间,可通过后续的发酵罐培养条件(如初始pH值、温度、通气量等)优化来进一步扩大培养。
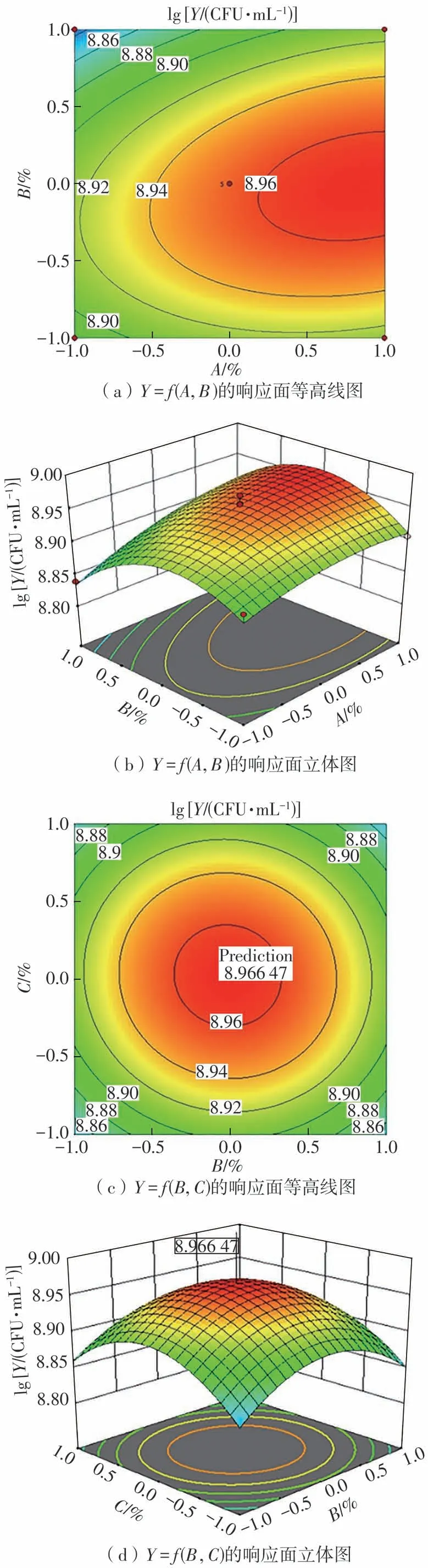
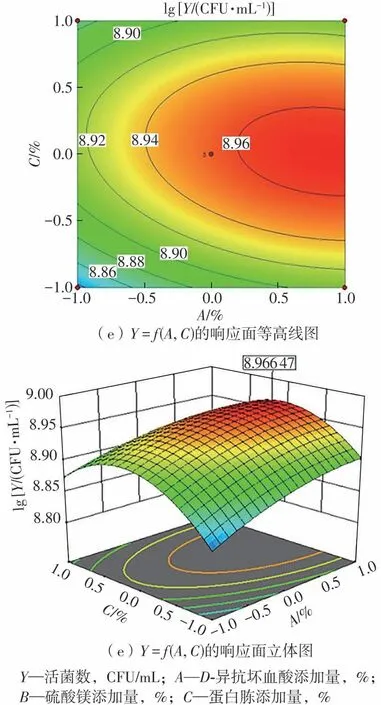
图5 Box-Behnken优化实验拟合响应曲面的交互作用影响图Fig.5 Interaction effect diagrams of Box-Behnken optimization experiment fitting response surface

图6 硝基还原酶实验结果Fig.6 Result of nitroreductase experiment
2.5 安全性及益生特性评价
2.5.1 硝基还原酶实验结果
硝基还原酶可将硝酸盐转化为亚硝酸盐,加入碘化钾溶液后,亚硝酸盐可将碘化钾中的碘元素置换得到碘单质,滴加淀粉后会发生颜色反应[16]。如图6所示,质控菌株(大肠杆菌)的硝基还原酶实验结果为阳性,LR-ZB1107-01的硝基还原酶实验结果为阴性,说明LR-ZB1107-01菌株内并无具活性的硝基还原酶,不会将硝酸盐还原成亚硝酸盐,可以在实际生产中应用。
2.5.2 氨基酸脱羧酶实验结果
少量的生物胺在机体内发挥着重要的生理功能,但生物胺过量也会导致呼吸道等疾病[17]。具有氨基酸脱羧酶活性的菌株可分解氨基酸并生成CO2和生物胺(赖氨酸→赖胺,鸟氨酸→鸟胺),使培养基呈碱性,从而使添加了指示剂溴甲酚紫的培养基呈紫色,因此,若培养基呈紫色则氨基酸脱羧酶实验结果为阳性,若培养基呈黄色则氨基酸脱羧酶实验结果为阴性。LR-ZB1107-01的氨基酸脱羧酶实验结果如图7所示,可以发现其并无氨基酸脱羧酶活性。

图7 氨基酸脱羧酶检测结果Fig.7 Result of aminodecarboxylase test
3 结论
文中通过单因素实验、Plackett-Burman实验发现,D-异抗坏血酸、硫酸镁和蛋白胨对鼠李糖乳杆菌LR-ZB1107-01的生长影响显著(P<0.05),影响大小依次为D-异抗坏血酸>硫酸镁>蛋白胨。通过Box-Behnken实验并结合响应面分析,确定鼠李糖乳杆菌LR-ZB1107-01的优化培养基配方如下:在MRS基础培养基上添加0.02%D-异抗坏血酸、0.12%硫酸镁、3%蛋白胨。在此优化条件下,实际最大活菌数达8.56×108CFU/mL,比在基础MRS培养基中提高了约10.7倍。初步安全性评价结果显示,LR-ZB1107-01菌株的硝基还原酶及氨基酸脱羧酶实验结果均为阴性,表明菌株不会将硝酸盐还原成致癌性的亚硝酸盐,也不会产生大量对人体有害的生物胺,具有一定的安全性,可用于后续的菌粉制备和功能性食品生产。

