地下水中多种塑化剂的SPME-GC-MS法测定
许锐杰 陈克复 招蔚弘 郑小萍
(1.华南理工大学轻工科学与工程学院,广东 广州 510640;2.广东贝源检测技术股份有限公司,广东 广州 510663)
塑化剂是工业生产中广泛使用的高分子材料助剂,又称增塑剂。由于其具有增加塑料制品柔韧性等功能,因此在很多材料中被普遍应用。其中邻苯二甲酸酯类(PAEs)塑化剂因其适用性广、化学性质稳定等优点被广泛使用,约占塑化剂使用总量的80%左右。另一类占比较高的塑化剂为己二酸类塑化剂。这两类塑化剂均具有一定毒性,1982年,美国国家癌症研究所对邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二(乙基己基)酯(DEHP)的致癌性进行了生物鉴定,认为DNOP、DEHP可引发啮齿类动物的肝脏癌症[1]。国际癌症研究所(IARC)已经将DEHP列为潜在促癌剂,美国环保署也将DEHP列为2B类致癌物。2011年2月,欧盟将DEHP等3种PAEs作为首批通过的REACH(化学品注册、评估、许可和限制)需授权物质正式纳入REACH法规授权名单,其判定依据是上述物质具有1B类生殖毒性[2]。动物实验显示,己二酸酯类增塑剂中的己二酸二(2-乙基己基)酯(DEHA)能令动物诱发肝癌,若进入人体可能会造成内分泌紊乱和内分泌系统的不正常调节,因此DEHA已被列为生物内分泌干扰素,可干扰人体激素的分泌,在体内长期积累会导致畸形、癌变和致突变,引起人类多种疾病[3]。
针对塑化剂的毒性影响,各国也制定了相应的管制标准,我国的GB/T 14848—2017《地下水质量标准》[4]对DEHP的限值进行了规定;美国国家环境保护局(USEPA)[5]则对6种PAEs及DEHA规定了管控限值。另外,我国及欧盟的食品接触材料标准中均对PAEs及己二酸酯类塑化剂规定了含量及迁移量要求[6-7]。可以看出,这两类塑化剂对环境和人类的影响正引起越来越多的关注和重视。但我国生态环境部目前执行的测试标准HJ/T 72—2001《水质邻苯二甲酸二甲(二丁、二辛)酯的测定液相色谱法》[8]中并未将DEHP包括在内;广州市地方标准DB4401/T 94—2020《水质半挥发性有机物的测定 液液萃取-气相色谱/质谱法》[9]中规定了6种PAEs(包括DEHP)的测试方法,但该方法是针对多种半挥发性有机物的扫描方法,对于特定物质的检出限及测试条件的专一性问题,在扫描方法中无法得到很好解决。而关于己二酸酯类塑化剂,生态环境部目前仍在编制相关标准[10]。因此,对地下水中的这两类塑化剂的测试进行研究是很有必要的。目前国内外关于地下水中这两类塑化剂的测试已有不少报道[11-16],对于PAEs有不少检出情况,但这些文献中报道的前处理方法大多采取传统的液液萃取或固相萃取,费时费力且需消耗大量溶剂,因此越来越多的研究专注于采用固相微萃取技术(SPME)来进行塑化剂的测试[17-24],但将这两类塑化剂结合在一起进行测试的文献则较为鲜见[23],且在这些文献中,基本采用的是顶空固相微萃取方法,对塑化剂这类沸点相对较高的物质来说,采用该方法并不太合适,因为很难保证塑化剂的萃取效率和较低检出限。采用浸入式固相微萃取法既可以保留SPME操作简便、节省溶剂的优点,又能有效萃取塑化剂类物质,从而达到提高灵敏度、降低检出限的效果。有鉴于此,文中采用浸入式固相微萃取对地下水中的11种塑化剂进行了测试,并对测试效果进行了探讨,以期降低方法检出限,提高灵敏度,达到更好的检测效果。
1 实验
1.1 主要仪器及试剂
Agilent 8890-5977B型气相色谱-质谱联用仪,美国安捷伦公司产品;固相微萃取手柄,美国安捷伦公司产品;5190-4048型超高惰性直型不分流衬管,美国安捷伦公司产品;聚二甲基硅氧烷(PDMS)萃取纤维头膜厚100μm,美国安捷伦公司产品;二乙烯基苯(DVB)/PDMS萃取纤维头,膜厚65μm,美国安捷伦公司产品;宽范围碳纤维(Carbon WR)/PDMS萃取纤维头,膜厚95μm,美国安捷伦公司产品;DVB/Carbon WR/PDMS萃取纤维头,膜厚80μm,美国安捷伦公司产品;85-2A型数显恒温磁力搅拌器,常州市金坛直联仪器研究所产品;磁力搅拌转子(8mm×3mm),英国COWIE公司产品;20mL螺口顶空瓶,美国安捷伦公司产品;Milli Q Reference超纯水系统,美国默克公司产品。
甲醇,LC-MS级,美国Supelco公司生产;氯化钠,AR级,广州化学试剂厂生产;无水硫酸钠,AR级,广州化学试剂厂生产;氯化钾,GR级,天津市科密欧化学试剂有限公司生产;高锰酸钾溶液,0.1mol/L,上海计量测试技术研究院生产;甲醇中的邻苯二甲酸酯混合标准溶液(包含邻苯二甲酸二甲酯、邻苯二甲酸二乙酯、邻苯二甲酸二烯丙酯、邻苯二甲酸二丁酯、邻苯二甲酸二丁基苄基酯、邻苯二甲酸二(2-乙基已基)酯、邻苯二甲酸二正辛酯),1000mg/L,北京北方伟业计量研究院生产;甲醇中的3种己二酸酯混合标准溶液(包含己二酸二乙酯、己二酸二丁酯、己二酸二异丁酯),1 000 mg/L,北京北方伟业计量研究院生产;甲醇中的己二酸二(2-乙基己基)酯标准溶液,100mg/L,德国DR.E公司生产;甲醇中的邻苯二甲酸二己酯(内标,100mg/L),美国AccuStandard公司生产。
1.2 样品采集
采集地下水样品,置于洁净的磨口棕色玻璃瓶中保存,加入HCl或NaOH调pH值至7,低温(0~4℃)避光保存,7d内完成分析[25]。
1.3 样品制备
取10 mL地下水样品于20 mL螺口顶空瓶中,加入内标溶液,放入磁力搅拌转子,用PTFE/硅橡胶瓶盖旋紧,将样品放置于数显恒温磁力搅拌器上。
1.4 固相微萃取
将萃取纤维头装入固相微萃取装置的萃取针中,然后将萃取针装入萃取手柄内,固定好萃取针的位置,插入制备好的样品中,伸出萃取纤维头并确保纤维恰好浸没并处于中心位置,设置好数显恒温磁力搅拌器的各项参数,进行浸入式固相微萃取。
固相微萃取条件如下:磁力搅拌转速,0、100、200、600和1 000 r/min;萃取温度,40、50、60、70、80和90℃;萃取时间,20、30、40、50和60min。
1.5 热解析
萃取完毕后,握住萃取手柄,将萃取针拔出并将萃取纤维收进针套内以免被污染,然后将萃取针扎入气相色谱进样口,推动萃取手柄,使萃取纤维头到达固定位置开始热解析。解析温度为250、255、260、265和270℃,解析时间为1.0、1.5、2.0、2.5和3.0 min,待测组分经解析后进入气相色谱-质谱仪中进行分析。
1.6 气相色谱分析
进样口温度:270℃,不分流(此处进样口温度即为1.5节所述解析温度)。
柱流量:1mL/min(恒流)。
色谱柱:DB-5MSUI(30m×0.25mm×0.25μm,美国安捷伦公司产品)。
柱温:初始温度40℃下保持4min;以30℃/min的速率升温至160℃,保持2min;再以10℃/min的速率升温至300℃,保持2min。
1.7 质谱分析
离子源类型:电子轰击源(EI);离子源温度:230℃;接口温度:280℃;四级杆温度:150℃;溶剂延迟时间:7min;扫描模式:选择性离子采集(SIM)模式,各待测物的采集离子信息见2.1节。
2 结果与分析
2.1 目标化合物的质谱特征离子选择
依照1.3至1.7节所述的分析条件,将11种塑化剂和邻苯二甲酸二己酯(内标)混合标准溶液加入水中,经固相微萃取后上机检测,全扫描模式(SCAN),质荷比(m/z)范围30~300,根据各化合物标准质谱库进行定性,可获得所有目标化合物的离子信息,总离子流色谱图见图1,离子信息见表1。可以看出,谱图中出现较多杂峰,说明萃取纤维除了对待测物有良好的萃取效果外,对水中的其他物质也有一定的吸附能力。为了排除杂质的干扰,提高灵敏度,采用SIM模式可以较好地解决这一问题。依照表1的离子信息,以离子响应强度高作为选取原则确定各物质的定性、定量离子。设定SIM模式的合适分段窗口,确保所有离子驻留时间在30~50 ms之间,循环频率大于3 Hz,相应的总离子流色谱图见图2。
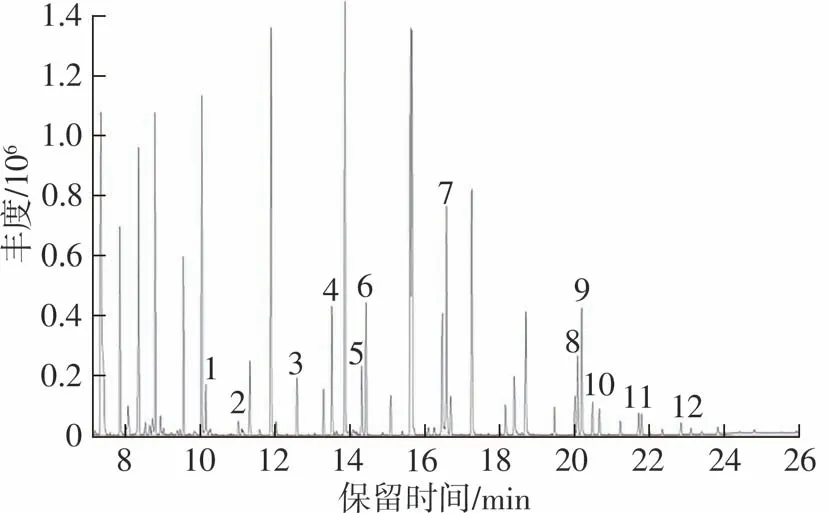
图1 塑化剂的总离子流色谱图(SCAN模式)Fig.1 Total ion flow chromatogram of plasticizers(SCAN mode)
2.2 前处理条件的优化
依照1.3至1.7节所述步骤对样品进行萃取与分析,对萃取纤维的选择进行探讨,对磁力搅拌转速、萃取温度、萃取时间、热解析温度、解析时间等条件进行优化,并进一步考察盐浓度及盐物质种类对萃取效果的影响。

表1 各物质的特征离子信息Table 1 Characteristic ion information of each substance
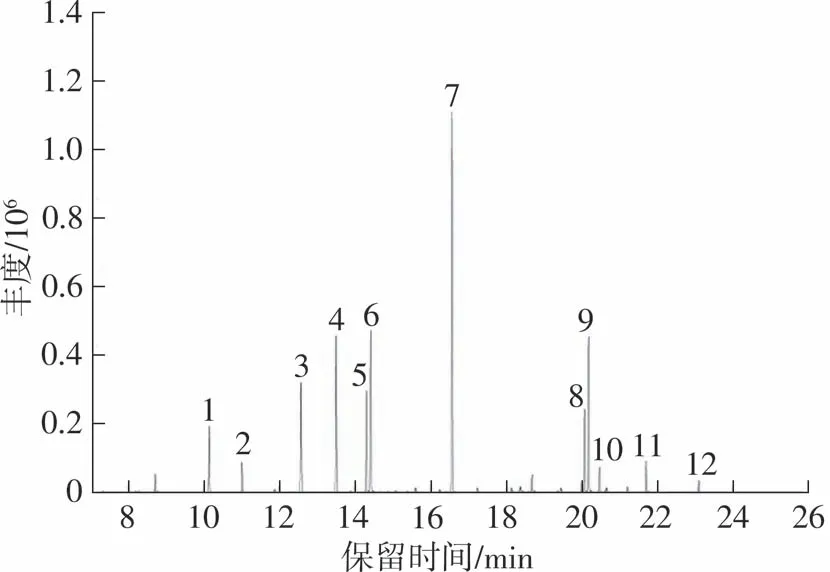
图2 塑化剂的总离子流色谱图(SIM模式)Fig.2 Total ion flow chromatogram of plasticizers(SIM mode)
2.2.1 固相微萃取条件的选择
2.2.1.1 萃取纤维的选择
最常用的萃取纤维材料为PDMS。根据待测物的不同,为改变萃取材料的极性、加大对不同物质的萃取效果,目前已有多种基于PDMS的改性复合材料面世。文中以PDMS萃取纤维头(膜厚100μm)、DVB/PDMS萃取纤维头(膜厚65μm)、Carbon WR/PDMS萃取纤维头(膜厚95μm)、DVB/Carbon WR/PDMS萃取纤维头(膜厚80μm)4种材料作为萃取纤维,控制萃取温度为80℃,磁力搅拌转速为1 000 r/min,萃取时间为50 min,各平行测定3次并取均值,来比较提取效果。实验结果(见图3)表明,PDMS纤维对DEA、DMP、DEP、DBA、DAP、DIBA的萃取效率很低,其余3种改性纤维均对11种塑化剂有一定程度的萃取效果,其中DVB/PDMS的萃取效果明显优于其他纤维材料,仅对DBP的萃取效果略差于DVB/Carbon WR/PDMS纤维。综合考虑11种待测物质的萃取效果,最终选取DVB/PDMS萃取纤维头(膜厚65μm)进行后续研究。
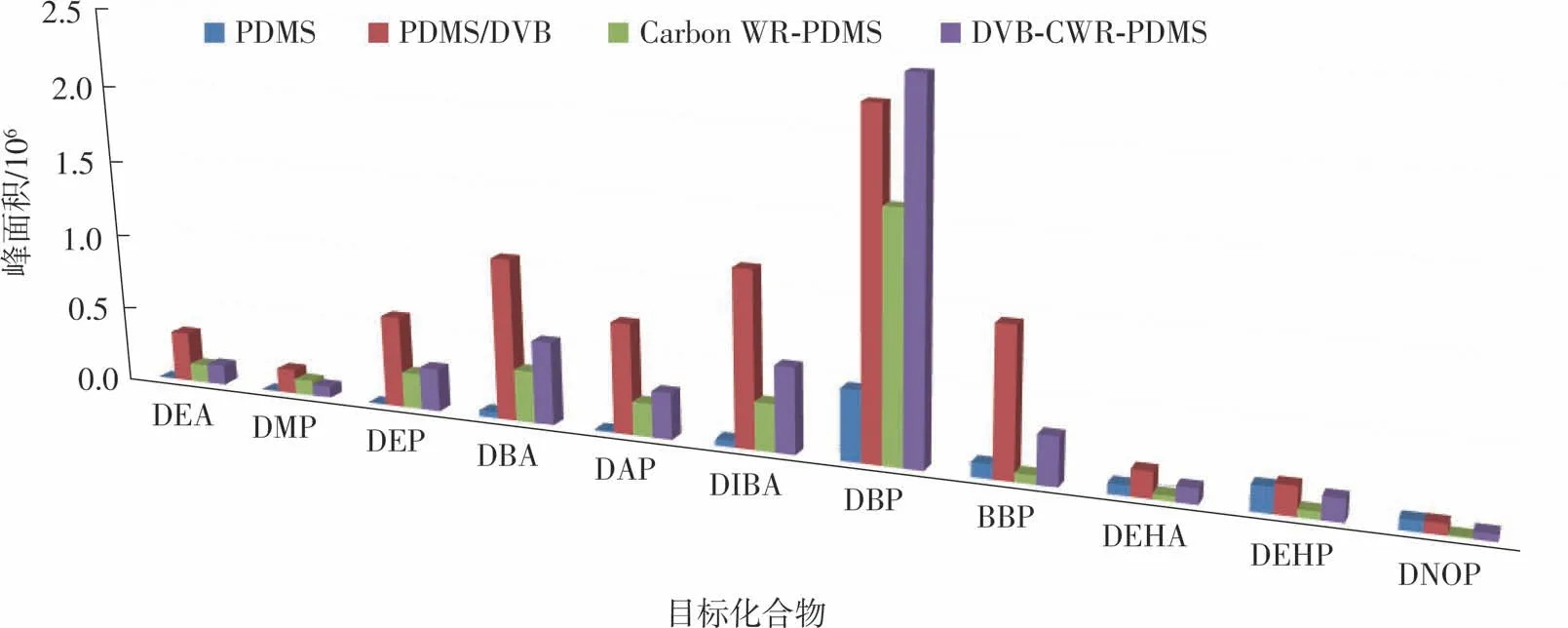
图3 不同萃取纤维萃取效果的塑化剂响应Fig.3 Response of plasticizers to different extraction fibers
2.2.1.2 萃取温度的影响
以DVB/PDMS萃取纤维头(膜厚65μm)为萃取材料,在磁力搅拌转速为1 000 r/min、萃取时间为50 min的条件下,考察6种温度(40、50、60、70、80和90℃)下的萃取效果,各平行测定3次,取均值。实验结果(见图4)表明,大多数物质在70℃开始趋于萃取平衡,在70~90℃达到稳定状态。其中DEA、DEP、DMP在高于70℃的萃取条件下峰面积呈下降趋势,而其他物质在高于70℃的条件下继续呈峰面积增加的趋势,其中响应最低的3种物质DNOP、DEHP、DEHA在高于70℃时萃取效果有较明显的提高。考虑到需要兼顾这类低响应物质的灵敏度,也考虑到大多物质在80℃时的萃取效果与90℃时的相当,且萃取温度过高会影响萃取纤维的寿命,最终选择80℃作为萃取温度。

图4 不同萃取温度下的塑化剂响应Fig.4 Response of plasticizers at different extraction temperatures
2.2.1.3磁力搅拌转速的影响
以DVB/PDMS萃取纤维头(膜厚65μm)为萃取材料,在萃取温度为80℃、萃取时间为50 min的条件下,考察5种磁力搅拌转速(0、100、200、600和1000r/min)下的萃取效果,各平行测定3次,取均值。实验结果(见图5)表明,在1 000 r/min的搅拌转速内,所有物质均呈搅拌转速越高萃取响应越好的现象。大多数物质在转速为600 r/min时趋于萃取平衡,而DIBA、DBA、BBP在转速为1 000 r/min时呈现较600 r/min时明显递进的萃取效果,故选取1 000 r/min作为搅拌转速(注:转速超过1 000 r/min时,磁力搅拌子碰壁严重,且旋转时产生较大的旋涡,从而使萃取头不能完全浸没于水样中,影响萃取效果,故实验中未考察转速大于1000r/min的萃取情况)。

图5 不同搅拌转速下的塑化剂响应Fig.5 Response of plasticizers at different stirring speeds
2.2.1.4 萃取时间的影响
以DVB/PDMS萃取纤维头(膜厚65μm)为萃取材料,在萃取温度为80℃、磁力搅拌转速为1000r/min的条件下,考察5种萃取时间(20、30、40、50和60 min)下的萃取效果,各平行测定3次,取均值。实验结果(见图6)表明,大多数物质在萃取40 min时趋于萃取平衡,在50min时达到稳定状态,故选取50min作为萃取时间。
2.2.2 热解析条件的选择
固定上述确定的萃取条件,优化解析温度及时间。
2.2.2.1 解析温度的选择
控制解析时间为2.5 min,考察5种解析温度(250、255、260、265和270℃)下的解析效果,各平行测定3次,取均值。实验结果(见图7)表明:对于低沸点物质,解析温度对解析效果没太大影响;对于沸点较高的物质如DEHP、BBP、DAP,解析温度越高,解析越完全,故选取270℃作为解析温度。将萃取头在该温度下进行二次解析,未出现待测物峰。
2.2.2.2 解析时间的选择
控制解析温度为270℃,考察5种解析时间(1.0、1.5、2.0、2.5和3.0 min)下的解析效果,各平行测定3次,取均值。实验结果(见图8)表明,所有物质在解析2.0 min后基本能被完全解析,解析时间为2.5 min时处于较为稳定的水平,故选取2.5min作为解析时间。

图6 不同萃取时间下的塑化剂响应Fig.6 Response of plasticizers at different extraction time

图7 不同解析温度下的塑化剂响应Fig.7 Response of plasticizers at different desorption temperatures
2.2.3 盐效应对萃取效果的影响
2.2.3.1 盐浓度的影响
采用文中选取的微萃取条件,并在水中添加不同量的氯化钠(使溶液浓度分别为0.0、2.5和5.0 mol/L),各平行测定3次,取均值。实验结果(见图9)表明:离子浓度对萃取效果有影响,随着离子浓度的增大,DMP的萃取效率显著提高;一定离子浓度下,DEA、DEP的萃取效率有所提高,但离子浓度过高时,萃取效率反而下降;其他物质在盐溶液条件下均呈现萃取效率下降的趋势。
2.2.3.2 盐种类的影响
采用文中选取的微萃取条件,分别在10 mL水中添加0.025 mol的氯化钠、0.025 mol的氯化钾和0.016 7 mol的硫酸钠(盐使用前需在马弗炉中于500℃下烘烤4 h),对应的盐溶液浓度分别为2.5 mol/L、2.5mol/L、1.67mol/L,3种盐溶液的阴阳离子总量均为5 mol/L。各平行测定3次,取均值。实验结果(见图10)表明,添加氯化钾与氯化钠对塑化剂萃取效果的影响程度较为接近,硫酸钠相较于前两种盐对萃取产生了负面效果(DMP除外)。可见,相同离子浓度下,不同种类的盐对萃取效果有不同的影响。

图8 不同解析时间下的塑化剂响应Fig.8 Response of plasticizers at different desorption time

图9 不同离子浓度下的塑化剂响应Fig.9 Response of plasticizers at different ion concentrations
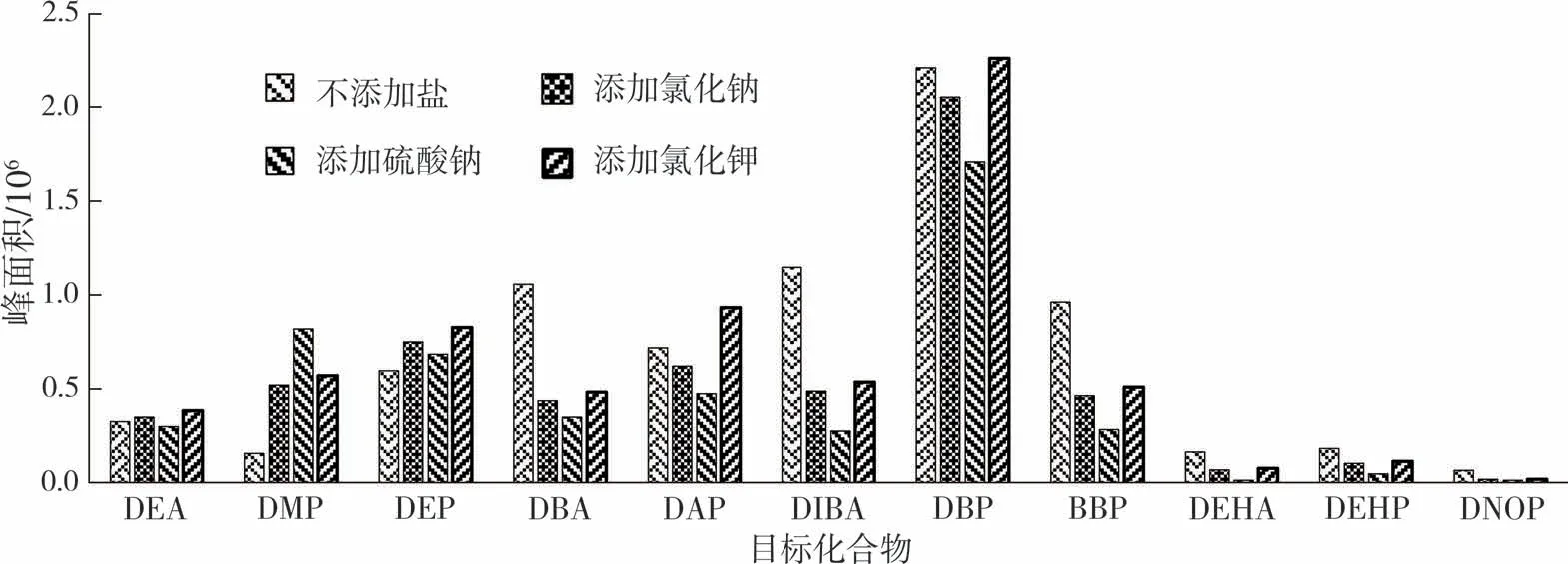
图10 不同盐溶液下的塑化剂响应Fig.10 Response of plasticizers in different salt solutions
综上所述,盐效应对塑化剂的萃取效果有影响,但影响的正负相关性没有必然的规律。盐浓度的增大能产生盐析效应,降低分析物的溶解度,增加待测物的吸附量。但盐的存在会改变涂层上静态液膜的性质,从而减少分析物从静态液膜扩散到涂层的速度,不同种类的盐产生的某些物理作用也不一致,这与王超英等[19]的结论一致。
考虑到浸入式萃取条件下盐溶液对萃取纤维会有一定程度的损害,影响萃取纤维寿命,文中选择在无添加盐的条件下进行实验。当待测的地下水中含有大量无机盐,特别是氯化物和硫酸盐含量较高时,应评估盐效应的影响,在与地下水盐含量及成分相当的条件下制作相应的校准曲线。
2.3 方法的线性范围、相关系数和检出限
将一定量的标准系列混合溶液加入纯水中,按优化后的条件进行萃取和热解析,以目标化合物的质量浓度为横坐标,以目标化合物与内标化合物定量离子响应值的比值和内标化合物质量浓度的乘积为纵坐标绘制标准曲线,各待测物在0.1~2.0μg/L范围内呈良好的线性关系,相关系数大于0.996。对水样进行加标,使塑化剂含量为0.1μg/L(取样量为10mL),平行分析7次计算标准偏差(S),按照公式MDL=t(n-1,0.99)×S(此处t=3.143)计算方法检出限(MDL)[26],结果见表2。11种塑化剂的检出限在0.03~0.06μg/L之间,其中DEHP的检出限为0.05μg/L,远低于GB/T 14848—2017《地下水质量标准》中对I类水质标准的限值要求(3μg/L)[4],说明文中方法适用性良好。

表2 文中方法的回归方程、相关系数和检出限Table 2 Regression equation,correlation coefficient and detection limit of the proposed method
2.4 方法的精密度、准确度和实际样品测定
在优化后的条件下对按1.2节所述方法采集的地下水样品进行萃取和热解析上机分析,检出样品中的DBP含量为0.78μg/L,DEHP含量为0.22μg/L。对地下水样品进行低、中、高质量浓度(分别为0.1、0.5、1.0μg/L)的加标测定,计算相对标准偏差及加标回收率,分析数据可得11种塑化剂的回收率在60.9%~128.0%之间,相对标准偏差在6.68%~19.00%之间,结果见表3。
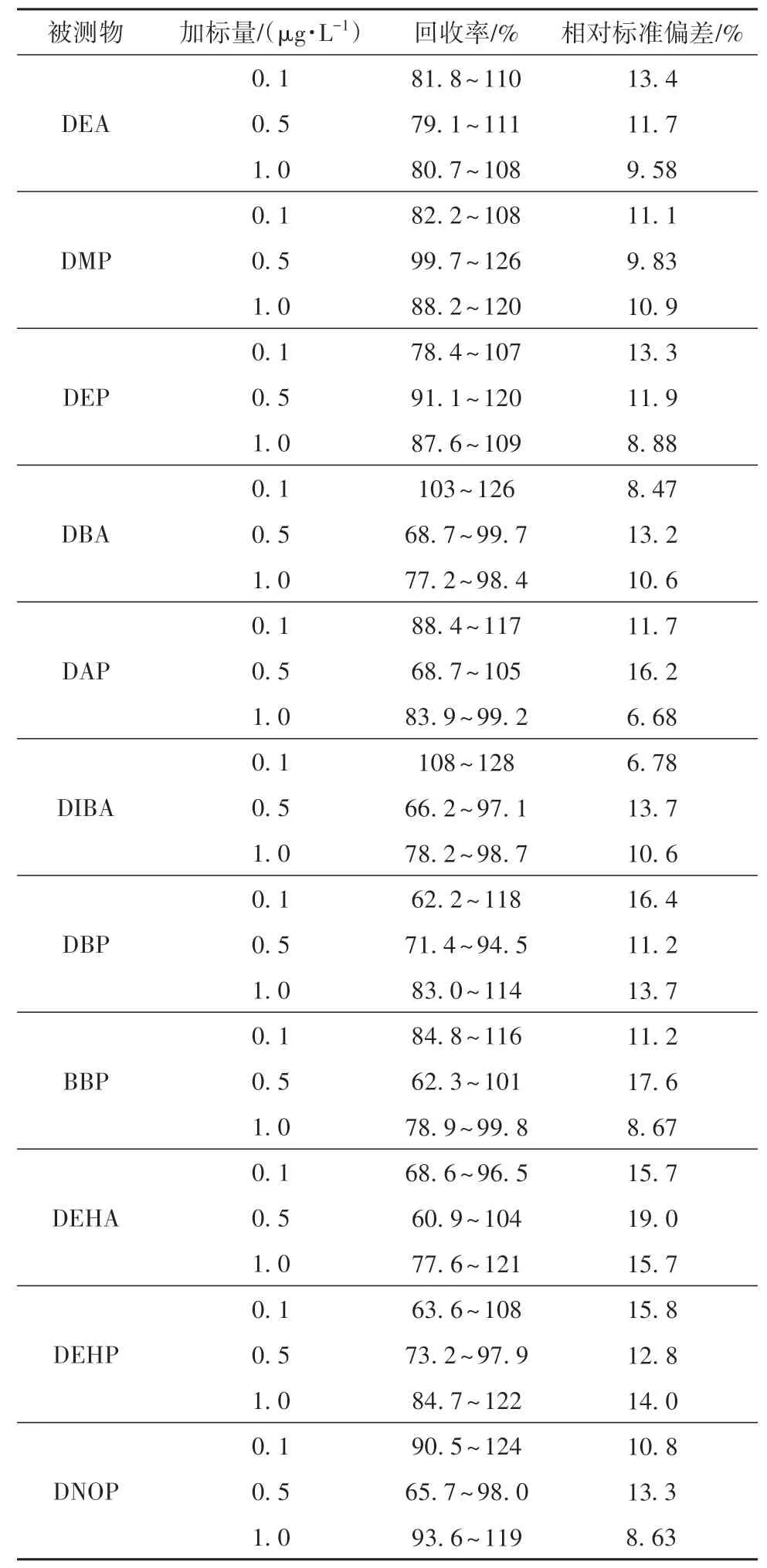
表3 文中方法的精密度和加标回收率1)Table 3 Precision and standard recovery of the proposed method
2.5 干扰及控制方法
高沸点的塑化剂易在萃取系统中残留。当高含量样品和低含量样品相继被分析时,可能会发生交叉污染。其中磁力搅拌转子极容易在萃取过程中吸附塑化剂,若其被连续使用,易将污染引入下一个待分析样品。因此,如需重复使用转子,则每做完1个样品后,需用铬酸溶液浸泡清洗转子以避免交叉污染。当检测了非常规的高浓度样品时,必须通过分析空白样来检查系统是否存在交叉污染。
萃取纤维的解析过程需在GC进样口进行,衬管的规格会大大影响出峰的形状,使用内径较小的直通型衬管可使载气的线速度更快,从而迅速传输分析物到色谱柱,形成较窄的扩散带,防止出现拖尾现象。而塑化剂大多为沸点较高的化合物,易残留于衬管中造成影响,为避免干扰,需要使用去活化的超高惰性衬管。有鉴于此,推荐使用内径0.75mm的超高惰性不分流直型衬管。
邻苯二甲酸酯类物质普遍存在于环境中,其中DBP、DEHP的污染最为常见,实验中需要把控各个环节的空白值,包括试剂、耗材、器皿等。笔者在研究空白试样的过程中发现,市售多款蒸馏水空白样中均检出较高含量的DBP、DEHP,这与盛装水的容器为塑料瓶有直接关系,故市售蒸馏水不宜用作空白样。文中还研究了自来水经去离子水纯水机制得的一级水和MilliQ水空白样,从中均检出了DBP、DEHP,但检出量较市售蒸馏水低很多,其中MilliQ水中的检出含最低,这与Penalver等的[22]研究结果一致,故选取MilliQ水作为实验用水。由于自来水中DBP、DEHP的本底检出量不稳定(不同日期的自来水本底存在波动),因此制备出的MilliQ水的检出量也不稳定,当检出的DBP和DEHP本底低于文中方法的检出限时,MilliQ水能直接使用,反之需对其进行二次蒸馏(二次蒸馏水的制备方法如下:每1 L水中加入10 mL硫酸溶液及少量高锰酸钾溶液,在200℃下蒸馏,弃去100mL初滤液,余下馏出液收集至玻璃瓶中[27]),使本底低于检出限才可使用。实验发现二次蒸馏可大大降低DBP、DEHP本底,对其消除效果显著,但较难完全消除。
3 结论
1)文中建立了固相微萃取-气相色谱-质谱法测定地下水中11种塑化剂的方法。实验结果表明,11种塑化剂在0.1~2.0μg/L范围内线性关系良好,相关系数大于0.996,测得回收率范围为60.9%~128.0%,相对标准偏差范围为6.68%~19.00%;
2)文中方法的检出限为0.03~0.06μg/L,其中DEHP检出限为0.05μg/L,远低于GB/T14848—2017《地下水质量标准》规定的I类水质标准的限值要求(3μg/L);
3)相较于传统的液液萃取和固相萃取法,固相微萃取法操作简便,萃取过程无需使用溶剂,也不涉及浓缩和净化步骤,且灵敏度高。结合气相色谱-质谱仪使用还可对各待测物质进行定性分析,故该方法适用于地下水中邻苯二甲酸酯类和己二酸酯类塑化剂含量的测定。

