酶解褐藻寡糖对扇贝肌原纤维蛋白体外消化特性的影响
丛海花,常珂欣,朱嘉雯,逯晓燕,周 倩,耿文豪,杨 天*
(1.苏州农业职业技术学院食品科技学院,江苏 苏州 215008;2.大连海洋大学食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁省水产品分析检验及加工科技服务技术中心,辽宁 大连 116023;3.山东省单县自然资源和规划局,山东 菏泽 274300)
我国贝类养殖产量占比巨大,达1 498.7 万t[1]。以贝类为来源的蛋白质约为人均总动物蛋白质摄入量的15%[2]。在贝类中,虾夷扇贝(Mizuhopecten yessoensis)具有生长速度快、营养丰富、口感细嫩、味道鲜美等特性,倍受消费者青睐[3]。海洋蛋白因其高营养价值和良好的功能特性日益受到关注[4]。因此,了解扇贝的理化和功能特性以及在人体内的消化情况变得尤为重要。
目前褐藻寡糖的制备主要分为化学法和酶解法2 种方法,但化学法的操作过程具有反应进程控制难度大、产物不纯等问题,降解过程更易控制且产率更高的酶解法逐渐成为主流提取方法[5]。研究表明,酶解褐藻寡糖(enzymatic hydrolysate of alginate oligosaccharides,EAO)是由褐藻胶酶促降解产生,具有许多生物活性[6],如促进海洋微藻的生长[7]、抑菌[8]、抗肿瘤[9]、促进肠上皮细胞恢复进而提升小肠健康功能[10]、增强冻藏期间虾肌原纤维蛋白的稳定性[11]、促进植物根茎生长[12]等。褐藻寡糖也具备一些物理化学特性,例如,Urtuvia等[13]研究发现,褐藻寡糖可以形成稳定的黏稠溶液,具备优良的保水性和乳化性,还可以被用作伤口愈合材料来加速骨骼肌的再生[14]。Zhang Bin等[15]研究发现,褐藻寡糖对蛋白的修饰作用可以降低虾肌原纤维蛋白的降解,增强蛋白的稳定性,防止其出现结构损伤。褐藻寡糖对鱼糜的稳定性也有改善作用,可以改变其极性结构,使蛋白结构更加聚集、紧密[16]。添加褐藻寡糖后和肌原纤维蛋白之间发生结构变化,对蛋白的热稳定性和低温环境下的抗冻性均有保护作用[17]。
随着人们对食品营养成分的不断重视,建立消化模型研究食物在人体内吸收情况的技术也发展的越来越成熟。体内消化可以更详尽研究物质在人体或动物体内消化的具体情况,更能展示接近真实的消化过程,但体内消化实验周期长,个体实验差异大,涉及伦理道德等问题[18]。体外消化更加易于操作也更加稳定,被用于判断食物在人体或动物体内的生物利用率等。体外消化模型可以分为静态消化模型和动态消化模型2 种,研究对象和研究目的不同都会影响消化模型的选择[19]。体外消化模型在当今研究中已经被广泛应用,例如,刘冬梅等[20]将西蓝花冻干粉进行模拟胃肠消化,以此研究不同烹饪方式对西蓝花中成分的影响。静态体外消化模型也被应用于判断食物营养成分在人体中的生物利用性,例如:大豆蛋白在磷酸化和碱基化处理后对消化性能的影响[21];南美白对虾提取物对人体潜在致敏性的研究[22]等。
目前多数研究集中于褐藻寡糖的功能作用,缺乏褐藻寡糖和蛋白结合后的相关结构变化,因而本研究探讨在人体消化环境中EAO对肌原纤维蛋白修饰作用的影响。虽然褐藻寡糖的各项特性得到广泛关注,但利用静态体外消化模型将褐藻寡糖和扇贝肌原纤维蛋白结合产生复合物的报道较少。本研究采用EAO,与团队前期研究[16-17]对应,以此进一步研究消化过程中蛋白质及蛋白质和寡糖复合后的相关变化。将提取自鲜活虾夷扇贝的肌原纤维蛋白作为研究对象,观察其与EAO结合后在各消化阶段的变化。
1 材料与方法
1.1 材料与试剂
实验选用鲜活的虾夷扇贝,购于大连黑石礁国亿生鲜超市,于30 min内进行处理,去除扇贝生殖腺及裙边,保留新鲜的扇贝柱。实验选用的EAO购于中科荣信生物科技有限公司。
三羟甲基氨基甲烷(Tris)、尿素(分析纯) 国药集团化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 天津市大茂化学试剂厂;牛血清蛋白北京索莱宝科技有限公司;氯化钠(NaCl) 天津市富宇精细化工有限公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
LDS-1高速组织捣碎机 上海标本模型厂;JYL-C93T破壁机 九阳股份有限公司;HR/T20MM立式高速冷冻离心机 湘仪离心仪器有限公司;NEXUS670红外光谱仪美国PerkinElmer公司;Epoch2酶标仪、Synergy H1/H1M酶标仪 美国伯腾仪器有限公司;F-2700荧光分光光度计日本日立公司;UV-9000双光束紫外-可见分光光度计日本岛津有限公司;PHSJ-4F精密数显pH计 山东晨拓科学仪器有限公司。
1.3 方法
1.3.1 扇贝肌原纤维蛋白的提取
根据Xiong YoulingL.等[23]的方法稍作修改,对鲜活扇贝进行处理,将扇贝柱放入破壁机绞成糜状,加入样品体积5 倍的10 mmol/L Tris-HCl(pH 7.2),将处理后的样品放入离心机中,5 000 r/min离心15 min后取沉淀;向沉淀中加入4 倍体积的含0.6 mol/L NaCl的Tris-HCl缓冲液(pH 7.2),4 500 r/min离心20 min后分离所得上清液即为肌原纤维蛋白。
1.3.2 模拟体外消化过程
取51.59 mL提取所得肌原纤维蛋白溶液(质量浓度13.56 g/mL),添加EAO,使其质量浓度为0.45 g/100 mL。将肌原纤维蛋白溶液和添加EAO的肌原纤维蛋白溶液在40 ℃数显电热水浴锅中加热30 min,再升温至90 ℃后加热20 min。根据Calvo-Lerma[24]、Minekus[25]等的研究,进行体外消化。
首先,模拟食物经由口腔环境的过程。在37 ℃条件下,将5 mL样品与5 mL模拟唾液混合,在水浴恒温振荡器中振摇5 s。
使用6 mol/L盐酸将样品的pH值调整至3。在配制的模拟胃液中加入胃蛋白酶溶液,使酶活力达到2 000 U/mL。模拟人体胃部消化过程,分别在消化时间为0、0.5、1.0、2.0 h 4 个阶段取样。
在模拟胃部消化结束后使用1 mol/L氢氧化钠将样品pH值调整至7。向模拟肠液中添加20 mL 0.16 mmol/L胆盐溶液和40 mL 100 U/mL胰蛋白酶溶液。混合后在水浴恒温振荡器中37 ℃振摇,模拟肠道消化过程,分别在消化时间为0、1、2、3 h 4 个阶段取样。
所有样品取样后在4 ℃低温层析柜中保存。将扇贝肌原纤维蛋白组记为M组,EAO-肌原纤维蛋白组记为EAO组。M组未消化,胃消化0、0.5、1.0、2.0 h,肠消化0、1、2、3 h分别记为对照组,G0、G0.5、G1.0、G2.0,I0、I1、I2、I3组;EAO组未消化,胃消化0、0.5、1.0、2.0 h,肠消化0、1、2、3 h分别记为A0,GA0、GA0.5、GA1.0、GA2.0,IA0、IA1、IA2、IA3组。
1.3.3 消化率测定
根据Cao Yungang等[26]的方法,稍作修改。取1 mL消化样品与1 mL 10 g/100 mL三氯乙酸溶液均匀混合,4 ℃、10 000×g离心10 min,弃上清保留沉淀。在离心管中加入1 mL 1 mol/L氢氧化钠溶液,使用双缩脲法在540 nm波长处测定吸光度,肌原纤维蛋白体外消化率按式(1)计算。

式中:ρs0为未消化组(对照组)的肌原纤维蛋白质量浓度/(mg/mL);ρt为三氯乙酸沉淀后各组肌原纤维蛋白质量浓度/(mg/mL)。
1.3.4 内源性荧光光谱测定
与Cao Yungang等[27]的方法相似,并作适当修改。将肌原纤维蛋白稀释至1 mg/mL,设置激发波长为280 nm,扫描范围290~310 nm,使用荧光分光光度计对样品进行检测。
1.3.5 紫外吸收光谱测定
参考Huang Xiaoqin等[28]的方法,稍作修改,设置图谱扫描速率为10 nm/s,扫描波长区间为200~400 nm。使用Origin软件对样品扫描后的数据进行处理,得到紫外二阶导数后计算并得到紫外二阶r值。
1.3.6 活性巯基含量测定
根据Yarnpakdee等[29]的方法,取0.25 mL肌原纤维蛋白样液与2.25 mL Tris-HCl混合(含0.2 mol/L Tris-HCl、10 mmol/L乙二胺四乙酸,pH 6.8),再加入0.25 mL 10 mmol/L 5,5’-二硫代双(2-硝基苯甲酸)溶液,在4 ℃下反应1 h,测定412 nm波长处的吸光度。活性巯基含量按式(2)计算。
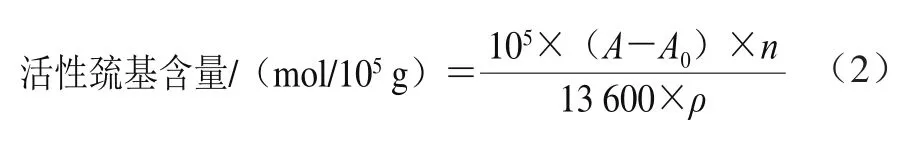
式中:A为样品的吸光度;A0为对照组样品的吸光度;n为稀释倍数;ρ为肌原纤维蛋白质量浓度/(mg/mL)。
1.3.7 表面疏水性测定
参考Benjakul等[30]的方法。将肌原纤维蛋白溶液稀释成0.1、0.2、0.3、0.4、0.5 mg/mL,取上述溶液2 mL与10 μL 8-苯胺-1-萘磺酸(pH 7.5)混匀,避光冷藏静置20 min。使用酶标仪将激发波长设置为375 nm,发射波长为485 nm,增益为50,测定表面疏水性。
1.3.8 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)测定
根据Ma Ying等[31]的方法稍作修改,使用12%聚丙烯酰胺凝胶进行SDS-PAGE分析。上样量10 μL。凝胶用0.1 g/100 mL考马斯亮蓝R-250染色,将凝胶放入含50%甲醇和10%乙酸的溶液中进行脱色处理,对比标准蛋白Marker以确定各条带的分子质量。
1.3.9 氢键含量测定
根据李德阳等[32]的方法稍作修改,配制10 mL 0.6 mol/L NaCl溶液和0.6 mol/L NaCl与1.5 mol/L尿素混合溶液,取2 mL样品分别与上述2 种溶液混合,在4 ℃下静置1 h后放入转速为8 000 r/min的离心机中离心10 min。0.25 g/100 mL考马斯亮蓝溶液和上清液按体积比5∶1混合,静置5 min后在595 nm波长处测定吸光度,氢键含量参考李德阳等[32]的方法计算。
1.4 数据处理
实验中各指标均进行3 次平行实验,结果用平均值±标准差表示。使用Origin 2018软件和Microsoft Excel 2010软件对实验数据进行分析,通过IBM SPSS Statistics 23.0统计分析软件进行各组间的差异显著性分析,P<0.05。
2 结果与分析
2.1 EAO对虾夷扇贝肌原纤维蛋白体外消化率的影响
由表1可知,EAO组比M组具有更高的消化率,可能是由于EAO的添加暴露了蛋白中的疏水基团导致的。同时,2 组样品也基本呈现消化率上升的趋势。在胃消化阶段,EAO组比M组具有更高的消化率(P<0.05)。随着消化时间的延长,样品在肠消化阶段消化率的变化基本不大,在肠消化1 h时再次出现显著性变化(P<0.05),肠消化3 h时显著升高(P<0.05)。Wan Jin等[33]在断奶仔猪的饲料中添加褐藻寡糖测定仔猪消化率的变化,发现褐藻寡糖的添加提高了仔猪的消化率,可以作为有效的饲料添加剂,推测EAO的添加可能是提高蛋白消化率的有效手段,由此可以解释本实验中EAO组消化率更高的现象。
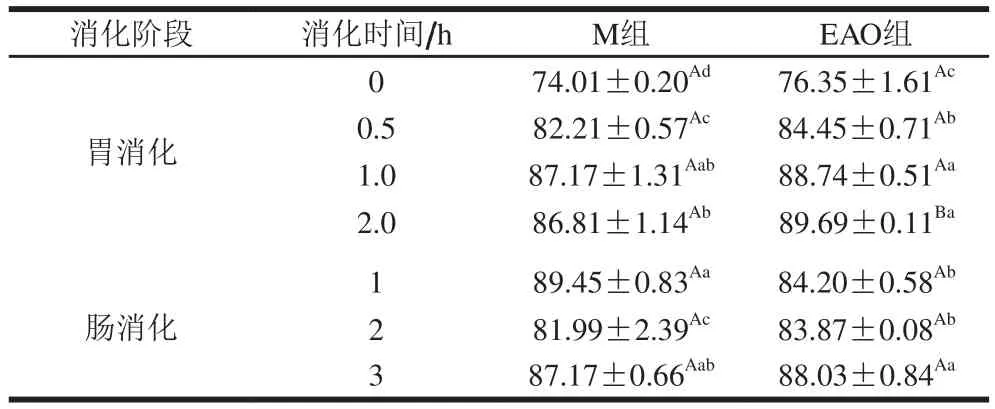
表1 EAO对虾夷扇贝肌原纤维蛋白体外消化率的影响Table 1 Effect of EAO on digestibility of scallop myofibrillar protein%
2.2 EAO对虾夷扇贝肌原纤维蛋白内源性荧光光谱的影响
不同种类的蛋白质有不同的色氨酸发光最大值,这是分析蛋白质构象变化的一种方法,导致色氨酸荧光光谱发生变化的主要原因是色氨酸微环境的改变[34]。由图1A可知:随着消化时间的延长,扇贝肌原纤维蛋白荧光强度逐渐降低,并发生轻微蓝移;肠道消化3 h后荧光强度最低。这可能是由于肌原纤维蛋白在消化过程中发生变性或结构展开,使得更多的色氨酸残基暴露,最终导致荧光强度降低,这一现象和Zhang Longteng等[35]研究结果一致。由图1B可知,添加0.45 g/100 mL EAO后,各消化阶段的EAO-扇贝肌原纤维蛋白复合物的荧光强度发生明显变化。在298 nm处,肌原纤维蛋白的荧光强度为223.9,A0组荧光强度为160.3,降低28.4%,推断EAO的添加对蛋白的变性和折叠有一定影响,使更多的芳香族氨基酸暴露出来,降低了整体的荧光强度。此外,肌原纤维蛋白的氧化也有可能引起结构产生聚集,部分氨基酸荧光被猝灭,进而成为降低荧光强度的原因[36-37]。

图1 扇贝肌原纤维蛋白(A)与EAO-扇贝肌原纤维蛋白复合物(B)内源荧光光谱Fig.1 Intrinsic fluorescence spectra of scallop myofibrillar protein in the absence (A) and presence (B) of EAO
2.3 EAO对虾夷扇贝肌原纤维蛋白紫外吸收光谱的影响
由于紫外光谱本身具有独特的能力,可用于检测涉及芳香族氨基酸微环境的蛋白质结构变化,现已被证明是一种有效的分析工具[38]。由图2可知,扇贝肌原纤维蛋白消化后的最大吸收波长约为280 nm,经过EAO修饰后,紫外吸收光谱趋势基本不变且最大吸收峰没有显著变化,消化各时间节点的紫外吸光度大小也基本无变化,但最大吸光度有轻微增大,这可能是由于EAO和肌原纤维蛋白结合后引起分子间相互作用,使更多的氨基酸基团被暴露在外[39]。

图2 扇贝肌原纤维蛋白(A)与EAO-扇贝肌原纤维蛋白复合物(B)紫外吸收光谱Fig.2 UV absorption spectra of scallop myofibrillar protein in the absence (A) and presence (B) of EAO
为了进一步研究EAO对肌原纤维蛋白构象的影响,处理得到紫外二阶导数吸收光谱图。由图3可知,在203、205、206、208 nm波长处得到4 个吸收峰,并出现轻微红移。
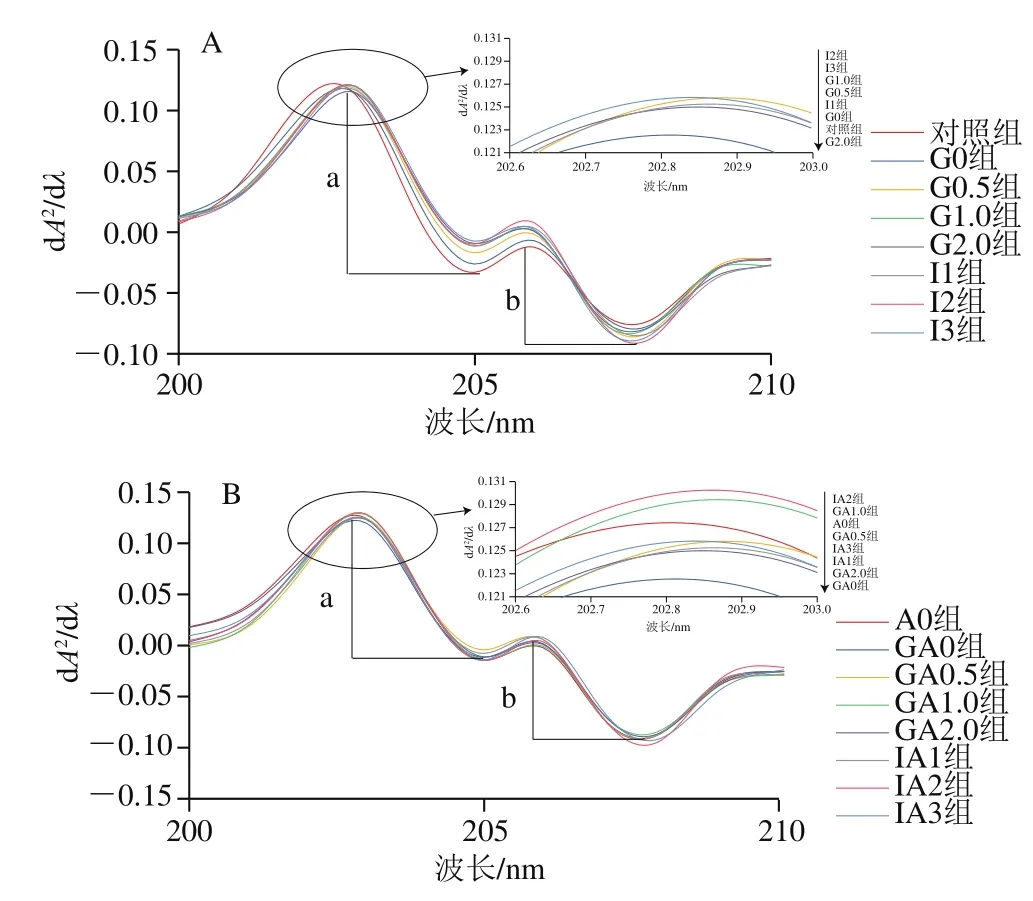
图3 扇贝肌原纤维蛋白(A)与EAO-扇贝肌原纤维蛋白复合物(B)紫外二阶导数图谱Fig.3 Second-order derivative UV absorption spectra of scallop myofibrillar protein in the absence (A) and presence (B) of EAO
紫外二阶导数r值的大小受酪氨酸在环境中暴露程度的影响。由表2可知,随着消化时间的延长,M组和EAO组r值呈现整体降低的趋势。与对照组相比,扇贝肌原纤维蛋白在胃消化过程中r值显著降低(P<0.05),肠消化过程中与对照组相比也存在显著差异(P<0.05)。随着体外消化的进行,与对照组相比,EAO-扇贝肌原纤维蛋白复合物r值并无显著变化,但肠道消化3 h时显著降低(P<0.05)。

表2 扇贝肌原纤维蛋白与EAO-扇贝肌原纤维蛋白复合物紫外二阶导数r值Table 2 Second-order derivative UV absorption r value of scallop myofibrillar protein in the absence and presence of EAO during simulated digestion
横向对比分析,与M组相比,添加EAO后,r值并无显著变化,胃消化1 h时r值最大,说明这一时刻酪氨酸的暴露量达到最大[40]。M组胃消化过程中G0、G0.5、G1.0组间均无显著差异,但胃消化时间延长至2 h,r值显著降低(P<0.05)。EAO组胃消化各阶段、肠消化各阶段的r值均无显著差异。由以上结果可知,EAO的加入会改变蛋白微环境,使更多的酪氨酸暴露于有机溶剂中[6]。本研究也证实了酶解后的产物会有更高含量的疏水性氨基酸,如酪氨酸等,这一发现也和Najafian等[41]的结论一致。
2.4 EAO对虾夷扇贝肌原纤维蛋白活性巯基含量的影响
活性巯基对于稳定蛋白质的空间结构有重要作用[42],同时,可以有效反映蛋白质的氧化程度,活性巯基含量越低,表示蛋白的氧化程度越高[43]。由图4可知:M组和EAO组初始活性巯基含量分别为7.83、9.26 mol/105g;进行胃部消化后,活性巯基含量显著降低(P<0.05),M组下降约77.62%、EAO组下降约82.60%;样品在进入肠道消化后活性巯基含量也略有降低,于肠消化2 h后逐渐趋于稳定状态。但样品消化时间的延长并不会引起样品活性巯基含量的显著变化。由于胃相本身是一个变化复杂多样的环境,胃酸的不断分泌会保持胃内的pH值始终处于较低状态,而胃蛋白酶在低pH值环境下可以促使蛋白变性[44],上述2 种情况的结合促使扇贝肌原纤维蛋白构象发生变化,更多的巯基被暴露出来,引起活性巯基含量降低,这和陈启航等[45]研究发现虾夷扇贝在超高压下巯基含量显著降低的结论一致。肌原纤维蛋白中添加卡拉胶寡糖后,巯基含量均显著下降且呈现添加量依赖性,添加量0.6%卡拉胶寡糖具有更好的抗冷冻氧化作用[46]。推测本研究中EAO具有一定的抗氧化能力,因此可以减缓肌原纤维蛋白活性巯基含量的下降[47]。
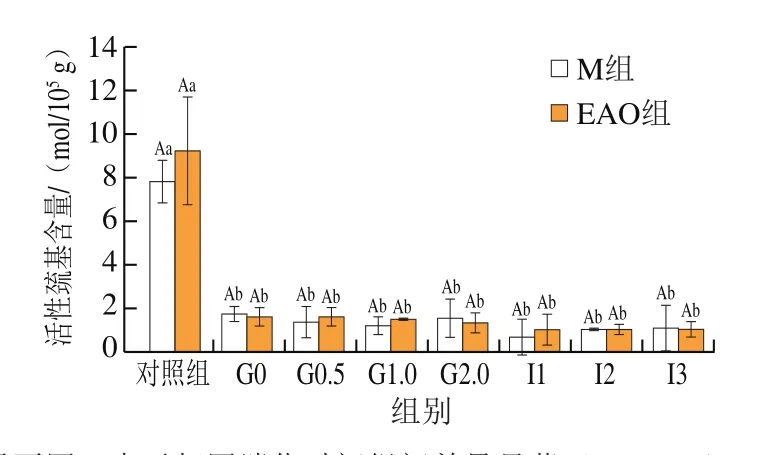
图4 扇贝肌原纤维蛋白与EAO-扇贝肌原纤维蛋白复合物活性巯基含量Fig.4 Reactive sulfhydryl content of scallop myofibrillar protein in the absence and presence of EAO during simulated digestion
2.5 EAO对虾夷扇贝肌原纤维蛋白表面疏水性的影响
构成蛋白质的多数非极性氨基酸侧链分布在蛋白质分子内部,进而可以形成疏水内核,疏水基团也会显露出来,这是蛋白质分子具有疏水性的原因[48]。蛋白质分子表面暴露出越多的疏水基团,对应的表面疏水性也就越高,蛋白质变性程度也就越大[49]。由图5可知:M组开始消化后表面疏水性显著降低(P<0.05),相比于对照组降低47.29%,在胃消化2 h时达到最小值,在进入肠道消化1 h后,表面疏水性略有上升但不显著,在肠道消化2 h后开始显著升高(P<0.05);EAO组的表面疏水性显示了基本相似的变化,同样表现为进入消化环境后与对照组相比出现显著变化(P<0.05);但略有不同的是,EAO的添加使EAO-扇贝肌原纤维蛋白复合物的表面疏水性高于未添加组,4 组胃消化样品和对照组相比分别升高95.06%、75.81%、84.67%、37.65%。以上现象说明,酸性的胃环境导致肌原纤维蛋白的构象发生改变,随着消化时间的延长不断展开,这与巯基的变化一致。进入肠道消化后,pH值再次发生改变,随着pH值不断接近等电点范围,表面疏水性逐渐升高,使得分子间结合更加紧密[50]。相似的结果在周心雅等[51]的研究结果中也得到证实。EAO作为一种低聚糖具有良好的抗消化性,因此也可能更容易改变蛋白的结构[52],因此相比于M组,EAO组的表面疏水性更高。
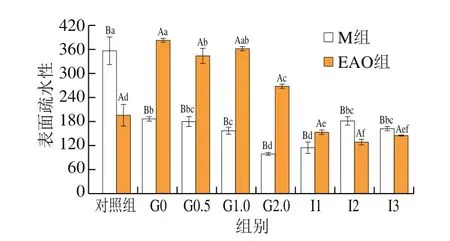
图5 扇贝肌原纤维蛋白与EAO-扇贝肌原纤维蛋白复合物的表面疏水性Fig.5 Surface hydrophobicity of scallop myofibrillar protein in the absence and presence of EAO during simulated digestion
2.6 肌原纤维蛋白的SDS-PAGE图谱
由图6可知:随着消化时间的延长,各条带逐渐消失,低分子质量的条带颜色逐渐加深,这些现象和刘楚怡等[53]研究发现一致;褐藻寡糖-虾夷扇贝肌原纤维蛋白复合物和扇贝肌原纤维蛋白的条带没有明显差异,并且在48 kDa附近的条带基本完全消失,但在消化过程中EAO组(A0、GA2、IA1、IA3)在5 kDa分子质量附近的条带颜色要略深于M组(对照、G2、I1、I3),这可能是由于EAO的添加进一步提高了复合物中蛋白酶解程度[54]。3 条颜色较深的条带分别集中在17~35 kDa、11 kDa附近和5 kDa附近。还有2 条颜色较浅的条带分布在75 kDa附近。结果表明,样品在胃和肠消化期间消化完全,蛋白也被大量分解,同时样品中含有少量α-乳白蛋白(14.2 kDa)和β-乳球蛋白(18.4 kDa)[55]。这和任方林等[56]发现大豆乳清蛋白在模拟消化过程中可以被胃液溶解,但在后续消化过程中基本不变的现象相符。
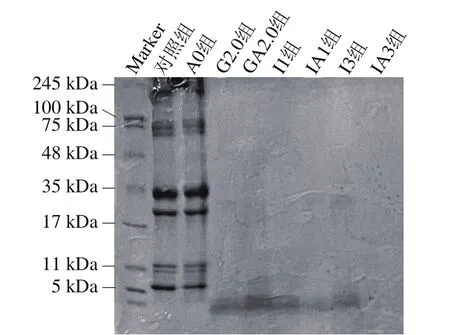
图6 扇贝肌原纤维蛋白与EAO-扇贝肌原纤维蛋白复合物的SDS-PAGE图Fig.6 SDS-PAGE pattern of scallop myofibrillar protein in the absence and presence of EAO during simulated digestion
2.7 EAO对虾夷扇贝肌原纤维蛋白氢键含量的影响
pH值的改变对于EAO-蛋白复合物的影响本身就较为复杂,再结合复杂的胃肠消化环境致使氢键变化更加复杂,因此图7只呈现2 组样品在胃消化期间的氢键含量变化。周心雅等[51]通过调节酸碱度的变化深入研究兔肉肌原纤维蛋白功能特性时发现,氢键含量会随着pH值的升高而增大。张超等[57]研究发现,大豆分离蛋白-壳聚糖复合材料的主要作用力之一是氢键,并且pH值的降低使这种复合材料具有更稳定的溶液体系。由图7可知:EAO组样品胃消化0.5 h后氢键含量较对照组显著下降(P<0.05),随着消化时间的延长,氢键含量略有上升但各组间差异不显著,EAO的添加使氢键的含量变化比M组显著(P<0.05)。这些变化可能是由于样品进入低pH值环境下氢键稳定性急剧下降,但同时随着消化的进行,蛋白持续展开,增加了氢原子的结合位点,使EAO-肌原纤维蛋白复合物的氢键含量升高,氢键作用力也随之增强[58-59]。
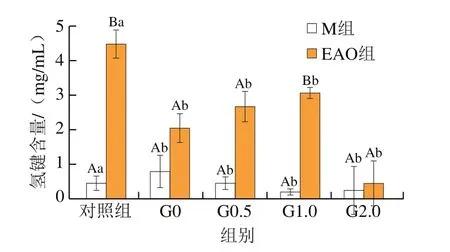
图7 扇贝肌原纤维蛋白与EAO-扇贝肌原纤维蛋白复合物样品消化后氢键的含量Fig.7 Hydrogen bond content of scallop myofibrillar protein in the absence and presence of EAO during simulated digestion
3 结 论
本研究通过测定提取的虾夷扇贝肌原纤维蛋白和经EAO修饰后的EAO-肌原纤维蛋白复合物在消化过程中结构的变化,探究在消化环境中EAO的添加对虾夷扇贝肌原纤维蛋白结构的影响。
胃和肠消化是一个存在剧烈酸碱度变化、十分复杂的过程。随着消化的进行,肌原纤维蛋白的构象发生变化,随之发生变性;消化的进行也使蛋白被大量分解,肌原纤维蛋白在消化过程中持续发生氧化;同时,表面疏水性和氢键含量的变化结果也相符。添加EAO后,改变了肌原纤维蛋白微环境,使肌原纤维蛋白结构发生变化,影响了肌原纤维蛋白的折叠。EAO的修饰作用使肌原纤维蛋白具有更好的分子间作用力(氢键含量更高),抑制了肌原纤维蛋白的氧化,同时改变了原始肌原纤维蛋白的消化特性,形成的EAO-肌原纤维蛋白复合物在人体消化有一定改善的作用,可以被更好地消化吸收。
本研究结果表明,EAO可以成为扇贝肌原纤维蛋白的改良剂,为EAO和扇贝肌原纤维蛋白的结合以及后续扇贝和EAO相关高质量、高营养产品的研发提供理论基础。

