培菌前期长水毛的中高温大曲品质特性
朱栋才,李杰,余有贵,杨涛,李新社,姜庆昊,徐海月
(1.江西李渡酒业有限公司,江西 南昌,331700;(2.邵阳学院 食品与化学工程学院,湖南 邵阳,422000;(3.生态酿酒技术与应用湖南省高校重点实验室,湖南 邵阳,422000)
大曲是白酒酿造的糖化发酵剂,具有生料制曲、自然接种、菌酶并用、使用陈曲的特点[1]。新曲的品质评价体系由感观、理化、微生物等指标构成[2],王晓慧等[3]在大曲香气成分研究、高通量测序分析、大曲分层研究和大曲感官深入分析等基础上构建入库曲和出库曲质量评定体系。大曲质量受原料、环境条件、加工工艺、菌群结构等许多因素的影响[4-7],培菌管理是关键环节之一[8],中—高温大曲的生产工艺强调“前缓、中挺、后缓落”的要求,其中,低温培菌期(前缓)的主要目的是让霉菌和酵母在30~40 ℃、相对湿度大于90%、时间2~3 d中大量繁殖,曲块表面呈现颜色一致的针头状的白色斑点或菌丛的“穿衣”现象[9],为高品质曲块立下头功。如果曲坯含水量大、安曲的曲间距小或曲块接触、盖草有明水滴落到曲块表面、曲室前期培菌的高温高湿环境、第一次翻曲不及时等操作,可导致曲块表面不能正常“穿衣”而长满絮状的灰黑色菌丝水毛,水毛属于毛霉菌,它的生长取代了曲霉菌,水毛现象被称为一种病害[10]。然而,有关水毛曲对中高温曲品质的理化、微生物群落结构的影响未见有相关报道。本研究以江西李渡酒业有限公司生产的中高温大曲为对象,研究培菌前期水毛曲与“穿衣”正常曲的陈曲在大曲理化和微生物群落方面的差异性,旨在丰富曲块质量评价体系的理论依据,并为大曲生产工艺的优化控制提供实践指导。
1 材料与方法
1.1 材料与主要仪器
1.1.1 材料
制曲原料:面粉、麸皮、鲜酒糟和水按一定比例混合而成。
正常曲:原料混合后经压曲机制成大曲坯,按“前缓、中挺、后缓落”的中高温大曲的培菌工艺要求,前期培菌时曲块表面长满针头大小的白色斑点或菌丛,这样的曲块属于正常“穿衣”,培菌结束的新曲入库贮存180 d,从陈曲中取样。
水毛曲:与正常曲不同的是入室培菌时,前期控温控湿不当,曲块表面长满灰黑色絮状菌丝即水毛,中后期管理按正常曲工艺要求,培菌结束的新曲入库贮存180 d,从陈曲中取出表面附着灰黑色絮状菌丝丛的样品。
化学药品:可溶性淀粉、蔗糖、葡萄糖、氢氧化钠、磷酸铵、磷酸二氢钾、碘化钾、重铬酸钾、酒石酸钾钠、硫酸铜、冰乙酸、无水乙酸钠、无水乙醇均为优级纯,国药集团化学试剂有限公司。
1.1.2 主要仪器
恒温干燥箱:DHG-9031A,上海-恒科学仪器有限公司。
分析天平:ML204型,梅特勒-托利多仪器(上海)有限公司。
电热恒温水浴锅:HWS-28型,上海一恒科学仪器有限公司。
台式高速离心机:Centrifuge 5418型,Eppendorf艾本德(上海)国际贸易有限公司。
PCR仪:580BR10905型,美国伯乐生物科技股份有限公司。
电泳仪:HE-120型,上海天能生命科学有限公司。
凝胶成像仪:2500型,上海天能生命科学有限公司。
生物分析仪:Bioanalyzer 2100型,安捷伦科技有限公司。
微量紫外-可见光分光光度计:NanoDrop 2000型,赛默飞世尔科技公司。
1.2 曲样采集与制备
采用三点取样法,在曲堆的上、中、下层中,每层分别取6块水毛曲和6块正常曲。收集同一类型18块大曲,先进行外观评价;然后,各层曲块随机平分成3小组,将各层的小组随机组合成3组混合样,其中每组混合样6块曲(含上中下3层曲各2块)。采用四分法制样,铲下曲块外表面1 cm厚的曲皮,粉碎后混合均匀,分别用于理化和微生物类群的指标检测。连续取样3批次。
1.3 检测方法
1.3.1 理化指标的检测
1)水分 采用常压烘箱干燥法[11],以“ % ”表示;
2)酸度 采用酸碱中和法[11],以“mmol/10 g”表示。
3)液化力 采用碘液褪色法[11],定义在35 ℃、pH为4.6条件下,1 g绝干曲l h能液化淀粉的克数为1 U,以“g/g·h”表示;
4)糖化力 采用斐林氏法[11],定义在35 ℃、pH为4.6条件下,1 g大曲1 h转化可溶性淀粉生成葡萄糖的毫克数为1 U,以 “mg/g·h”表示;
5)发酵力 采用CO2失重法[11],参照“QB/T 4257—2011酿酒大曲通用分析方法”中发酵力检测稍作改进,定义在30 ℃、24 h内1 g大曲利用可发酵糖类所产生的CO2克数为1 U,以“g/g·24 h”表示;
6)酯化力 采用皂化法[11],定义每50 g大曲在35 ℃,经过7 d催化己酸和乙醇合成己酸乙酯的毫克数为1 U,以“mg/50 g·7 d”表示。
1.3.2 微生物类群的检测
采用高通量测序方法,细菌和真菌由上海欧易生物医学科技有限公司提供。
1)细菌 采用16 S扩增子微生物多样性测序法,通过对16 S rRNA基因上的可变区域进行扩增,利用变异区域的差异分类鉴定不同菌属的细菌进行,并对大曲中细菌的丰度进行分析。
2)真菌 采用ITS扩增子微生物多样性测序法,通过DNA抽提、PCR扩增及其产物电泳检测,使用Illumina NovaSeq 6000测序平台对18 S rDNA和28 S rDNA转录间隔序列(ITS区)测序,利用变异区域的差异分类鉴定不同菌属的真菌进行,并对大曲中真菌的丰度进行分析。
2 结果与分析
2.1 水毛曲与正常曲的外表比较
由图 1 可知,前期为低温培菌期,要求入室曲坯在第2~3 d的温度控制在42 ℃以内,控制“前缓”的目的是曲块表面均匀“穿衣”,见图1(b)。而如果在培曲时曲坯表面水分过多、安曲过密致曲块接触、第一次翻曲不及时等操作,则会造成曲块表面长灰黑色菌丝的水毛,见图1(a),水毛新曲经贮存后,在陈曲的表面附着有水毛的灰黑色菌丝丛,见图1(c)。而正常曲为白色或微黄色,见图1(d)。将图1(c)的水毛曲表面局部放大,可见更清晰的灰黑色菌丝丛,见图1(e)。

图1 水毛曲与正常曲的外表比较
2.2 水毛曲与正常曲理化特性的比较
由表1可知,与穿衣良好的正常曲相比,前期长水毛的陈曲水分含量和酸度均较高,但两者之间水分含量和酸度的差异均不显著(P>0.05);水毛曲与正常曲相比,液化力稍强但两者之间差异不显著(P>0.05);糖化力、发酵力和酯化力均较弱,而糖化力之间差异极显著(P<0.01),发酵力差异显著(P<0.05),酯化力差异不显著(P>0.05)。因此,与正常曲相比,水毛曲的糖化力(P<0.01)、发酵力(P<0.05)显著下降,而液化力(P>0.05)、酸度(P>0.05)有所提高,酯化力(P>0.05)有所下降,但影响程度均不显著。

表1 水毛曲与正常曲主要理化指标的比较
2.3 水毛曲与正常曲主要微生物类群的比较
1)细菌群落属水平上结构分布的比较
水毛曲检出91个属细菌,而正常曲检出136个属细菌,在细菌属水平上水毛曲少于正常曲。由图2可知,水毛曲与正常曲排名前8的细菌类中,两者共有6类细菌:Weissella(魏斯氏菌属)、Lactobacillus(乳杆菌属)、Pediococcus(片球菌属)、Saccharopolyspora(糖多孢菌属)、Muribaculaceae(鼠李属)、Bacteroides(拟杆菌属),但各自独有2类细菌:正常曲为Acetobacter(醋酸杆菌属)和Pseudonocardiaceae(假诺卡氏菌属),水毛曲为Staphylococcus(葡萄球菌属)和Prevotella(普氏菌属)。在两者共有的6类细菌中,水毛曲显著多于正常曲的2类细菌为Weissella(魏斯氏菌属)和Pediococcus(片球菌属),水毛曲显著少于正常曲的2类细菌为Lactobacillus(乳酸杆菌属)和Saccharopolyspora(糖多孢菌属),水毛曲较少于正常曲的 2 类细菌为Muribaculaceae(鼠李属)和Bacteroides(拟杆菌属)。在排名前 4 的细菌类中,水毛曲依次为Weissella(魏斯氏菌属)、Pediococcus(片球菌属)、Lactobacillus(乳酸杆菌属)、Muribaculaceae(鼠李属),而正常曲依次为Lactobacillus(乳杆菌属)、Weissella(魏斯氏菌属)、Saccharopolyspora(糖多孢菌属)、Acetobacter(醋酸杆菌属)。酒曲中检出的主要细菌属类中,与江东材等研究偏高温大曲中细菌区系有Lactobacillus、Weissella、Pediococcus、Staphylococcus4个属相同[12],与张芸曌报道的中高温大曲中细菌区系有Lactobacillus、Weissella、Pediococcus、Staphylococcus、Acetobacter、Saccharopolyspora6个属相同[13],样品是导致相互间细菌类差异的最关键因素。
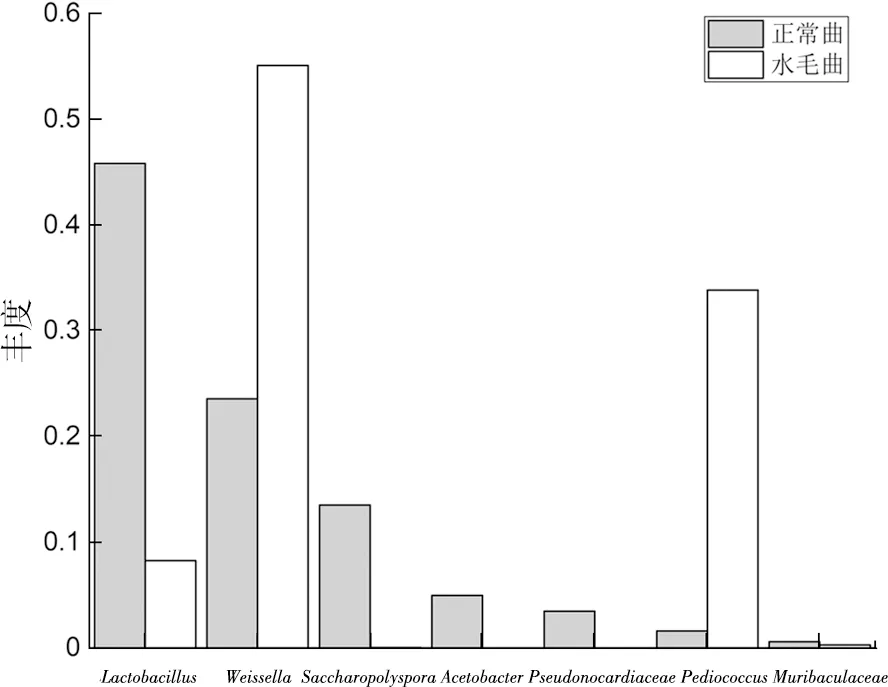
图2 水毛曲和正常曲主要细菌类(属)的结构分布比较
细菌是白酒酿造的主要生香类微生物。Lactobacillus、Weissella、Pediococcus均为乳酸 菌,能代谢生成醇类、酯类、酮类和吡嗪类等物质[14],如产生乳酸、乳酸乙酯等[15],能调节发酵酒醅初期的酸度,形成酒体的重要香味成分。Weissella属于厌氧或兼性厌氧的乳酸菌,在培菌管理前期的低温高湿的条件下生长繁殖最旺盛,与酸度呈显著性正相关(p<0.05)[13]。Lactobacillus是常见的厌氧杆菌,更适于培菌管理前期的中温高湿低氧环境生长繁殖,其代谢产物有乙酸、乳酸、乙醇以及其他重要风味化合物[13]。Saccharopolyspora能分泌多种酶类和代谢产生重要的生物活性物质,从而有利于酒体风味更加丰满[16];它与酸度呈显著性负相关(P<0.01),与液化力呈显著性正相关(P<0.05)[13]。Pediococcus可降低胺的含量,有利于发酵产品的风味形成[13]。
2)真菌群落属水平上结构分布的比较
水毛曲检出13个属的真菌,而正常曲检出12个属真菌,在真菌属水平上水毛曲稍多于正常曲。由图3可知,水毛曲和正常曲在排名前8的真菌类中,两者共有6类真菌:Aspergillus(曲霉属)、Rhizomucor(毛霉属)、Pichia(毕赤酵母属)、Rhizopus(根霉属)、Wickerhamomyces(威克氏菌属)、Lichtheimia(利希氏菌属),但各自独有 2 类真菌:水毛曲为Torulaspora(环孢菌属)和Trichosporon(毛孢子菌属),正常曲为Xeromyces(干菌属)和Candida(假丝酵母属)。在相对丰度排名前4的真菌中,水毛曲依次为Aspergillu(曲霉属)、Rhizomucor(毛霉属)、Rhizopus(根霉属)和Acremonium枝顶孢属,而正常曲依次为Aspergillus(曲霉属)、Xeromyces(干菌属)、Pichia(毕赤酵母属)、Candida(假丝酵母属)。酒曲中检出的主要真菌属类中,与张芸曌研究有Candida、Aspergillus、Rhizomucor、Rhizopus、Trichosporon5个属相同[13],样品是导致相互间主要真菌类差异的最关键因素。
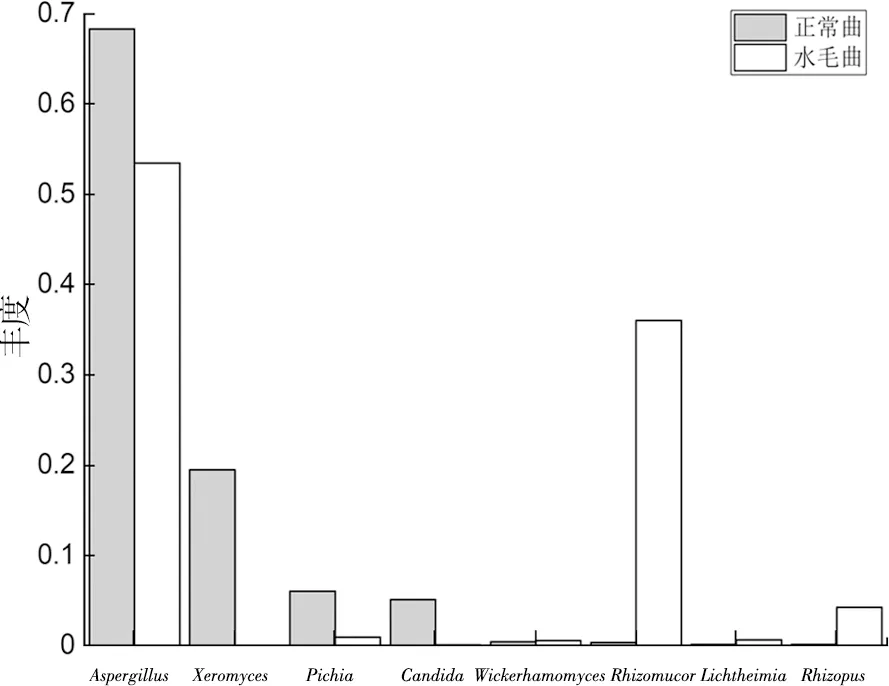
图3 水毛曲和正常曲主要真菌类(属)的分布比较
霉菌是白酒酿造中糖化的主要动力。Aspergillus能产生淀粉酶、纤维素酶、蛋白酶、脂肪酶等多种酶,对大曲液化力、糖化力、酯化力等起着关键性的调控作用,代谢产生柠檬酸、葡萄糖酸等有机酸和脂肪酸酯[17],有利于提升酒体的风味物质。Aspergillus与酸度呈显著性正相关(P<0.01)[13]。Rhizopus能代谢生成丰富的酶类如脂肪酶[18],大多数具有糖化发酵与酯化能力,从而提高出酒率和提升白酒风味;Rhizopus在曲坯入室第2 d后就开始大量繁殖,尤其在温度较高的时候[13],是大曲 “穿衣”良好的主要菌类。Rhizomucor能产蛋白酶和淀粉酶,可分解蛋白质及产生芳香物质、糖化力较强,还可产柠檬酸、乳酸和甘油等[18]。
酵母菌是白酒酿造中发酵的主要动力,除主要产生乙醇外还会产生高级醇、酯类和其他芳香活性物质。Wickerhamomyces也是一种能产酯的生香酵母[19],它与酸度呈显著性正相关(P<0.01),与液化力呈显著性负相关(P<0.05)[13]。Candida能产蛋白酶和脂肪酶[20],它与酸度呈显著性正相关(P<0.05)[13]。
水毛曲与正常曲在微生物类群结构上的差异,导致了曲块之间理化、生化指标上的差异,但水毛曲的微生物类群还需要深入分析,微生物与理化、生化指标之间的相关性还有待进一步研究。
3 结论
1)与“穿衣”正常曲相比,前期长水毛曲会导致成品曲的糖化力(P<0.01)、发酵力(P<0.05)显著下降,而液化力(P>0.05)、酸度(P>0.05)有所提高,酯化力(P>0.05)有所下降,但影响程度均不显著。
2)在微生物群落属水平的结构分布中,水毛曲检出91个属细菌、13个属真菌,而正常曲检出136个属细菌、12个属真菌。在属水平排名前8的细菌类中,水毛曲与正常曲两者共有6类细菌,但正常曲独有Acetobacter(醋酸杆菌属)和Pseudonocardiaceae(假诺卡氏菌属)2类,水毛曲独有Staphylococcus(葡萄球菌属)和Prevotella(普氏菌属)2类;在排名前4的细菌类中,水毛曲依次为Weissella(魏斯氏菌属)、Pediococcus(片球菌属)、Lactobacillus(乳酸杆菌属)、Muribaculaceae(鼠李属),而正常曲依次为Lactobacillus(乳酸杆菌属)、Weissella(魏斯氏菌属)、Saccharopolyspora(糖多孢菌属)、Acetobacter(醋酸杆菌属)。在属水平排名前 8 的真菌类中,两者共有6类真菌,且水毛曲显著多于正常曲的2类真菌为Rhizomucor(毛霉属)、Rhizopus(根霉属),水毛曲显著少于正常曲的2类真菌为Aspergillus(曲霉属)、Pichia毕赤酵母属;水毛曲独有Torulaspora(环孢菌属)和Trichosporon(毛孢菌属)2类,正常曲独有Xeromyces(干菌属)和Candida(假丝酵母属)2类。
3)研究结果揭示了中高温大曲中水毛曲与正常曲之间内在的品质差异,对于提高白酒制曲质量,进一步了解制曲条件和发酵性能之间的关系提供了一定的理论基础。

