实时荧光PCR技术快速检测食品中的蜡样芽孢杆菌
马琳琳,刘 珍,马腾州,清 江,田衍香,丁 利*
(1.长沙理工大学 化学与食品工程学院,长沙 410114; 2.长沙和合医学检验实验室有限公司,长沙 410000;3.上海海关工业品与原材料检测技术中心,上海 200135)
蜡样芽孢杆菌为革兰氏阳性菌,是引起食物中毒的食源性致病菌之一,其污染食品后,在合适的条件下菌体能快速进行繁殖并产生大量的毒素,从而导致人食物中毒[1],且在蔬菜、肉、乳制品、炒米饭以及各种甜点等[2]多种食品中分离出该菌株。蜡样芽孢杆菌含有多种可引起呕吐或腹泻的食物中毒基因[3-6],其中ces基因产生的呕吐型毒素能够转化为活性毒素吸附在内脏上;腹泻型毒素大多由肠毒素F M(ent F M)、肠毒素T(bce T)、细胞毒素K(cyt K)、溶血性素hbl和非溶血素nhe等基因共同作用[7]。蜡样芽孢杆菌还会通过菌体感染导致眼部疾病、心内膜炎、肺炎、败血症及脑膜炎等,严重时还会导致暴发性肝脏衰竭。因此,建立快速准确检测食品中蜡样芽孢杆菌以控制其污染、减少毒素危害等[2,8-11]具有重要意义。
目前,国内外对于蜡样芽孢杆菌的检测主要有传统检测方法[12]、免疫学检测方法[13-14]、聚合酶链式反应(PCR)扩增检测[15-16]等。其中,传统检测方法是国家标准方法GB 4789.14-2014《食品安全国家标准 食品微生物学检验 蜡样芽孢杆菌检验》规定的微生物培养法,如文献[17]用自制显色培养基解决蜡样芽孢杆菌鉴别和计数的困难,但试验周期较长(3~5 d),不能满足突发的食品安全以及检验时效性的要求;文献[18]采用生化鉴定与PCR相结合的方法从环境中分离鉴定蜡样芽孢杆菌,结果较准确,但该方法操作步骤复杂且耗时长。免疫学检测方法通过抗原和抗体特异性识别结合后形成复合物,从而对抗原抗体进行检测,如文献[19]采用酶联免疫技术对鞭毛血清型蜡样芽孢杆菌进行分类,具有高灵敏度和较强特异性;文献[20]采用双抗体夹心酶联免疫方法检测食品中蜡样芽孢杆菌,能有效检出多种病原体的蜡样芽孢杆菌;文献[21]报道采用免疫磁珠技术能有效检出熟制食品中蜡样芽孢杆菌,但试剂耗材较贵,且存在抗体对蜡样芽孢杆菌亲和力低的现象。随着分子生物学的发展,PCR技术在食品检测中得到了广泛的应用,如文献[22]以Plc R和cyt K为目标基因,采用PCR技术鉴定出蜡样芽孢杆菌,该方法简单但不准确;文献[23]采用单叠氮丙啶多重PCR(PMA-mPCR)技术同时检测出蜡样芽孢杆菌、沙门氏菌和阪崎肠杆菌,该方法具有良好的特异性和灵敏度,但同时扩增多对引物和不同模板需要严格的反应条件,易引起非特异性扩增,而且单叠氮丙啶对人体具有一定的致畸性;文献[24]等采用环介导等温扩增技术检测牛乳中蜡样芽孢杆菌,检出限低且操作简单,但对引物要求高且有假阳性;文献[2]等应用探针建立实时荧光PCR技术检测肉中蜡样芽孢杆菌,检测灵敏度为1×103CFU·mL-1,但探针昂贵,不适合大批量应用检测。
本工作以蜡样芽孢杆菌gyr B为目标基因,采用实时荧光PCR技术,应用分段扩增方式建立快速检测蜡样芽孢杆菌的方法,进一步对其特异性和灵敏度进行考察,并应用在实际样本的检测中,为快速、准确、有效检测食品中蜡样芽孢杆菌提供技术支撑。
1 试验部分
1.1 仪器与试剂
9600A型Real-Ti me PCR仪;ZQPWI-70型 全温振荡培养箱。
LB肉 汤 干 粉(货 号PM0010-500 g)、SYBR GREEN I(1 mL/管);细菌基因组DNA快速提取试剂盒(BSC09S1B);蜡样芽孢杆菌、沙门氏菌、金黄色葡萄球菌、单增李斯特菌等菌株及引物均购自某生物公司。
豆腐、米饭、鲜面条、米粉、炒饭、大米、甜酒、肉、土豆、红薯、生菜、空心菜共12个样本,均购自当地菜市场。
1.2 试验方法
1.2.1 引物的设计
以蜡样芽孢杆菌gyr B作为目标基因,以16S作为内参基因,应用Pri mer 5软件分析并设计引物,如表1所示,所有引物均由某公司合成。引物经短暂离心后,用双蒸水稀释至10μmo L·L-1,备用。

表1 引物序列Tab.1 Pri mer sequences
1.2.2 样本处理
对样本预处理并混匀(红薯、土豆、豆腐、肉和生菜切成1 c m大小片段;鲜面条、米粉和空心菜切成约1 c m小段;甜酒重悬;米饭和炒饭分别拌匀),分别称取5 g放至45 mL肉汤培养基中,于37℃以转速200 r·min-1培养12~14 h,取1 mL菌液提取基因组DNA,按照1.2.3节进行实时PCR扩增。
1.2.3 实时PCR扩增
反应体系(20μL):SYBR GREEN I(基体)10μL,gyr B-F 0.5μL,gyr B-R 0.5μL,DNA模板2μL,双蒸水7μL。在实时荧光PCR反应过程中采用分步扩增方式,反应条件:95℃预变性5 min,然后进入循环反应阶段,95℃变性15 s,50℃复性30 s,72℃延伸30 s,共45个循环。
2 结果与讨论
2.1 实时荧光PCR反应体系的建立
以蜡样芽孢杆菌gyr B-F、gyr B-R为引物,16S作为内参基因,按照试验方法对蜡样芽孢杆菌DNA模板进行实时荧光PCR检测,重复3次。结果表明,应用分段扩增方式,所得结果具有明显的S型扩增曲线,且gyr B-F、gyr B-R引物具有较好的重复性,说明对蜡样芽孢杆菌快速检测的实时荧光PCR技术建立成功。
2.2 实时荧光PCR特异性分析
将蜡样芽孢杆菌、沙门氏菌、金黄色葡萄球菌、单增李斯特菌分别接种在LB肉汤培养基中,其中蜡样芽孢杆菌、沙门氏菌和金黄色葡萄球菌于37℃以转速200 r·min-1振荡培养12~14 h,单增李斯特菌于25℃以转速200 r·min-1振荡培养12~14 h。采用细菌基因组DNA快速提取试剂盒分别提取上述细菌基因组DNA,以蜡样芽孢杆菌为阳性对照,沙门氏菌、金黄色葡萄球菌、单增李斯特菌等3种细菌作为阴性对照,应用上述4种菌株DNA作为模板进行实时荧光PCR,以验证蜡样芽孢杆菌引物的特异性,每个模板重复3次,结果见图1。
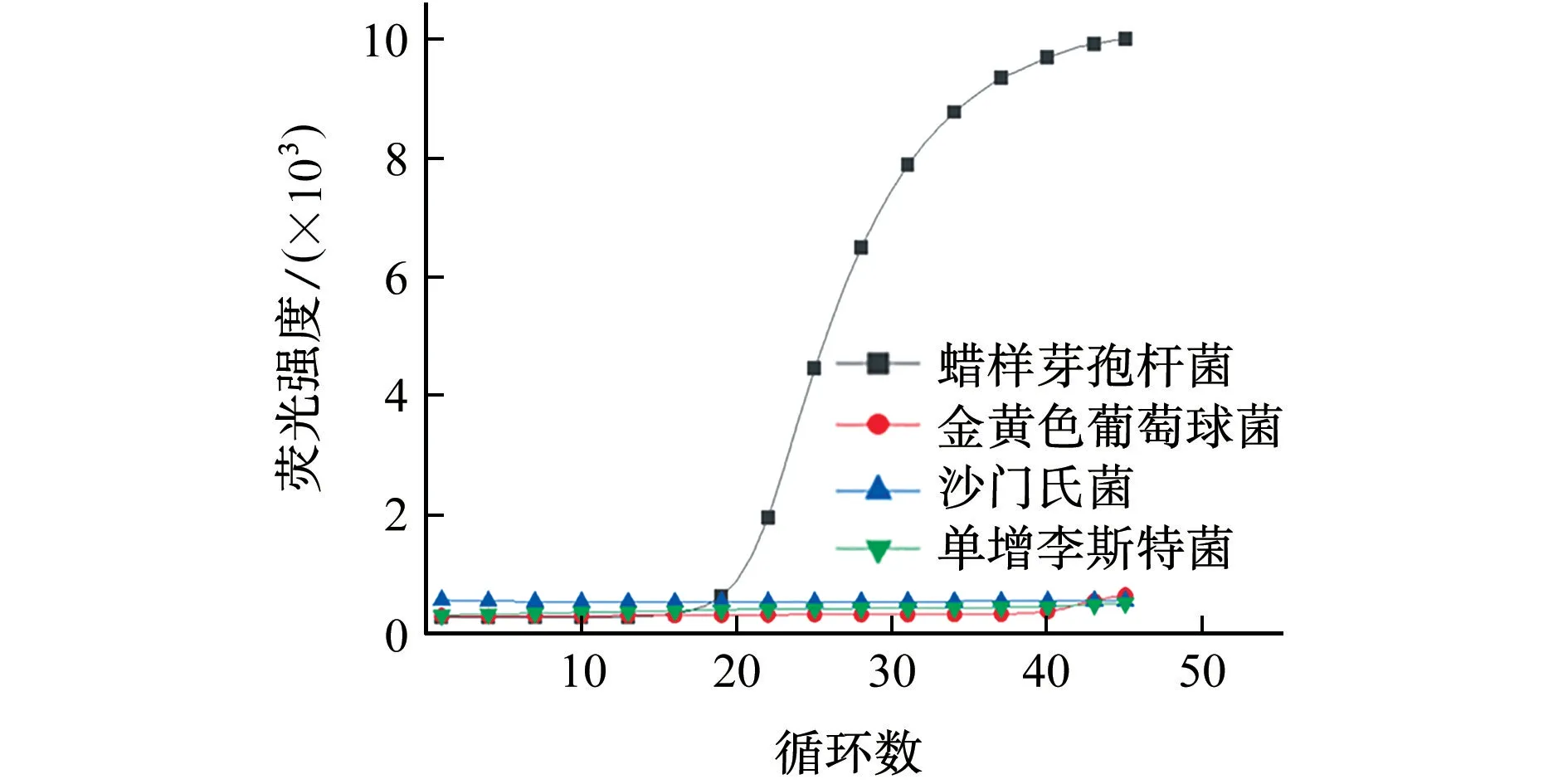
图1 实时荧光PCR检测蜡样芽孢杆菌的特异性试验Fig.1 Specificity test of real-ti me fluorescence PCR for detection of Bacill us cereus
结果表明,4种菌株中只有蜡样芽孢杆菌所得结果具有S型扩增曲线,其他3种菌株无扩增曲线,说明引物特异性高。
2.3 蜡样芽孢杆菌DNA灵敏度试验及活菌检出限
将蜡样芽孢杆菌DNA逐级稀释成0.000 01,0.000 1,0.001,0.01,0.1,1,10,100 mg·L-1等8个不同浓度水平,并分别作为模板进行荧光定量PCR试验。结果表明,实时荧光PCR检测蜡样芽孢杆菌的灵敏度可达0.01 mg·L-1。
将活化后的蜡样芽孢杆菌菌种按10倍稀释法稀释成不同浓度水平,分别接种到固体培养基上平板涂布培养,按照GB 4789.2-2010《食品安全国家标准 食品微生物学检验 菌落总数计算》进行菌落计数;同时分别取2 mL上述稀释菌液提取DNA,采用实时荧光PCR技术检测活菌检出限,结果见图2。
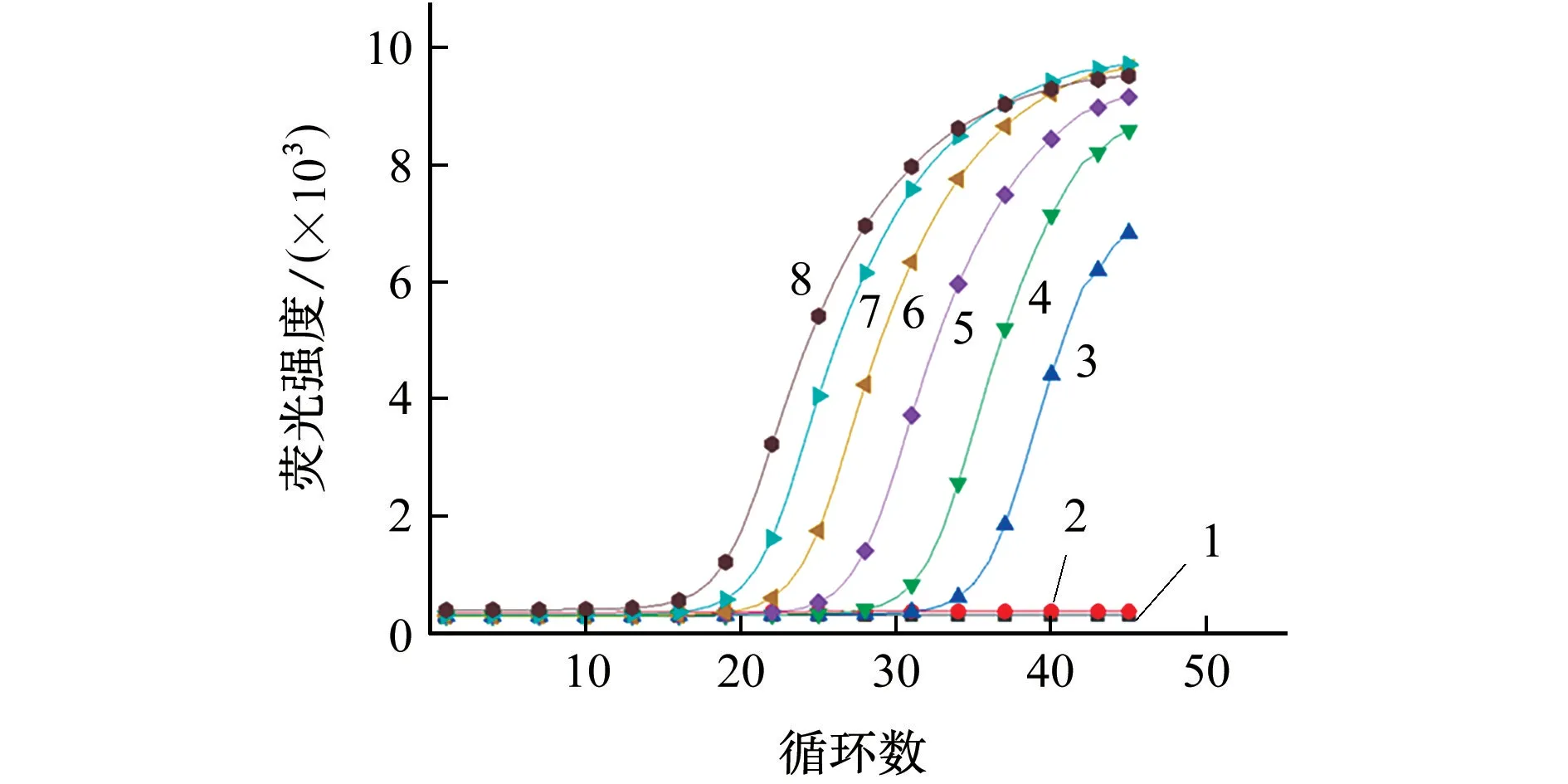
图2 活菌检出限Fig.2 Detection limit of live bacteria
结果显示,蜡样芽孢杆含菌量为8.9×107,8.9×106,8.9×105,8.9×104,8.9×103,8.9×102CFU·mL-1时均有扩增曲线,低于8.98×102CFU·mL-1时无扩增曲线,表明活菌检出限为8.9×102CFU·mL-1。
2.4 样本分析
豆腐、米饭、鲜面条、米粉、炒饭、大米、甜酒、肉、土豆、红薯、生菜、空心菜等12个样本,经过增菌培养后分别提取基因组DNA,以蜡样芽孢杆菌菌株活化后提取DNA作为对照,采用建立的方法进行实时荧光PCR试验,各样本的Ct值(从基线到指数增长的拐点所对应的循环次数)见表2。其中,Ct值小于42,表示检出蜡样芽孢杆菌。

表2 各样本的Ct值Tab.2 Ct value of each sample
结果表明:鲜面条的Ct值为15.61,说明鲜面条样本中蜡样芽孢杆菌含量高,反映出蜡样芽孢杆菌在潮湿的环境中容易增长;其次,大米的Ct值为19.35,说明大米中含有一定量的蜡样芽孢杆菌;甜酒的Ct值最大,为40.25,说明甜酒灭菌不完全,存在少量蜡样芽孢杆菌污染;其余样本的Ct值在20.00~34.00内。综合上述数据说明,该市场中销售的产品存在一定蜡样芽孢杆菌的污染,检出率为100%。
本工作采用实时荧光PCR检测技术,以分段扩增方式检测食品中的蜡样芽孢杆菌,可在12~14 h内完成,蜡样芽孢杆菌DNA灵敏度可达到0.01 mg·L-1,活菌检出限为8.9×102CFU·mL-1,与文献[2]检测肉制品中蜡样芽孢杆菌结果相似,并且该方法适用于大批量样品中蜡样芽孢杆菌的快速筛查检测,具有较好的推广应用前景。同时,本方法对餐饮食品及其他淀粉含量高的食品、乳制品等中蜡样芽孢杆菌的筛查检测,也具有较高的实用推广价值。

