牛蒡子苷P(VDF-TrFE)复合膜对骨髓间充质干细胞成骨分化的影响*
程鸣威, 朱培君, 杨烁, 陈家豪, 罗柯, 刘倩, 徐淑兰
南方医科大学口腔医院种植中心(广东广州 510280)
在口腔种植领域,引导骨再生是常用的骨增量手术之一,其中屏障膜与细胞的相互作用非常重要,理想的膜材料不只是被动的给细胞提供生长环境,更应该积极的促进细胞间信号传递,使细胞更好地行使生物功能[1-2]。人体组织与生物电有着密切关系,天然骨和骨膜中存在生理电位(-10~-90 mV),已有研究表明,成骨细胞会对电信号产生回应[3],据此,本课题组前期设计出电活性P(VDF-TrFE)生物膜,通过极化处理,使得该电活性多聚物表面带有电荷,将电信号直接传递给细胞,从而影响细胞黏附,增殖与分化。牛蒡子苷元(Arctigenin, ARG)是从中医药牛蒡子中提取的木质素类化合物[4]。多项研究表明其具有抗炎,抗氧化,抗肿瘤以及促进成骨的作用[5-7],已有研究证实牛蒡子苷元抑制RANKL诱导的破骨细胞生成和羟基磷灰石再吸收[8]。而对于骨质疏松患者,牛蒡子苷元能够通过PI3K/Akt/PPARγ通路调节骨再生[9]。本课题组前期研究发现电活性P(VDF-TrFE)产生的微电环境能够有效促进骨再生,2021年5月至2022年5月在本研究中,将进一步探索牛蒡子苷复合电活性P(VDF-TrFE)薄膜对大鼠骨髓间充质干细胞成骨分化的影响。
1 材料与方法
1.1 材料 大鼠骨髓间充质干细胞(ATCC);P(VDF-TrFE)粉末(法国阿克玛公司);N,N-二甲基甲酰胺(上海阿拉丁试剂有限公司);DMEM/F12培养基(Gibco,美国);DMSO(北京索莱宝);MTT试剂盒(上海碧云天生物科技有限公司);ALP试剂盒(上海碧云天生物科技有限公司);BCA蛋白测定试剂盒 (上海贝博生物科技有限公司);茜素红染液(上海赛业生物);氯化十六烷基吡啶(上海远慕生物); 扫描电子显微镜观察表面形貌(JSM6300,JEOL,Peabody,MA,USA);电热鼓风箱(GZ-140 上海博迅医疗生物仪器股份有限公司)。
1.2 牛蒡子苷P(VDF-TrFE)复合膜制备 按照前期研究实验方法制备P(VDF-TrFE)膜[10],在高温下对P(VDF-TrFE)膜进行油隅极化处理,电压设置为6 kV/cm,加压速率为100 V/min,120℃高温极化1 h。将牛蒡子苷元粉末溶解于DMSO中,使用无水乙醇配置成4个工作浓度(2.5、5、10、20 μmol/L),调整溶液pH为7.4。分为5组,对照组浸泡于无水乙醇,其余4组浸渍于不同浓度的牛蒡子苷元溶液中作为处理组,设置温度为37℃,使得牛蒡子苷元吸附在P(VDF-TrFE)膜表面,经过48 h后取出P(VDF-TrFE)膜,在空气下自然干燥,所有样品均经过紫外消毒后备用。
1.3 大鼠骨髓间充质干细胞培养 大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)购自赛业生物公司,BMSCs培养于T25培养瓶中,加入5 mL完全培养基,完全培养基为含10% 胎牛血清和1% 双抗(青霉素/链霉素)的F12/DMEM培养基,在37℃、5% CO2的细胞培养箱中培养,细胞融合至70%~80% 时用0.25% 胰蛋白酶消化传代。使用第3~4代BMSCs,将细胞按照密度为2×104个/孔分别种植在不同组别的牛蒡子苷P(VDF-TrFE)复合膜上。
1.4 牛蒡子苷P(VDF-TrFE)复合膜表面形貌和电学性能分析
1.4.1 扫描电镜分析表面形貌 将牛蒡子苷P(VDF-TrFE)复合膜裁剪成0.5 cm×0.5 cm大小,通过导电胶粘接在样品台上,进行喷金(铂)提高材料的导电性,使用扫描电子显微镜观察表面形貌。
1.4.2 牛蒡子苷元释放行为测定 取一定质量的牛蒡子苷P(VDF-TrFE)复合膜置于鼓风烘箱中做释放处理,温度设置为室温。按照设定的时间间隔,使用万分之一天平来称量纤维膜的质量,记下复合膜质量的变化,结果以失重质量百分比表示。
1.4.3 电学性能表征 使用压电测量仪(ZJ-3AN, IACAS, Beijing, China)测量牛蒡子苷P(VDF-TrFE)复合膜的压电系数(d33)。为了检测电学稳定性,将牛蒡子苷P(VDF-TrFE)复合膜放置在DMEM/F12培养基中浸泡,在第30天时检测d33。
1.5 细胞增殖实验 细胞增殖实验按照CCK8说明书进行操作,BMSCs按照上述说明进行培养,在24、48、72 h时用灭菌PBS冲洗3次,加入含有10% CCK8工作液的完全培养基,在 37℃下孵育 30 min。酶标仪记录450 nm波长下各孔的吸光度,实验重复3次。
1.6 碱性磷酸酶实验 BMSCs按照上述说明进行培养,在3 d时,用灭菌PBS洗涤3次。在碱性磷酸酶染色实验中,使用4% 多聚甲醛固定细胞30 min,然后用碱性磷酸酶染色溶液(Beyotime Biotechnology Inc.)染色30 min。在碱性磷酸酶活性测定实验中,使用BCA试剂盒检测蛋白总量,用适量不含磷酸酶抑制剂的 RIPA 细胞裂解液处理细胞,制备待测液。根据ALP试剂盒说明配置ALP活性测定工作液,并将工作液与待测液混合,用酶标仪测定其在405 nm的吸光度,计算酶活力,结果以U/L表示。
1.7 茜素红实验 BMSCs按照上述说明进行培养,在14 d时,用灭菌PBS洗涤3次。在茜素红染色实验中,使用4%多聚甲醛固定细胞30 min,然后用茜素红染液(Sigma-Aldrich, St. Louis, MO, USA)染色10 min,在显微镜下观察拍照观察。向孔板内加入2 mL 10% 十六烷基吡啶溶液,置于摇床上轻摇1 h,待染色物完全溶解后,取适量溶解液于 562 nm 的波长下测定其吸光度用于茜素红染色定量分析。
1.8 统计学方法 所有实验数据用均值±标准差来表示。使用SPSS 22.0统计软件进行统计分析,统计方法采用单因素方差分析(one-way ANOVA),SNK法进行两两比较,以P<0.05为差异有统计学意义。检验水准α=0.05。
2 结果
2.1 牛蒡子苷P(VDF-TrFE)复合膜物理特征 所有样本在浸泡牛蒡子苷元溶液后均无出现样本损伤,从图1可以看出,SEM结果显示样本表面形貌无明显改变。将浸泡了牛蒡子苷元的P(VDF-TrFE)膜在室温下对牛蒡子苷元释放进行测定, 从表1可以看出,不同浓度的4个组在10 h前均有药物突释行为,在96 h基本释放完全,累积释放率达到90%以上。对牛蒡子苷P(VDF-TrFE)复合膜压电常数的分析表明,浸泡牛蒡子苷元后,材料表面的仍具有良好电学性能,为了测试复合膜的压电稳定性,将其浸入DMEM/F12培养基中30 d,30 d结束时,浸没样品的压电系数d33接近原始d33,见表2。说明牛蒡子苷P(VDF-TrFE)复合膜在体外能够稳定的构建微电环境。
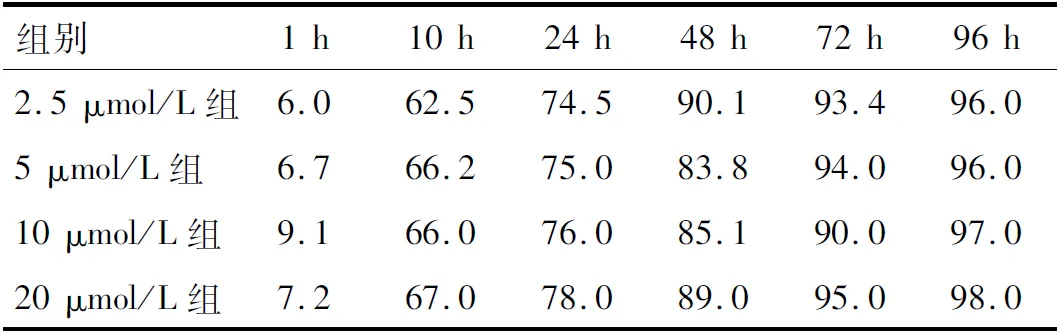
表1 牛蒡子苷P(VDF-TrFE)复合膜释放率 %

表2 牛蒡子苷P(VDF-TrFE)复合膜的压电系数d33

注:A:对照组;B:2.5 μmol/L组
2.2 牛蒡子苷P(VDF-TrFE)复合膜的细胞相容性 实验在不同浓度水平检测了牛蒡子苷P(VDF-TrFE)复合膜对BMSCs增殖的影响,CCK8结果显示(图2)牛蒡子苷P(VDF-TrFE)复合膜呈现出浓度依赖的细胞增殖抑制,与对照组相比,在浓度为20 μmol/L时呈现出明显的细胞毒性。
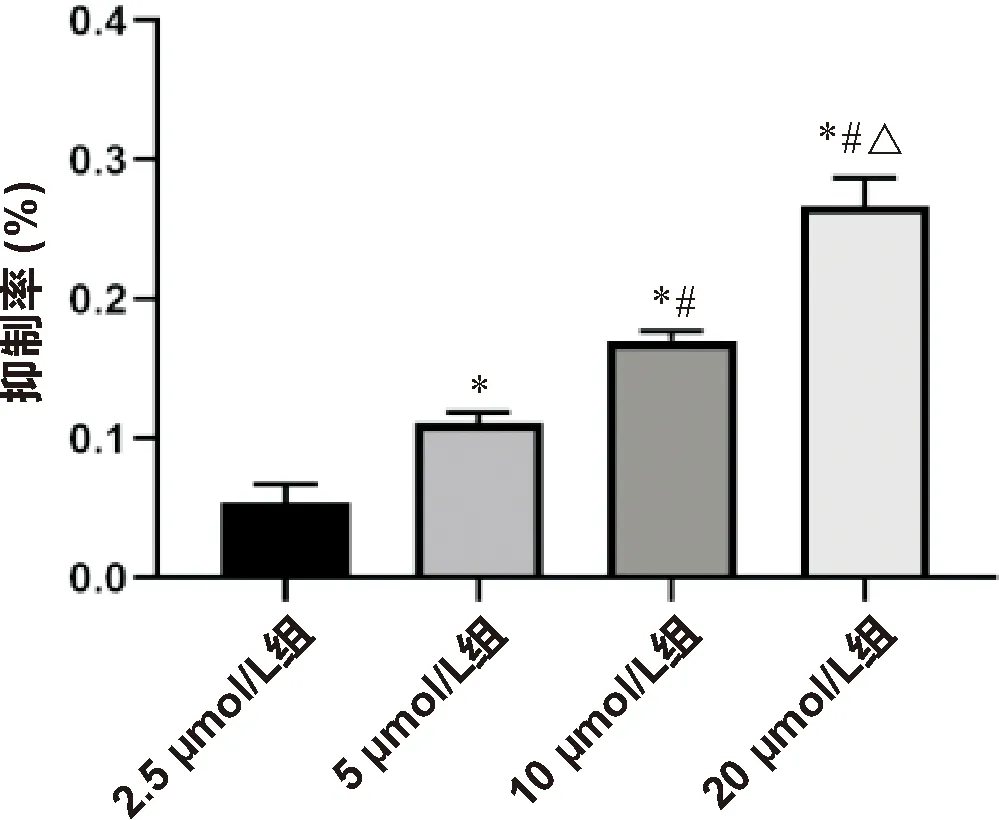
注:*与2.5 μmol/L组比较 P<0.05;#与5 μmol/L组比较 P<0.05;△与10 μmol/L组比较 P<0.05
2.3 牛蒡子苷P(VDF-TrFE)复合膜促进骨髓间充质干细胞成骨分化的效能 骨髓间充质干细胞成骨分化的效能通过ALP和茜素红染色实验表征。碱性磷酸酶染色实验结果显示(图3),在3 d时,5组复合膜表面均出现深染蓝色物质,说明均有碱性磷酸酶形成。碱性磷酸酶定量结果显示(图4),牛蒡子苷元处理组的早期成骨分化效能均优于对照组,在浓度为10 μmol/L时拥有最佳的早期成骨效能。

注:A:对照组;B:2.5 μmol/L组;C:5 μmol/L组;D:10 μmol/L组;E:20 μmol/L组
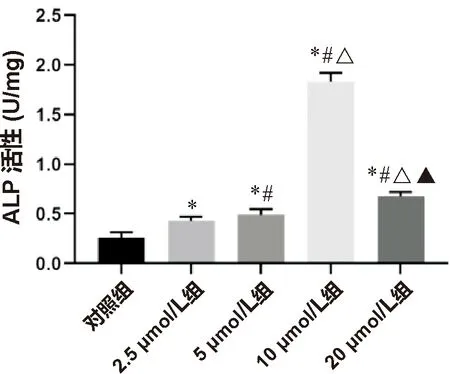
注:*与对照组比较 P<0.05;#与2.5 μmol/L组比较 P<0.05;△与5 μmol/L组比较 P<0.05;▲与10 μmol/L组比较 P<0.05
茜素红染色结果显示(图5),在14 d时,5组复合膜表面均出现红褐色矿化结节,说明有钙磷物质沉积到细胞外基质中,但茜素红定量结果显示(图6),相比对照组,处理组不会促进BMSCs矿化结节生成。从细胞增殖实验和成骨分化实验结果来看,牛蒡子苷元浓度为10 μmol/L时,牛蒡子苷元P(VDF-TrFE)复合膜用有最佳的成骨效能。

注:A:对照组;B:2.5 μmol/L组;C:5 μmol/L组;D:10 μmol/L组;E:20 μmol/L组

图6 茜素红定量检测
3 讨论
骨改建是一个高度受控的过程,成骨细胞分泌细胞外基质促进骨形成,破骨细胞降解细胞外基质引起骨吸收。BMSCs定向迁移到损伤部位,分化为成骨细胞以及分泌生长因子,促进受损骨组织的再生[11]。中医药作为促进成骨分化的新思路近年来获得广泛关注,研究表明蛤蚧、补骨脂、淫羊藿、鹿茸等单味药能够有效促进成骨,治疗骨质疏松,改善骨密度[12-15]。牛蒡子苷元提取自天然中药牛蒡子,初期被用于抗炎、抗肿瘤以及免疫调节,最近有研究表明牛蒡子苷元能够抑制破骨细胞分化从而治疗骨质疏松[8, 16],但是对牛蒡子苷元促进成骨细胞或BMSCs成骨分化的研究尚且较少。P(VDF-TrFE)因其具有良好的生物相容性,而被誉为适合生物医学应用的仿生电活性材料,相关研究表明P(VDF-TrFE)膜极化后表面带有电荷,能仿生生物体内的微电环境,从而提高成骨细胞的生物学活性[17]。此薄膜的设计规避了外源性电信号装置易诱发感染的风险,提高了仿生电活性材料的生物效应及生物安全性,本课题组前期研究表明极化P(VDF-TrFE)通过免疫调节促进BMSCs成骨分化[10]。因此,本研究进一步将牛蒡子苷元负载在极化P(VDF-TrFE)薄膜上,研究其促成骨效能。
本研究采用浸泡的方式进行药物负载,极化P(VDF-TrFE)膜浸泡了不同浓度牛蒡子苷元后仍然具有稳定的电学能力以及均匀的表面形貌,牛蒡子苷元释放行为检测结果显示不同浓度的4个组在10 h前均有突释行为,释放量达到60%以上,而在96 h基本释放完全,累积释放率达到90%以上。浸泡是较为常用的一种方式,但是存在释放时间过短,前期突释效应显著等问题。药物控制释放能够在生物体内以可预测的方式完成较长时间的药物释放,目前包括纳米控释系统,水凝胶药物释放体系、微球控释体系以及电仿纤维控释体系[18]。有研究表明,静电纺丝可以制备压电材料并且具有生物活性[19],因此在载中药电活性生物材料中,静电纺丝是一种具有前景的制备工艺。
在本实验中,牛蒡子苷P(VDF-TrFE)复合膜呈现出浓度依赖的细胞增殖抑制,在浓度为20 μmol/L时呈现出明显的细胞毒性。Li等[9]的研究发现牛蒡子苷元浓度为10 μmol/L以下时不具有细胞毒性,这与本实验的研究结果一致。牛蒡子苷P(VDF-TrFE)复合膜在早期促进了ALP表达。实验结果显示牛蒡子苷元处理组的早期成骨分化效能均优于对照组,同样呈现出浓度依赖性,高浓度组(20 μmol/L)的碱性磷酸酶活性不如10 μmol/L组,这可能与细胞毒性有关。而对照组的促成骨效能则可能来自于极化P(VDF-TrFE)薄膜为BMSCs提供的微电环境。生物矿化从无定型的钙磷沉积开始,无定型钙磷沉积到胶原纤维形成的框架中,随后矿物质成核、生长,形成钙结节,茜素红通过与钙结节中的钙离子反应形成红褐色化合物,能够反映细胞晚期成骨分化能力。实验结果显示对照组和处理组均有少量矿化结节形成,但是其差异无统计学意义。结合牛蒡子苷元释放实验,本课题组推测由于药物释放时间过短从而影响了牛蒡子苷P(VDF-TrFE)复合膜的晚期促成骨分化能力。
综上所述,本研究在细胞水平探讨了不同浓度牛蒡子苷元复合P(VDF-TrFE)生物膜促进BMSCs成骨分化的能力,结果显示极化P(VDF-TrFE)所创改造的微电环境能够为细胞成骨分化提供良好的环境,同时牛蒡子苷P(VDF-TrFE)复合膜能更进一步促进早期成骨,且在一定浓度范围内其成骨作用于药物浓度呈正相关,而高浓度牛蒡子苷P(VDF-TrFE)复合膜则会产生细胞毒性,减弱其促成骨效能。目前的载药方式尚不足以达到药物控释的效果,牛蒡子苷P(VDF-TrFE)复合膜只能在成骨早期释释放药物,如何能够提高牛蒡子苷元溶解度和生物利用度,使药物持续作用于成骨分化的整个过程,仍需要进一步研究。
利益相关声明:所有作者声明不存在任何利益冲突。
作者贡献说明:徐淑兰进行了实验设计,朱培君和杨烁构建了牛蒡子苷P(VDF-TrFE)复合膜并进行了材料分析。罗轲和刘倩进行了细胞实验,程鸣威统计数据并撰写论文。

