长沙臭豆腐卤水发酵过程特征风味物质及其关联菌群分析
唐 辉,陈 霖,康林芝,李 跑,钟瑞敏,刘国凌,蒋立文,3,*
(1.韶关学院英东食品学院,广东 韶关 512005;2.湖南农业大学食品科学技术学院,湖南 长沙 400128;3.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
“食臭”自古有之,虽然其气味不甚友好,但因独特的风味、浓厚的地域特色和深厚的文化底蕴,彰显着其存在的价值。中国的臭豆腐、法国的臭奶酪、韩国的鳐鱼片、日本的咸圆鯵鱼干和纳豆、瑞典的鲱鱼罐头等都以其独特的风味享誉世界[1]。以秦岭淮河为界,臭豆腐可分为北方发酵型和南方半发酵型。长沙臭豆腐“闻起来臭、吃起来香”,是南方半发酵型臭豆腐代表之一,主要工艺是将豆腐坯浸入发酵卤水一段时间,油炸后拌佐料供人们休闲食用,其加工和风味来源关键在于发酵卤水[2]。卤水制作多沿用传统敞口式发酵,风味品质不稳定。目前关于卤水的研究主要集中在挥发性风味物质和微生物多样性等方面。挥发性风味物质的研究,一方面是其分析方法的优选,李里[3]比较了固相微萃取(solid phase micro-extraction,SPME)、溶剂萃取法、同时蒸馏萃取法的提取效果,结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)检测,发现SPME能提取到臭豆腐及其卤水更多挥发性成分。Tang Hui等[4]采用顶空-SPME-GC-MS(headspace SPME-GCMS,HS-SPME-GC-MS)方法对不同品牌的长沙臭豆腐卤水中挥发性风味物质进行研究,系统优化了SPME萃取纤维种类、平衡时间、萃取温度、萃取时间和不同极性色谱柱等提取和分析条件。另一方面是卤水挥发性成分定性和定量研究,郑小芬等[5]比较了深色和浅色2种卤水的挥发性成分,结果发现,深色卤水中主要挥发性风味物质有38种,以酯类、醇类和酸类为主,酯类的含量最高,乙酸丙酯、乙酸丁酯的含量达到10%以上;浅色卤水中主要挥发性风味物质有42种,以杂环类化合物、含硫化合物、烷烃类物质为主,杂环类化合物的含量最高,间甲基苯酚含量达到37.92%。贺静[6]对不同发酵阶段卤水的挥发性成分进行研究,发现仅在卤水发酵初期检测出酸类物质,酮类、醇类、醛类、酚类、烷类、烯类、酯类等物质在发酵初、中、晚3个时期都存在,但种类和含量在不同时期有不同变化,3-甲基吲哚是贯穿整个发酵过程的物质。Tang Hui等[4]发现对甲基苯酚、苯酚、3-甲基吲哚、吲哚、乙酸、丙酸、异丁酸、丁酸和3-甲基丁酸等成分是不同品牌长沙卤水共有的气味贡献物质。关于臭豆腐卤水中微生物的研究,目前主要采用传统纯培养技术[7]、16S rRNA[8]和454焦磷酸[9]等高通量测序技术,结果发现乳酸菌较高频的被分离检测到[7],浙江臭豆腐卤水中的主要优势菌群为普雷沃菌属、乳杆菌属、盐单胞菌属和克里斯滕森氏菌属[8],长沙臭豆腐卤水中主要优势菌有厌氧球菌属、卟啉单胞菌属和氨基杆菌属等[9]。
相关学者对卤水中挥发性风味物质的分析方法、定性和定量分析、微生物的多样性等方面做了大量研究,但卤水发酵过程中的特征风味成分和优势菌群的变化及其相关性方面的研究却鲜有报道,明确卤水中特征风味物质的关联菌群,对促进长沙臭豆腐风味品质的稳定具有重要的意义。
鸟枪法宏基因组学等高通量测序技术克服了以往研究手段的局限性,以环境样品中的微生物群体全基因组为研究对象,用于分析微生物群落的分类组成和功能潜力,鉴定到微生物的种、株水平,能更全面准确地监测环境样本中微生物群落结构情况[10],因此被广泛应用于奶酪[11-12]、酱油[13]、酸菜[14]、食醋[15]等发酵食品中。Escobar-Zepeda等[12]利用鸟枪法宏基因组学揭示了Cotija奶酪中独特的微生物群落结构,并成功检测出与Cotija奶酪多种风味形成有关的微生物。本实验以豆腐、冬笋、梅干菜、香菇等原料为基质发酵长沙臭豆腐卤水,利用HS-SPME-GC-MS、内标定量法结合香气活性值(odor activity value,OAV)跟踪卤水发酵过程中挥发性成分、特征风味物质及其动态变化情况,在此基础上,采用鸟枪法宏基因组学探究不同发酵时期卤水的优势菌群,通过Pearson相关系数分析卤水中优势菌群与特征风味成分之间的相关性,寻找卤水中风味关联菌,以期为稳定长沙臭豆腐风味品质,促进其现代化生产提供理论和应用基础。
1 材料与方法
1.1 材料与试剂
冬笋、梅干菜、香菇、豆腐花、豆豉、盐、食用纯碱湖南农业大学农贸市场;C7~C30正构烷烃混合标准品、邻二氯苯标准品(99.99%) 美国Supelco公司;D4015-02型E.Z.N.A.®Stool DNA Kit、Ambion试剂盒、AM9932型Nuclease-free Water试剂盒、FC-121-4001型TruSeq Nano DNA LT Library Preparation Kit-Set A试剂盒美国Omega公司;琼脂糖 西班牙Biowest公司;甲醇、乙醇、甲醛、氢氧化钠、邻苯二甲酸氢钾、酚酞(均为分析纯) 国药集团上海化学试剂有限公司。
1.2 仪器与设备
GC-MS-QP2010 GC-MS联用仪 日本岛津公司;CD-WAX极性色谱柱 上海安谱科学仪器有限公司;85 μm Polyacrylate萃取纤维 美国Supelco公司;HiSeq4000高通量测序平台 美国Illumina公司;Power Pac 3000型琼脂糖凝胶电泳仪、Gel Doc XR+型凝胶成像仪 美国Biorad公司;LONG GENE MG96型梯度PCR仪 中国杭州朗基科学仪器有限公司;Allegra 6R型冷冻离心机 德国贝克曼公司;Q32857型核酸蛋白检测仪 美国Invitrogen公司;UCD-200超声波破碎仪比利时Diagenode公司。
1.3 方法
1.3.1 长沙臭豆腐卤水生产工艺流程
长沙臭豆腐卤水工艺流程见图1。
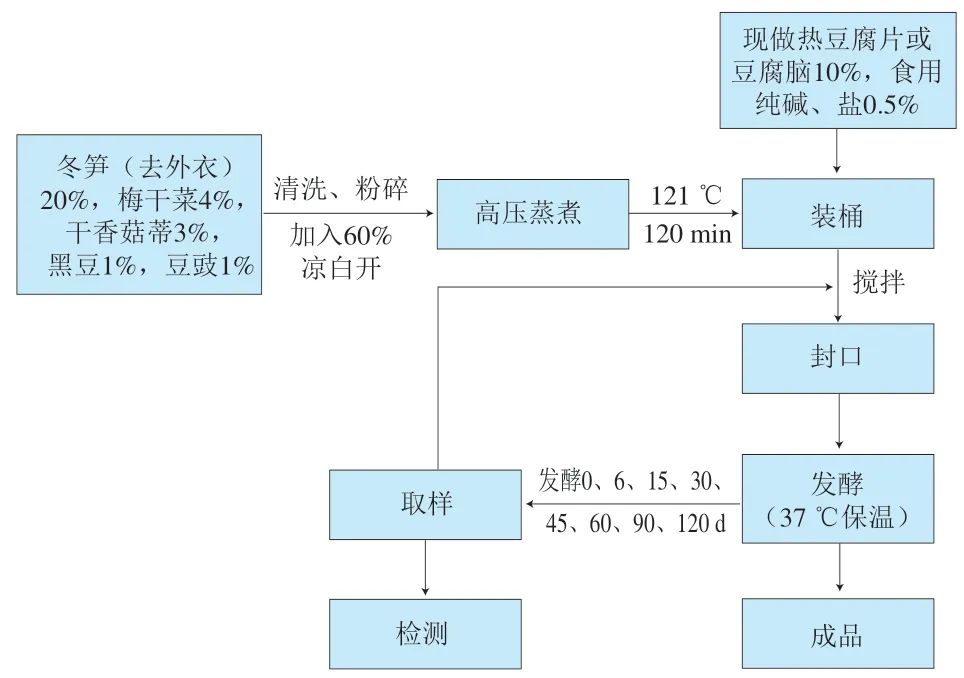
图1 长沙臭豆腐卤水工艺流程Fig. 1 Flow chart for the production process of Changsha stinky tofu brine
工艺说明:按比例称取冬笋(去除外衣)、梅干菜、干香菇蒂、黑豆、豆豉等原料,清洗后用粉碎机粉碎,加入凉白开水,在高压灭菌锅中121 ℃蒸煮灭菌120 min,冷却后按比例加入豆腐花、食用纯碱、盐,搅拌均匀后分装入9个10 L的发酵罐中,封口,在37 ℃的培养箱中保温发酵,定时取样。其中,每3个桶为一个平行样,9个发酵罐为3个平行样,当样品发酵至0、6、15、30、45、60、90、120 d每个平行样分别取1 kg左右,放入-80 ℃冰箱,待用。每次取样前后均需将样品搅拌均匀,取样后样品需封口,待下次取样时再开启搅拌。
1.3.2 长沙臭豆腐卤水理化指标的测定
pH值:采用pH计,每个样品平行测定3次。氨基酸态氮的测定:参照GB 5009.235—2016《食品中氨基酸态氮的测定》酸度计法[16],每个样品平行测定3次。
1.3.3 长沙臭豆腐卤水挥发性风味物质的检测
分别取发酵0、6、15、30、45、60、90、120 d卤水各2.0 mL于固相微萃取顶空瓶中,添加5 μL内标稀释液(取15 μL邻二氯苯于250 mL棕色容量瓶中,用甲醇定容至刻度),再分别进行HP-SPME萃取和GC-MS测定。萃取和测定条件参考文献[17],每个样品平行测定3次。
总离子流色谱图经NIST2014s标准谱库检索定性鉴定出成分,并结合计算保留指数(retention index,RI)共同确定化合物。RI按式(1)计算:
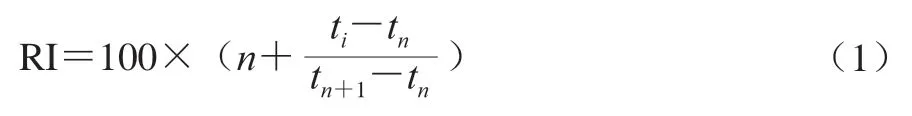
式中:n为碳数;ti为待测挥发性成分的保留时间/min;tn为具有n个碳原子正构烷烃的保留时间/min;tn+1为具有n+1个碳原子正构烷烃的保留时间/min。
将计算的RI与数据库(http://webbook.nist.gov/chemistry/cas-ser.html)中参考RI进行比较,相近者则为同一种物质。
采用内标法定量长沙臭豆腐卤水中挥发性风味物质的绝对含量,按式(2)计算:

式中:C1为待检化合物的质量浓度/(μg/mL);C0为加入内标化合物的质量浓度/(μg/mL);A1为待检化合物的峰面积;A0为加入内标化合物的峰面积;V1为每次萃取卤水样品的体积(2.0 mL);V0为加入内标化合物的体积(5 μL)。
OAV按式(3)计算:

式中:Ci为某挥发性风味物质的质量浓度/(μg/mL);OTi为某挥发性风味物质的气味阈值/(μg/mL)。
当OAV≥1时,认为该风味物质是关键的风味化合物,对样品风味具有重要贡献,OAV越大,风味贡献度就越大;当0.1≤OAV<1时,认为该风味物质对样品风味有一定的贡献;OAV<0.1时,认为该风味物质对整体风味影响不大。
1.3.4 微生物鸟枪法宏基因组测序分析
依据卤水发酵过程中挥发性风味物质和特征风味成分变化的关键时间点,分别取发酵0、15、30、45、60 d(记为stb0、stb15、stb30、stb45、stb60)的卤水样品,每个关键时间点取样重复3次,采用E.Z.N.A.®Stool DNA Kit试剂盒提取各卤水样品中微生物总DNA,选取样品DNA电泳条带较好,无明显降解,OD260/OD280值在1.8~2.0之间的DNA送杭州联川生物技术股份有限公司测序平台进行高通量测序,测序模式为PE150。
下机后的原始数据采用FastQ files(version 1.33)软件(https://github.com/najoshi/sickle)进行预处理,参考文献进行基因组装[18]、CDS预测[19]、去冗余基因[20]等信息处理,获得最终用于后续分析的Unigenes[21]。将Unigenes与NR_meta库(根据NR数据总库对微生物数据库进行构建后的子库http://blast.ncbi.nlm.nih.gov/)和KEGG功能数据库(http://www.kegg.jp/kegg/pathway)进行比对,获得各层级的物种分类和功能信息。
1.3.5 相关性分析
根据长沙臭豆腐卤水中特征风味物质和菌群结构的变化情况,采用Pearson相关系数分析卤水中优势菌群与特征挥发性风味成分之间的相关性。
1.4 数据处理软件
采用Excel 2007、Visio 2007、R 3.6.3、Matelab 7.0软件进行实验数据分析和处理;宏基因组原始数据已上传https://submit.ncbi.nlm.nih.gov/subs/sra/(查询号PRJNA731658)。
2 结果与分析
2.1 长沙臭豆腐卤水发酵过程中理化指标的变化情况
如图2所示,卤水pH值先降后升,在发酵第6天降到最低,发酵60 d左右趋于稳定。这主要是因为发酵前期,糖类、脂肪和蛋白质等物质在微生物的代谢下产酸,卤水的pH值急速下降,于发酵第6天降到最低。随着发酵时间的推移,微生物此消彼长,一些产碱微生物的复苏和繁殖,糖类、脂肪和蛋白质不断分解代谢出碱性物质,导致pH值升高,发酵60 d左右时,体系pH值趋于稳定,这与贺静[6]和李雨枫等[22]的研究结果一致。
卤水发酵过程中氨基酸态氮含量先升后降,在发酵第45天升到最高,随后下降,至发酵60 d左右趋于稳定。发酵0~45 d时,微生物利用蛋白酶系降解原料中的蛋白质产生大量游离氨基酸,卤水中的氨基酸态氮含量逐渐升高。发酵45 d后,氨基酸态氮逐渐下降,这可能一方面是微生物生长繁殖对游离氨基酸的必需消耗所引起,另一方面是由于Strecker降解反应将游离氨基酸降解为挥发性的醛、酚、醇等风味物质[23]导致卤水体系中氨基酸态氮含量下降。这个结果与酸菜[24]和燕麦[25]等发酵食品发酵过程中氨基酸态氮的变化趋势相同。
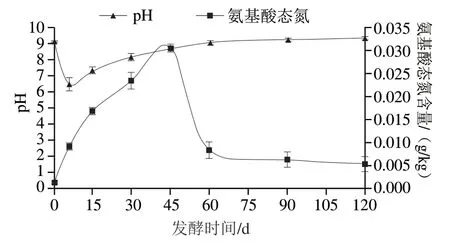
图2 卤水发酵过程pH值和氨基酸态氮的变化Fig. 2 Changes in pH and amino acid nitrogen content of stinky tofu brine during fermentation
2.2 长沙臭豆腐卤水发酵过程中挥发性风味物质和特征风味物质的变化情况
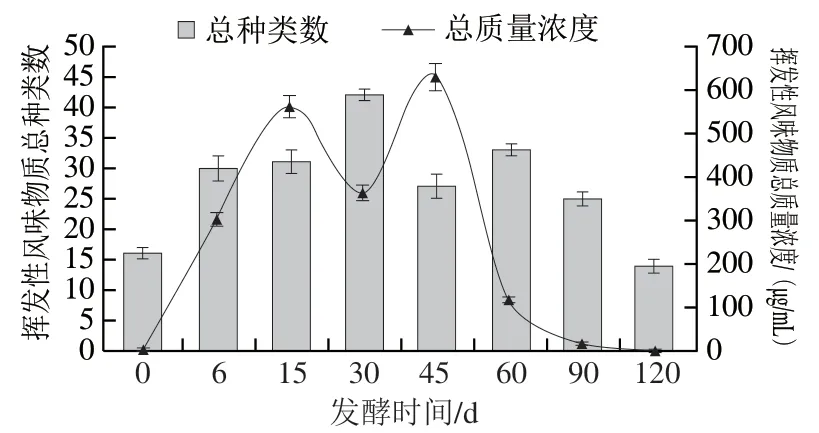
图3 卤水发酵过程挥发性风味物质总种类和总含量的变化Fig. 3 Changes in the total number and amount of volatile components in stinky tofu brine during fermentation
如图3所示,卤水发酵过程共鉴定到75种挥发性风味物质,其中,醇类22种、酸类8种、醛类2种、酮类9种、酯类18种、醚类3种、苯酚类4种、吲哚类2种和其他类7种。发酵0、6、15、30、45、60、90、120 d卤水中挥发性风味物质总种类分别为16、30、31、42、27、33、25、14种,在发酵第30天出现高峰;总质量浓度分别为3.01、305.42、562.05、365.8、629.56、120.62、21.87、2.49 μg/mL,在发酵第15、45天出现2个高峰(562.05 μg/mL和629.56 μg/mL)。综合pH值的变化趋势,推测发酵0~15 d,卤水中一些产酸菌大量繁殖,促使氨基酸、挥发性脂肪酸等代谢产物、风味前体物质和风味物质产生,导致挥发性风味物质总量在第15天左右出现第1个高峰;随着发酵时间继续延长,pH值逐渐升高,菌群结构发生较大变化,氨基酸、脂肪酸、糖类等风味前体物质在微生物和酶的作用下经过一系列生化反应,进一步产生大量的酚、醇、醛、酮、酯等风味物质,使总量在第45天左右出现第2个高峰。
由图4a可知,苯酚和吲哚类物质种类较稳定(苯酚有3~4种,吲哚有2种),且含量很高,但含量在发酵过程中的变化较大,呈先升后降,再升再降的变化趋势,且两者都在发酵第15、45天出现峰值。其中,苯酚类物质在第45天,出现最高峰值(428.32 μg/mL),吲哚类物质在发酵第15天出现最高峰值(244.19 μg/mL)。由图4b可知,醇、酸、酯类物质种类和含量较高,变化较大,都呈先升后降的变化趋势,其中,醇类在发酵第30天达最高种类(15种),酯类的种类在发酵第6、30天(12种)达到2个高峰期,酸类在发酵第15天达到最高种类(6种),三者的含量均在发酵第6天,达到较高水平。由图4c可知,醛、酮和醚类物质种类较少,含量也较低,整个发酵过程较为稳定。
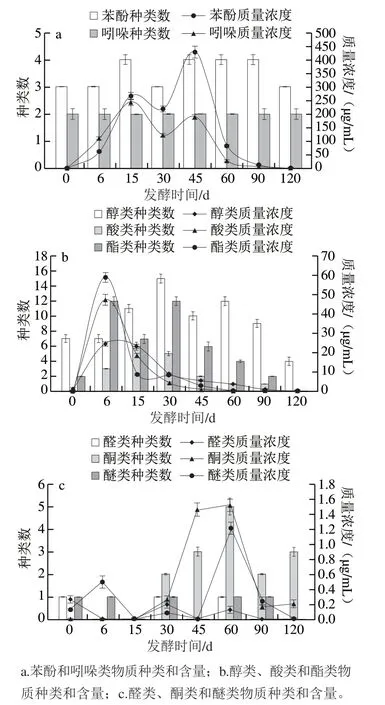
图4 卤水发酵过程各种挥发性成分含量和种类的变化Fig. 4 Changes in the number and amount of phenols and indoles (a),alcohols, acids and esters (b), and aldehyde, ketones and ethers (c) in stinky tofu brine during fermentation
如表1所示(仅列出不同发酵阶段卤水中OAV不小于1的19种特征风味物质,其余56种物质在各阶段卤水中OAV均小于1,因此未列出),发酵0、6、15、30、45、60、90、120 d的卤水中挥发性风味物质OAV不小于1的分别有3、9、13、11、9、10、3、3种,新鲜卤水原料中(发酵0 d)1-辛烯-3-醇的OAV较高(220),是其主要的特征风味物质,呈蘑菇和蔬菜香[26];在卤水发酵过程中(发酵6~120 d)OAV较高的特征风味物质主要有苯酚、对甲基苯酚、吲哚和3-甲基吲哚等。苯酚和对甲基苯酚呈先升后降的变化趋势,苯酚质量浓度在0.39~89.96 μg/mL之间,OAV在0.07~15.25之间,发酵第15天出现峰值;对甲基苯酚质量浓度在0.19~389.62 μg/mL之间,OAV在3.45~7 084.00之间,发酵第45天出现峰值。苯酚和对甲基苯酚在长期发酵的“臭味”食品中经常出现[4,27],呈酚醛、窖泥等特殊风味[27],LD50分别为530 μg/mg和1 800 μg/mg(大鼠,经口),GB 2760—2014《食品添加剂使用标准》中规定两者作为香料均可安全用于食品。卤水中苯酚和对甲基苯酚浓度虽偏高,但远低于其LD50值,且卤水不直接食用,只作为长沙臭豆腐的浸泡原料,其中的苯酚和对甲基苯酚经传递和高温油炸后(长沙臭豆腐需油炸后食用),大量挥发,浓度大幅度下降,因此不存在安全危害,且一定量的苯酚和对甲基苯酚赋予了长沙臭豆腐特殊的风味。有研究表明,苯酚和对甲基苯酚是肠道中细菌降解酪氨酸的代谢产物,一些肠道微生物可代谢酪氨酸产苯酚或(和)对甲基苯酚,如梭菌属、芽孢杆菌属、乳酸菌等[27]。吲哚和3-甲基吲哚也是卤水发酵过程中主要的特征风味物质,其中,吲哚的质量浓度较高,在1.14~242.97 μg/mL之间,OAV在8.14~1 735.50之间,在发酵第15天出现最高值;3-甲基吲哚质量浓度虽不高,在0.14~3.00 μg/mL之间,但阈值极低,风味强烈,OAV在23.33~500.00之间,在发酵第45天出现最高值。吲哚LD50为1 000 μg/mg(大鼠,经口),3-甲基吲哚无毒性,具有一定刺激性,两者都是GB 2760—2014中规定允许使用的食品用合成香料,呈粪便臭味,但低浓度时具有特殊芳香气味[26]。卤水中的吲哚和3-甲基吲哚经传递和高温油炸后,浓度大幅度下降,亦赋予了长沙臭豆腐特殊的风味。据报道,吲哚和3-甲基吲哚的产生与原料中色氨酸的代谢有关,目前发现只有一些肠道细菌,包括粪肠球菌(Enterococcus faecalis)、嗜热共生菌(Symbiobacterium thermophilum)、芽孢菌(Bacillussp.)等[28-29]细菌可以代谢色氨酸产生吲哚。臭豆腐卤水中的主要原料有豆腐、冬笋、梅干菜、香菇等,含有丰富的酪氨酸、苯丙氨酸和色氨酸等,为臭豆腐卤水主要特征风味的形成提供了物质基础。
另外,卤水发酵过程中还含有一些不断变化的醇、酸、醛、酯、胺等特征风味物质,它们在不同发酵阶段卤水中的OAV均不小于1,具有一定的贡献度,主要有丁酸、3-甲基丁酸、4-乙基苯酚、三甲胺等物质强化了发酵6~60 d卤水的主体臭味,赋予了其酸臭和腥臭味[26]。异戊醇、2-庚醇、正己醇、3-辛醇、1-辛烯-3-醇、2-十一醇、苯乙醇、合金欢醇、3-苯丙酸乙酯、丙位十二内酯和壬醛丰富了发酵6~60 d卤水浓郁的蘑菇和蔬菜香、花香、果香、酒香和油脂香等[26]。发酵90 d后,这些香味物质在卤水中逐渐消失。
综上所述,卤水在整个发酵过程中,特征风味物质的种类和含量不断变化,其中,苯酚、对甲基苯酚、吲哚、3-甲基吲哚贯穿卤水整个发酵过程,是其中主要的特征风味物质,亦或是长沙臭豆腐“闻起来臭,吃起来香”的主要原因。丁酸、3-甲基丁酸、4-乙基苯酚、三甲胺是长沙臭豆腐“闻起来臭”的另一原因。异戊醇、2-庚醇、正己醇、3-辛醇、1-辛烯-3-醇、2-十一醇、苯乙醇、合金欢醇、3-苯丙酸乙酯、丙位十二内酯和壬醛等特征风味物质或是长沙臭豆腐“吃起来香”的另一原因。
2.3 长沙臭豆腐卤水发酵过程中菌群结构的变化
2.3.1 臭豆腐卤水微生物群落界水平的组成
通过注释得到不同发酵阶段卤水中微生物在界水平的丰度统计与差异比较,见表2。卤水发酵过程中,界水平各组成的物种差异显著(P<0.01),其中,细菌占绝对优势,平均丰度占比达90%以上。谷静思[8]、贺静[9]等研究发现卤水中微生物主要是细菌,这与本研究结果一致。病毒、古生菌、真核生物在卤水发酵过程中平均丰度占比较低,分别为0.86%、0.08%和0.04%。另外,卤水中还有平均丰度占比8.73%的未知物种,限于数据库物种数以及技术水平,本实验不做深入分析,但随着科学技术的发展和数据库的更新,这些宝贵的生物资源将会越来越多的被认识和利用。
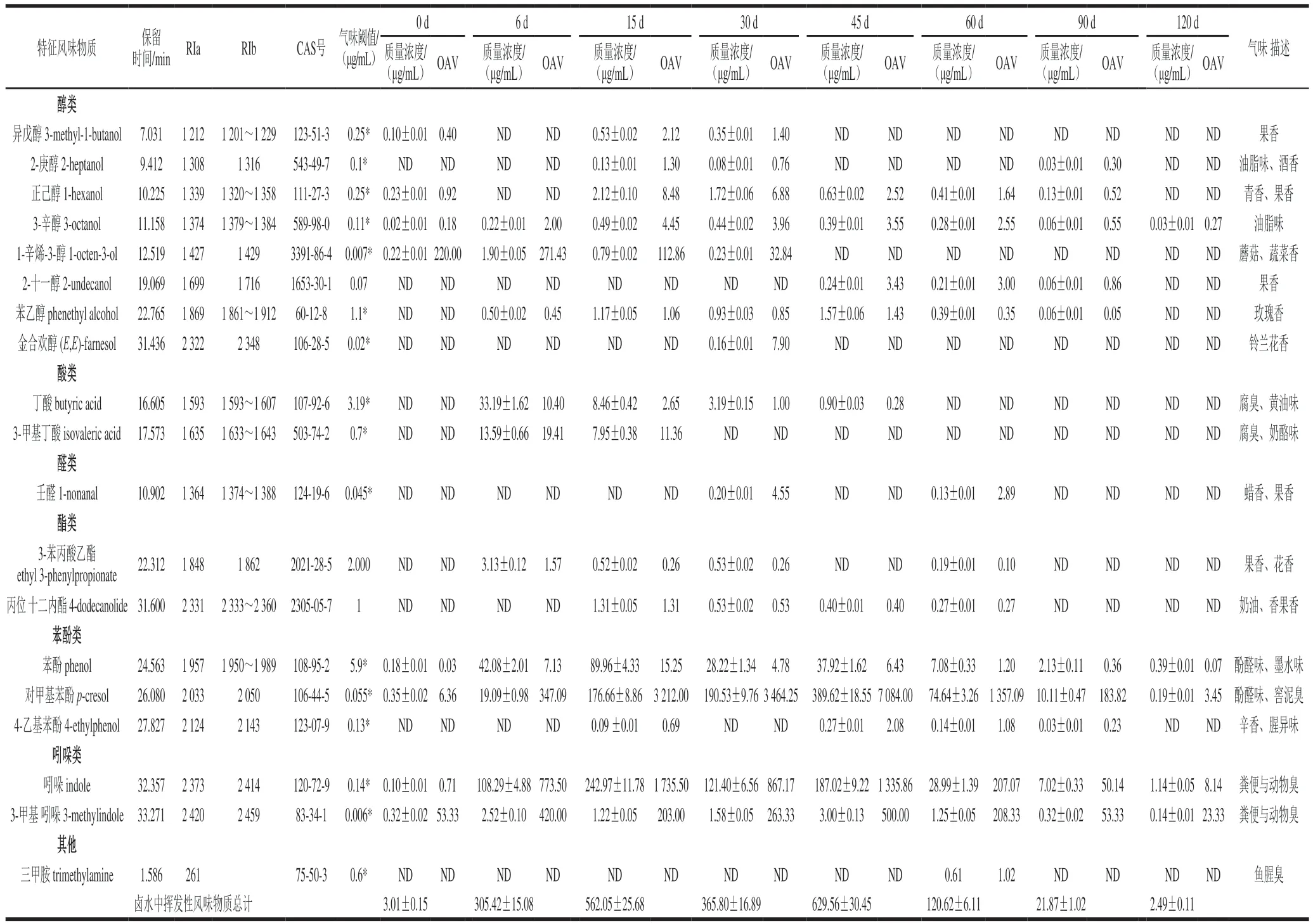
表1 不同发酵时期卤水中特征风味物质含量、OAV与风味特征描述Table 1 Contents, OAVs and flavor characteristics of flavor compounds in stinky tofu brine at different fermentation periods
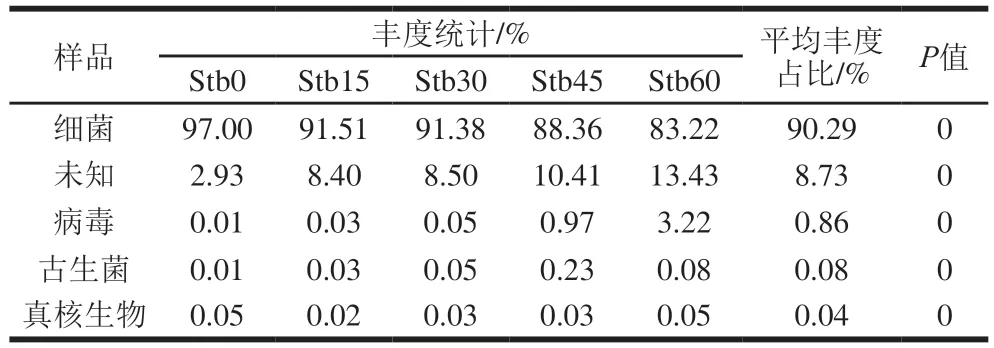
表2 界水平物种丰度统计与差异比较Table 2 Statistics and comparison of microbial abundance at the kingdom level
2.3.2 基于种水平臭豆腐卤水微生物多样性结果
从图5可以看出,基于种水平,发酵卤水5个样本中微生物数目依次为stb45>stb60>stb15>stb30>stb0,共鉴定出8 483种微生物,其中,2 817种微生物在不同发酵阶段的卤水中被检测到,这些菌可能与卤水发酵过程中共同检测到的风味物质形成相关。有42、234、10、32、87种微生物分别为stb0、stb15、stb30、stb45、stb60独有,这些微生物可能与卤水在不同发酵阶段的独特代谢产物的形成相关。
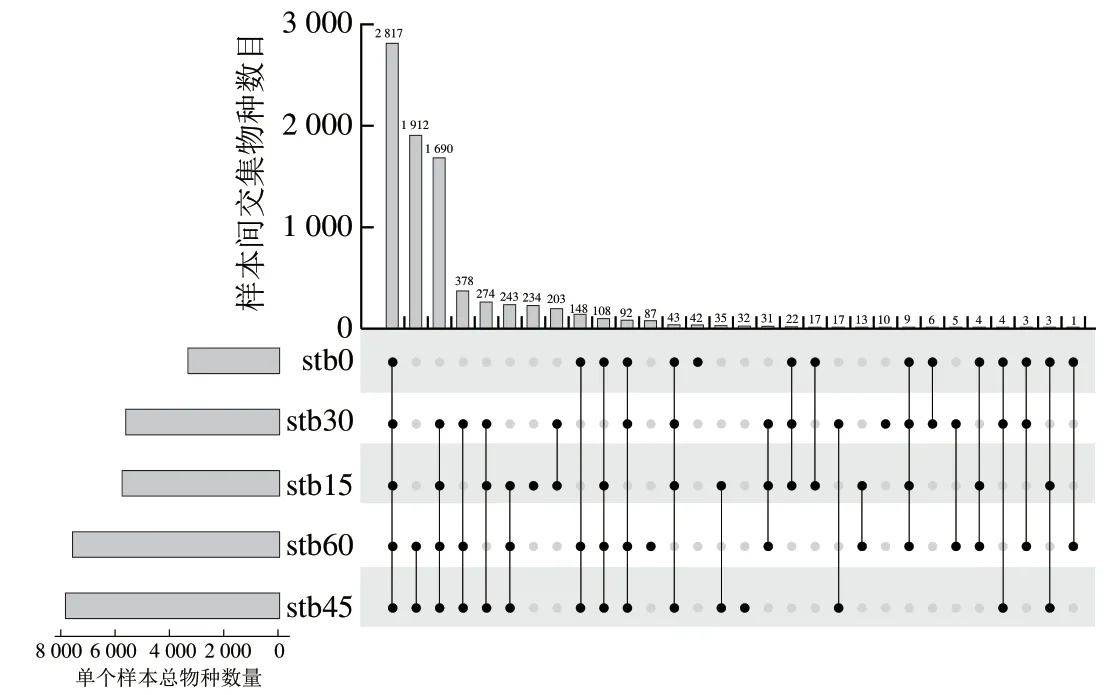
图5 基于种水平的微生物upset图Fig. 5 Upset plot of microbiota at the species level
2.3.3 臭豆腐卤水发酵过程菌群结构变化情况
如图6所示,本实验仅将每个样品中相对丰度不小于1%的种单独呈现于柱形图中,小于1%的统一归属为其他(others)。5个样品中相对丰度不小于1%的菌种总丰度占微生物总丰度60%以上,即能表达样本总微生物的主要信息[30]。虽然在不同发酵阶段卤水中鉴定到大量的共有物种(2 817种),但是相对丰度不小于1%的物种差异较大,发酵前(0 d)与发酵后(15、30、45、60 d)卤水样本中的主要物种种类差异明显,这是由于发酵前后卤水体系的pH值发生较大变化(见2.1节结果),一些非嗜酸菌如微小杆菌等逐渐被替代。发酵后卤水中的主要物种有一定演替变化,但总体上比较相近,推测发酵后卤水中共有的主要物种是发酵阶段的主要特征风味形成的功能菌种。
基于注释得到的卤水中微生物种类和相对丰度,本实验将相对丰度不小于4%的种定义为优势菌[31],基于种水平,卤水发酵前(0 d)样品中的优势微生物主要为微小杆菌属(Exiguobacteriumunclassified、E. alkaliphilum、Exiguobacteriumsp.AB2、E. chiriqhucha,相对丰度分别为22.13%、16.71%、12.96%、7.75%)、粪肠球菌属(Enterococcus faecalis)14.69%。卤水发酵后(15~60 d)共筛选出11种优势菌,即梭菌科中4个属5个种(Clostridiales bacteriumSYSU GA17129、Clostridialesunclassified、Clostridium ultunense、Sporanaerobacter acetigenes、Keratinibaculum paraultunense)、芽孢杆菌科中3个属3个种(Massilibacterium senegalense、Aneurinibacillus aneurinilyticus、Pseudogracilibacillus auburnensis)、产碱菌科1个属1个种(Paenalcaligenes hominis)、依格纳季氏菌属2个种(Ignatzschineriasp.F8392、Ignatzschineria indica)。其中,发酵初期(15 d)卤水中优势菌有4种,包括C. bacteriumSYSU GA17129、S. acetigenes、M. senegalense和A. aneurinilyticus,相对丰度分别为12.74%、11.48%、7.69%和7.22%。发酵中期(30 d)卤水中优势菌有6种,包括M. senegalense、S. acetigenes、Clostridialesunclassified、C. ultunense、K. paraultunense和C. bacteriumSYSU GA17129,相对丰度分别为15.67%、9.92%、9.58%、6.05%、5.07%和4.25%。发酵中、后期(45 d和60 d)卤水中优势菌种共包括Clostridialesunclassified、C. ultunense、K. paraultunense、P. hominis、Ignatzschineriasp.F8392和I. indica,发酵第45天卤水中的优势菌还包括M. enegalense和P. auburnensis,除了发酵第60天卤水中P. hominis相对丰度高达12.92%,其他菌种在卤水中的相对丰度均在4.08%~7.05%之间。有研究表明,微小杆菌属、肠球菌属、梭菌属、芽孢杆菌属等是健康人群肠道中主要菌群组成部分[32],其中,微小杆菌和粪肠球菌具有较高的降解蛋白质和多肽物质的能力[33-34],这对卤水发酵初期降解卤水原料中大量蛋白质和多肽类物质,形成大量风味前体物质起着重要的作用。卤水发酵过程中,优势菌之一的梭菌科大多数在pH值为6.5~8.5,温度30~37 ℃时生长最快,能分泌蛋白酶、淀粉酶、氨基酸脱羧酶、脂酶等代谢糖类化合物、氨基酸、醇类、纤维素类、嘌呤、类固醇和其他有机物合成醇类、酸类及苯酚类物质等[35-36]。芽孢杆菌科是卤水中的另一优势菌科,大多数芽孢杆菌科在pH值为6~8、温度30~37 ℃时最宜生长,能分泌蛋白酶、淀粉酶、氨基酸转氨酶、脱羧酶等多种酶,代谢各种糖类物质和氨基酸产生醇、酸、酯、酚、含硫、杂环类等多种风味化合物[37]。研究报道,梭菌属、芽孢杆菌属在臭豆腐及其卤水中也较高频的被分离鉴定到[6-9,38],这与本研究结果一致。由此可知,卤水体系环境非常适宜梭菌科、芽孢杆菌科的生长和代谢,从而使得卤水形成复杂的风味。
综上所述,微小杆菌属(4个种)和粪肠球菌是卤水发酵前的优势菌种,梭菌科(5个种)和芽孢杆菌科(3个种)的细菌从种类和数量上都是发酵阶段卤水中主要的优势菌,尤其在卤水发酵初、中期占绝对优势,后期逐渐减少。卤水原料中氨基酸、糖类物质非常丰富,可作为风味前体物质,大量的特征风味物质在发酵初、中期产生,由此推测发酵前、初、中期的优势菌为卤水特征风味物质的主要产生菌。
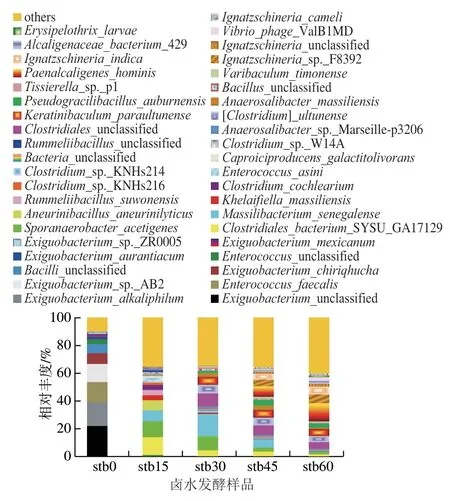
图6 卤水不同发酵阶段基于种水平的群落结构变化Fig. 6 Change in the structure of microbial community at the species level as a function of fermentation time
2.3.4 菌群结构与特征风味成分之间的相关性分析
为了进一步探究优势菌群与特征风味之间的关系,以种水平下微生物相对丰度不小于4%的优势菌群与19种特征风味成分含量进行Pearson相关性分析,见图7,图中越接近红色,正相关性越强,越接近蓝色,负相关性越强。从图7可以看出,与19种特征风味物质有相关性(P<0.05)的优势菌群有11种,其中,与C. bacteriumSYSU GA17129有相关性的特征风味物质数目最多,有8种,包括苯酚、丁酸、丙位十二内酯、吲哚、对甲基苯酚、3-甲基丁酸、2-庚醇、正己醇。与A. aneurinilyticus有相关性的特征风味物质数目较多,有6种,包括3-甲基丁酸、苯酚、3-甲基吲哚、丁酸、丙位十二内酯、1-辛烯-3-醇。与S. acetigenes有相关性的特征风味物质数目也较多,有5种,包括2-庚醇、正己醇、3-苯丙酸乙酯、丁酸、异戊醇。这3种优势菌与12种特征风味物质相关(P<0.05),涵盖了大部分的特征风味物质,尤其是C. bacteriumSYSU GA17129、A. aneurinilyticus与主要特征风味物质苯酚、对甲基苯酚、吲哚、3-甲基吲哚有显著相关性(P<0.05)。C. bacteriumSYSU GA17129属梭菌科,据报道,梭菌科可代谢酪氨酸及其代谢物(4-羟苯丙酮酸、4-羟基苯乙酸和对羟基苯甲酸等)产苯酚或(和)对甲基苯酚[39-40],这与本实验结果一致。芽孢杆菌科属被认为是几种大豆基质发酵食品中的关键微生物[41],A. aneurinilyticus属芽孢杆菌科,谭金萍[42]在卤水中分离鉴定出产苯酚微生物A.aneurinilyticus,这与本实验结果也一致。
相关性分析说明优势菌种C. bacteriumSYSU GA17129、A. aneurinilyticus、S. acetigenes等与大部分特征风味物质存在显著相关(P<0.05),是卤水中主要的风味关联菌。
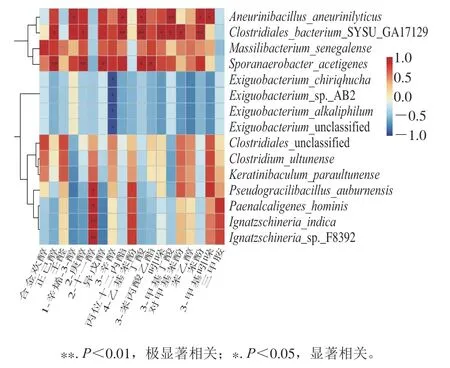
图7 优势菌群与特征风味成分Pearson相关性热图Fig. 7 Heat map showing Pearson’s correlation coefficients between the predominant microbial community and the characteristic flavor components
3 结 论
采用HS-SPME-GC-MS、内标法结合OAV研究长沙臭豆腐卤水发酵过程挥发性成分、特征风味物质及其变化情况,结果表明,卤水发酵过程中共鉴定到75种挥发性风味物质,主要包括苯酚类、吲哚类、醇类、酸类、醛类、酮类、酯类、醚类等。其中,苯酚、对甲基苯酚、吲哚、3-甲基吲哚、丁酸、3-甲基丁酸、4-乙基苯酚、三甲胺、异戊醇、2-庚醇、正己醇、3-辛醇、1-辛烯-3-醇、2-十一醇、苯乙醇、合金欢醇、3-苯丙酸乙酯、丙位十二内酯和壬醛19种物质是卤水发酵过程中的特征风味物质。采用鸟枪法宏基因组学,研究卤水发酵过程菌群变化和优势菌群,结果显示,卤水发酵过程中共鉴定出11种优势菌种,即梭菌科(Clostridiales bacteriumSYSU GA17129、Clostridialesunclassified、Clostridium ultunense、Sporanaerobacter acetigenes、Keratinibaculum paraultunense)、芽孢杆菌科(Massilibacterium senegalense、Aneurinibacillus aneurinilyticus、Pseudogracilibacillus auburnensis)、产碱菌科(Paenalcaligenes hominis)、依格纳季氏菌属(Ignatzschineriasp. F8392、Ignatzschineria indica)。其中,优势菌C. bacteriumSYSU GA17129、A. aneurinilyticus和S. acetigene与12种特征风味物质存在显著正相关(P<0.05),是卤水中主要的风味关联菌。
本实验对长沙臭豆腐卤水发酵过程特征风味物质和优势菌群及其相关性进行研究,明确与卤水特征风味关系密切的主要风味关联优势菌,但这些优势菌群的功能基因、参与的代谢通路及对特征风味物质形成所起的作用、卤水发酵商业菌种的开发等还需进一步研究。

