六价铬对不同时期妊娠小鼠及胚胎的损伤作用
汪 君,刘燕群,2,鲁雄兵,陈靖雯,陈雯婕,孙书萌,罗傲添,刘欣宇
1.江汉大学医学院,湖北 武汉 430056
2.江汉大学持久性有毒污染物环境与健康危害湖北省重点实验室,湖北 武汉 430056
六价铬是重金属铬化合物中毒性最强的。较高剂量的六价铬会对胚胎的发育产生严重的毒性作用。六价铬容易进入体细胞、肝脏、肾脏、消化道、呼吸道、骨骼,在人体内累积,且具有致癌性[1]。六价铬可以改变DNA分子结构,诱导基因突变,使遗传物质发生改变,从而影响子一代的神经系统发育[2]。一定剂量的六价铬可以损伤小鼠的生殖功能[3]。
六价铬可以损伤睾丸及其附属腺的结构,使得精液质量、精浆中微量元素及生化水平异常,减少精子的发生,损伤男性生殖系统,经六价铬处理后的精子与卵母细胞结合受精的成功率显著降低[4]。六价铬对女性生殖系统的损伤机制甚少报道。本研究在雌性小鼠妊娠不同时期进行染毒,旨在比较不同时期六价铬对胚胎发育的影响。
1 材料与方法
1.1 实验动物
SPF 级 育 龄 期 KD 小 鼠, 合 格 证 号:No.42010200005824,购于三峡大学。小鼠毛色纯白有光泽,体格健壮,日龄42 d,活动度高。买回后于空调(24±1)℃除湿模式下适应性喂养5 d。将KD鼠随机分为3组,每组6只雌鼠,6只雄鼠,并另养6只雌鼠备用。
1.2 主要实验仪器与试剂
重铬酸钾(K2Cr2O7),生产于山东西亚化学股份有限公司,纯度99.8%。JA2003B电子天平(上海越平科学仪器有限公司),Chemray 240全自动生化分析仪(深圳雷杜生命科技)等。
1.3 溶液配制
重铬酸钾LD50溶液:鉴于相关文献[5]报道,小鼠的重铬酸钾半数致死量为171 mg/kg[7],本实验选取重铬酸钾342 mg,用双蒸水40 mL溶解,配成LD50原液,然后稀释成1/6LD50溶液,低温保存,以供实验灌胃所需。
1.4 实验方法及观察指标
1.4.1 预实验 共分3组,重铬酸钾(1/4LD50),重铬酸钾(1/6LD50),重铬酸钾(1/8LD50),适应性喂养结束后于20:00合笼,雌雄比1∶1,次日8:00,用生理盐水对细棉签润湿,轻轻插入小鼠阴道0.5 cm处并转动一下后取出,将棉签上的阴道分泌物均匀地涂在载玻片上,95%酒精溶液固定10min后,HE染色5min,用自来水顺载玻片边缘冲掉多余染液,风干后观察,涂片中观察到精子为怀孕第0 d,从怀孕第3 d起灌胃,共灌胃7 d,灌胃期间密切观察小鼠的活动状态,第8 d解剖,对其进行观察,断头取血,并取其胚胎,滤纸脱水,称重,根据胚胎的发育情况,分为劣质胚胎(畸形细胞及桑椹胚期以前细胞)、优质胚胎(桑椹胚及囊胚),找出胚胎质量最好的一组,确定正式实验重铬酸钾浓度。
1.4.2 正式实验 共分为3组:卵泡期染毒组、植入期染毒组、空白对照组。使用苦味酸对小鼠头、尾、上下左右腿做标记。卵泡期染毒组雌性小鼠重铬酸钾染毒1次/d,连续3 d。间隔2 d后,于20:00~22:00按雌∶雄=1∶1合笼,次日8:00检查阴栓,合笼3 d。查到阴栓日记为D1,称取小鼠此时的体质量。植入期染毒组在D4~D6染毒,1次/d,连续3 d。空白对照组注射等量生理盐水与饲料。灌胃期间记录每只小鼠的体质量变化以及活动状态,若有情况异常者,则记录下变化,若有死亡者,则分析原因适度改变实验变量重新开展实验。孕小鼠D14称量孕鼠体质量,断颈处死,剖腹取子宫,剥离去除结缔组织,滤纸吸干,剪开子宫壁,取出胚胎,计数胚胎数和死胎数,再分离胚胎与胎盘,分别称量子宫、胚胎、胎盘的重量;样品使用固定液储存。分别对子宫、卵巢、胚胎做病理切片,拍照留存,观察其结构变化。
1.4.3 指标检测 分别称量小鼠怀孕1 d和解剖当日的体质量,对子宫,胚胎,胎盘称重,记录下胚胎数和死胎数。
1.5 统计学方法
采用SPSS 21.0软件进行分析。组间比较采用单因素方差分析法(ANOVA),进行描述性和方差同质性检验,使用多重比较进行纵向比较两个时期作用强度,计量资料以均数±标准差(±s)表示。以P<0.05为差异有统计学意义。
2 实验结果
2.1 六价铬染毒对不同时期孕体体质量的影响
卵泡期染毒组孕体体质量增加量明显低于空白对照组,植入期染毒组孕体体质量增加量明显低于空白对照组,差异有统计学意义(P<0.05);植入期染毒组孕体体质量增加量低于卵泡期染毒组,差异无统计学意义(P>0.05)。其中,F=15。见表1。HE染色可见卵泡外周有异型的梭形细胞,呈片状排布,瘤细胞层次增多,见图1。

图1 重铬酸钾染毒对卵泡期小鼠卵巢的影响
表1 六价铬染毒对不同时期孕体体质量的影响(±s) g

表1 六价铬染毒对不同时期孕体体质量的影响(±s) g
组别空白对照组(n=6)卵泡期染毒组(n=6)植入期染毒组(n=6)D1体质量33.50±2.881 35.83±2.639 33.83±2.714 D14体质量48.83±2.483 46.83±2.483 44.50±2.588体质量增加量15.33±1.862 11.00±1.414 10.67±1.633
2.2 六价铬染毒对子宫的影响
卵泡期染毒组子宫脏器系数为(1.910±0.255)%,明显低于空白对照组的(2.964±0.487)%,差异有统计学意义(P=0.000 17<0.05);植入期染毒组子宫脏器系数为(2.394±0.320)%,明显低于空白对照组,差异有统计学意义(P=0.017<0.05);植入期染毒组子宫脏器系数高于卵泡期染毒组,差异有统计学意义(P=0.037<0.05)。其中,F=12.380。HE染色可见子宫肌层中出现子宫内膜腺体及大小不一形态各异的异型细胞和大量浆细胞,见图2。
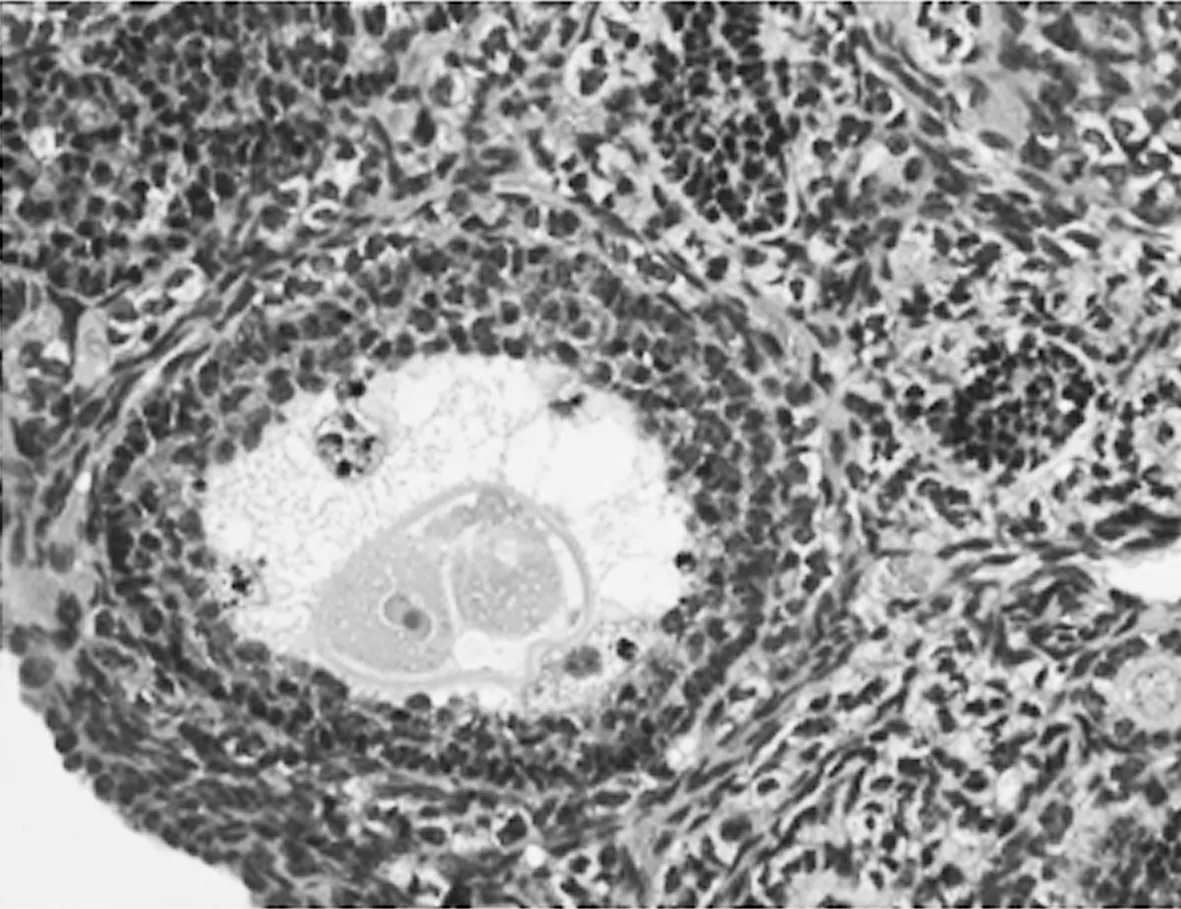
图2 重铬酸钾染毒对植入期小鼠子宫的影响
2.3 六价铬染毒对胎盘的影响
卵泡期染毒组胎盘脏器系数为(0.347±0.016)%,明显低于空白对照组的(0.397±0.030)%,差异有统计学意义(P=0.002<0.05);植入期染毒组子宫脏器系数为(0.312±0.021)%,明显低于空白对照组,差异有统计学意义(P=0.000 01<0.05);卵泡期染毒组胎盘脏器系数高于植入期染毒组,差异有统计学意义(P=0.018<0.05)。其中,F=14.345。 HE染色显示,胎盘间质水肿,血管减少,胎盘绒毛滋养层有中性粒细胞浸润。
2.4 六价铬染毒对胚胎的影响
空白对照组胚胎平均质量为(0.536±0.045)g,明显高于卵泡期染毒组的(0.342±0.038)g和植入期染毒组的(0.395±0.035)g,差异有统计学意义(P<0.05);植入期染毒组胚胎平均质量高于卵泡期染毒组,差异有统计学意义(P=0.035<0.05),其中,F=38.389。如表2所示,空白对照组6只小鼠均未出现死胎;卵泡期染毒组每只小鼠均出现了死胎,其中,有3只小鼠有2个死胎,有3只小鼠有1个死胎;植入期染毒组中4只小鼠出现了死胎,其中怀胎数目最多的小鼠出现了3个死胎,其余3只小鼠均有1个死胎。卵泡期染毒组死胎率明显高于空白对照组,差异有统计学意义(P=0.002<0.05);植入期染毒组死胎率高于空白对照组,差异有统计学意义(P=0.027<0.05);卵泡期染毒组死胎率高于植入期染毒组,差异有统计学意义(P=0.024<0.05)。
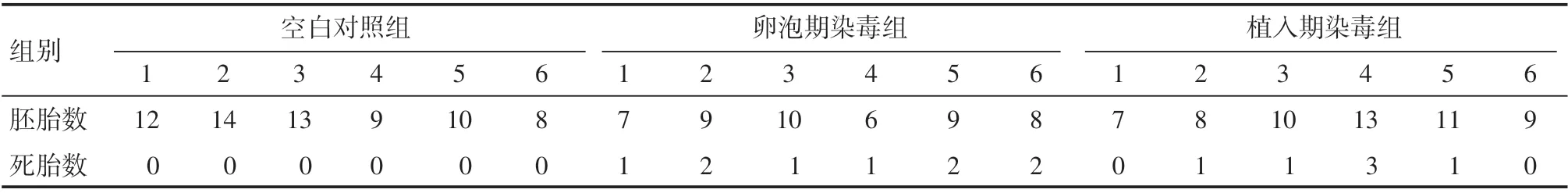
表2 六价铬染毒对不同时期小鼠胚胎数目的影响 只
3 讨论
六价铬作为人类致癌物,其生殖毒性广为探讨,特别是对长期接触铬的高危作业人群,测定工人中孕妇体内尿铬含量,发现尿铬含量越高,新生儿体质量以及出生头围越小[6]。在六价铬接触水平达到一定浓度条件下,铬作业男工的精子存活率明显下降,铬作业中女工月经异常,主要表现为痛经和月经周期的紊乱,并且铬作业中女工的自然流产率和死产率较高,妊娠结局较差[7]。
六价铬在大鼠的器官发生期(妊娠的7~15 d)具有强烈的胚胎发育毒性,可导致胚胎外观、骨骼、内脏的畸形率增高,表现为有腭裂、脊柱膨出和骨骼发育不全等。本实验采用重铬酸钾对卵泡期(妊娠前2 d)和植入期(妊娠的4~6 d)经灌胃途径染毒,旨在寻找六价铬染毒的敏感位点。分别对小鼠怀孕1 d和解剖当日的体质量进行称重,计算小鼠体质量增加量,从而比较三组体质量增加量以反映六价铬染毒对孕体的影响。称取子宫、胚胎、胎盘的重量,计算子宫和胎盘的脏器系数,使用脏器系数反映脏器的萎缩程度,对照空白组,比较卵泡期染毒组和植入期染毒组的脏器系数降低程度。使用胚胎平均质量(每只孕鼠受精情况不一致,导致子宫中胚胎数量各不相同)反映胚胎的发育程度。记录死胎数。制备常规石蜡切片,经HE染色,光学显微镜下观察并拍照记录,在高倍镜下观察其病理变化。实验结果显示,卵泡期染毒组和植入后期染毒组体质量增加量明显低于空白对照组;卵泡期染毒组和植入期染毒组的脏器系数相比空白对照组都有了一定程度下降;卵泡期染毒组和植入期染毒组均出现了死胎,表明六价铬对小鼠的生殖系统有损伤作用。卵泡期染毒组相比植入期染毒组,子宫的脏器系数下降更为明显,表明早期染毒对生殖系统的影响更大。卵泡期染毒组死胎率相比植入期染毒组更高且卵泡期染毒组的胚胎平均质量较植入期染毒组低,表明卵泡期染毒组胚胎发育程度较植入期染毒组低,说明胚胎发育早期对六价铬的毒性更为敏感,六价铬对子宫和胚胎的毒性随着染毒时间的延长增强,具有时间依赖性[8]。另外,观察胚胎的病理切片,可以发现卵泡期的胚胎受损程度较强,提示在卵泡期染毒也就是孕前染毒损伤了卵母细胞的遗传物质,使得胚胎无法正常发育。卵泡期分泌雌激素,雌激素对于整个妊娠期起着至关重要的作用,对后续胚胎发育有着较大的影响,卵泡期染毒受损严重是否与雌激素有着密不可分的联系,需要进一步进行实验,实时监测孕小鼠体内雌激素的量。
植入期染毒组相比卵泡期染毒组胎盘的脏器系数下降更为明显,表明植入期染毒组对胎盘的损伤较大。结合胚胎发育学知识,这可能与小鼠胚胎在植入子宫后才伴随着胎盘的形成有关,单纯植入期在胎盘发育初始染毒有较强毒性作用,本实验研究结果有待进一步证实。

