副猪嗜血杆菌与PCV3 混合感染的实验室诊断及分析
赵自亮,田宇森,庄鸿琨,李婕,朱桓奕,刘霞,杨晓伟,,张立武,赵光伟,
(1.西南大学动物医学院,重庆 402460;2.贵州省动物疫病预防控制中心,贵州贵阳 550008;3.重庆三杰众鑫生物工程有限公司,重庆 402460)
副猪嗜血杆菌病也称格拉泽氏病(Glasser's disease)[1],是养猪业中影响较为严重的细菌性传染病之一,临床上往往与其他呼吸系统疾病或免疫抑制性疾病病原,如猪传染性胸膜肺炎放线杆菌、圆环病毒和猪繁殖与呼吸综合征病毒(PRRSV)等发生混合感染,单独感染时则以猪多发性纤维素性浆膜炎和关节炎为特征,呈现出高发病率、高死亡率特点[2]。该病由隶属巴氏杆菌科嗜血杆菌属的副猪嗜血杆菌(Haemophilus parasuis,Hps)引起。Hps 无鞭毛和芽孢,为革兰阴性短小杆菌,目前已发现15种血清型[3]。不同Hps血清型毒力差异较大,交叉保护力较低,且不同时空分离菌株的主要生物学特性存在较大差异,因而尽管目前有防控该病的商品化疫苗,但其预防效果存在地区差异。临床上,抗生素仍是当前防治副猪嗜血杆菌病的主要手段,但长期不合理地用药造成的耐药问题较为突出。
猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科圆环病毒属的闭合单股环状DNA 病毒,有多种血清型,其中PCV3 于2016 年首次在患有皮炎肾病综合征的母猪及流产胎儿的组织病料中被检出[4],随后世界范围内陆续报道发现该病毒。我国在辽宁、江西和重庆等地也检测到PCV3[5]。现有资料表明,PCV3 单独感染会导致坏死性心肌炎、间质性肺炎以及轻度的淋巴细胞性肝炎及免疫器官淋巴细胞消耗型炎症等,与断奶仔猪多系统衰弱综合征(PMWS)症状较为相似[6]。尽管PCV3 分离困难,但通过病毒拯救获得的PCV3 病毒粒子可以导致4 周龄和8 周龄仔猪产生与猪皮炎与肾病综合征(PDNS)相似的临床症状[7],因而PCV3 的致病性不容忽视。鉴于对PCV3 感染尚无商品化疫苗及治疗药物,目前对其防控仍是一大难点。
本研究对重庆市某猪场发生的表现发热和呼吸道症状的疫病进行实验室诊断,确定为Hps 和PCV3 的混合感染,进而对Hps 分离株的主要生物学特征以及PCV3 的基因组特征进行了分析,以期为这两种病原混合感染的临床综合防治提供参考。
1 材料与方法
1.1 病料及发病情况
重庆市某猪场(存栏基础母猪300 头)育肥猪中出现以发热和呼吸道症状为典型特征的疾病,发病率约为25%,死亡率约为20%;剖检病死猪发现,肺脏有纤维素膜覆盖,出血、肿胀明显,心包内有大量积液。无菌采集病死猪心包液和肺脏组织至冰盒中,低温迅速送至实验室检测。
1.2 主要试剂
胰蛋白胨大豆琼脂(TSA)、胰酪大豆胨液体培养基(TSB)、细菌微量生化反应管及药敏纸片,购自杭州微生物试剂有限公司;特级胎牛血清(FBS)和一管式临床样品DNA 抽提试剂盒,购自上海生工生物工程股份有限公司;EasyPure Viral DNA/RNA Kit,购自北京全式金生物技术有限公司;反转录酶、2×RapidTaqMaster Mix 和DL 2 000 Plus DNA Marker,购自南京诺唯赞生物科技有限公司;引物合成及测序,均在北京六合华大基因重庆分公司完成。
1.3 病料PCR 检测
根据临床表现及剖检病理变化,参考已发表的RT-PCR 或PCR 方法,对组织病料进行传染性胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,App)[8]、Hps[9]、猪瘟病毒(CSFV)[10]、PRRSV[11]、猪肺炎支原体(Mycoplasma hyopneumoniae,Mps)[12]、PCV2 和PCV3[13]等 病原的核酸检测。病料组织匀浆后,利用EasyPure Viral DNA/RNA Kit 提取核酸,其中提取的DNA用于App、Hps、Mps、PCV2 和PCV3 检测,提取的RNA 经反转录后用于CSFV 和PRRSV 检测。病原检测及PCV3 全长扩增用引物序列、目的片段大小及退火温度等见表1。
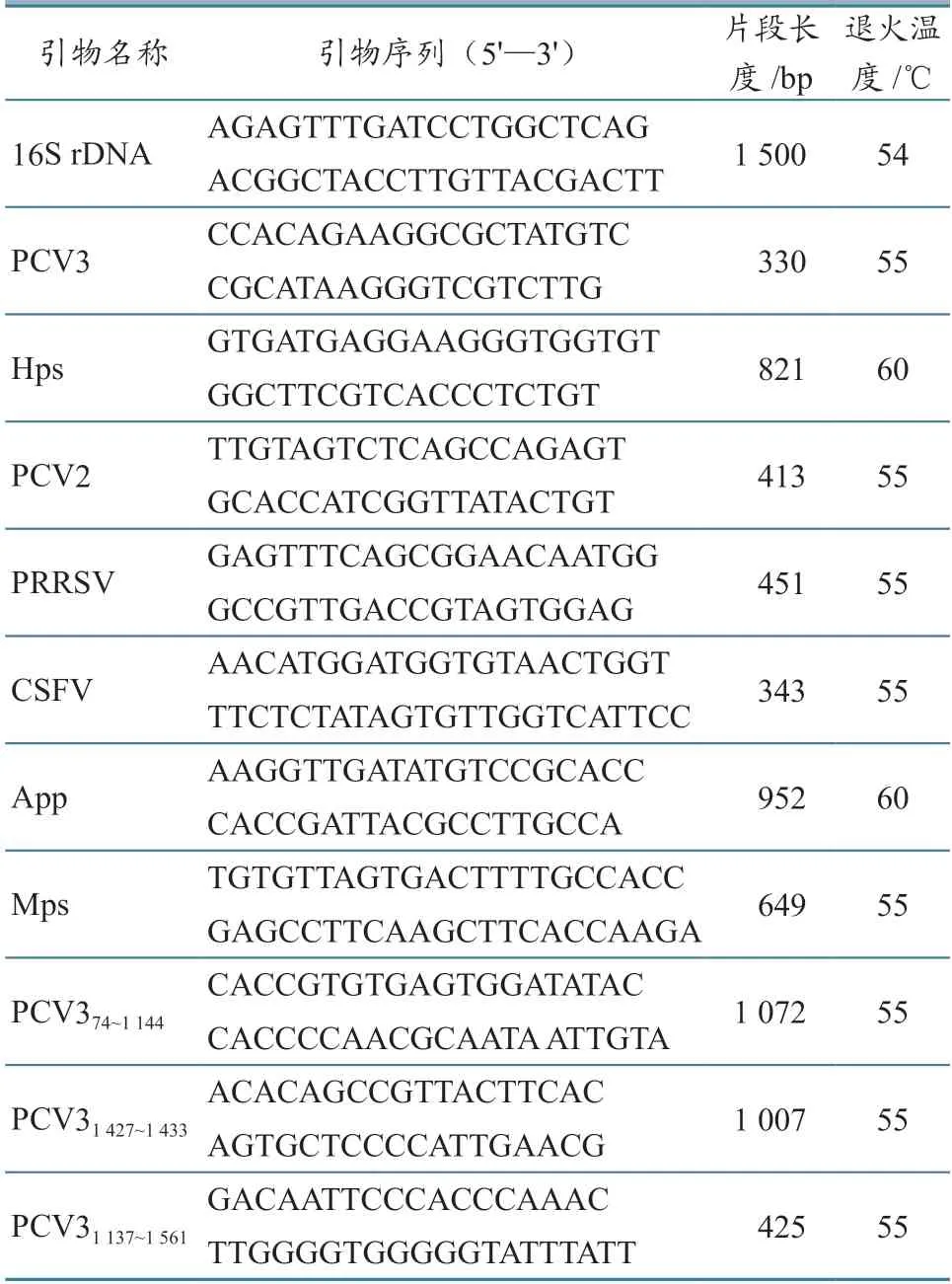
表1 病原检测及PCV3 全长扩增用引物信息
1.4 细菌分离
用接种环无菌钩取肺脏深层组织以及心包液接种兔血TSA 平板,置于37 ℃恒温培养箱中,5% CO2厌氧培养24~48 h,观察细菌生长状况及菌落特征,挑取单个菌落进行二次纯化培养36~48 h;将纯化后的单个菌落接种于含有5%胎牛血清(FBS)的TSB 培养基中进行扩培,革兰氏染色后镜检观察其形态,后加无菌甘油冻存于-80 ℃备用。
1.5 16S rDNA 测序鉴定及同源性分析
利用一管式临床样品DNA 抽提试剂盒提取纯培养细菌基因组,参考焦振泉[14]报道的16S rDNA通用引物进行PCR 扩增;PCR 产物经1.0%琼脂糖凝胶电泳纯化后送华大基因科技有限公司测序,对测序结果利用NCBI 的Blast 功能进行比对,确定分离菌种类。
1.6 Hps 血清型鉴定
1.7 分离菌生长曲线绘制
将纯化培养菌接种于含5% FBS 的TSB 中,37 ℃ 180 r/min 振荡培养24 h;将上述菌液按1%的体积分数接种于含5% FBS 的5 mL 灭菌TSB 中,设3 个平行组,共15 组,以未接菌培养基作为空白对照,每隔2 h 取一组测定OD600nm,计算样品与空白对照差值的平均值,连续测定30 h,绘制分离菌株生长曲线。
1.8 分离菌药敏试验
根据美国临床检验标准委员会(NCCLS)推荐的Kriby-Bauer 纸片扩散法,对分离菌进行β-内酰胺类、氨基糖苷类和四环素类共23 种药物的敏感性试验,参照药敏纸片说明书进行耐药(R)、中介(I)和敏感(S)分析。具体步骤:取分离菌纯化培养物调整菌液浓度为0.5 麦氏比浊度,均匀涂布于兔血TSA 平板,培养36 h,测量并记录抑菌圈直径。
1.9 分离菌耐药基因检测
对分离菌分别进行β-内酰胺类[17-20]、氨基糖苷类[21]和四环素类[22]药物的49 种常见耐药基因进行检测分析,其中β-内酰胺类包括blaTEM、blaCTX-M、blaSHV、blaPER、blaSIM、blaDHA、blaADC、blaEBC、blaCIT、blaACC、blaCMY、blaMOX、blaFOX、blaPSE、blaIMP、blaVIM、blaOprD2、blaGES、blaMIR、blaISAbal、blaCARB、blaGIM、blaSPM、blaCMY-1、blaKPC-gp、blaNMC和blaACT-1共27 种,氨基糖苷类包括strA、strB、aadB、aac(3)-IV、aph3'-III、aacC2和aphA1共7 种,四环素类包括tetA、tetB、tetC、tetD、tetE、tetG、tetK、tetL、tetM、tetO、tetS、tetZ、tet31、tet33和tet34共15 种。
1.10 PCV3 全基因组扩增与拼接
参考Fux 等[23]报道,合成3 对引物(表1)对病料进行3 段PCV3 基因组扩增;PCR 产物纯化测序后,利用DNAstar 7.0 软件进行拼接,获得PCV3 全基因组序列,并将该序列信息上传至GenBank。
1.11 PCV3 系统进化树构建及基因型鉴定
将本试验获得的PCV3 基因组序列与国内22 个省份分离的及美国最早报道的毒株信息进行比较,参考毒株全序列包括PCV3a 基因型9 株(MH177453、MH823221、MK105924、M K 1 7 8 2 9 7、M K 1 7 8 3 2 0、M T 2 2 8 7 0 3、OK334614、OL422143、KT869077),PCV3b 基因型5 株(MH607133、MK142773、MK178285、MN605937、MN790776),PCV3c 基因型9株(KY075990、MF072716、MG372486、MG564175、MH683051、MK656956、MN507536、MZ934695、MZ449237);利用MEGA 7 软件构建系统进化树,进行基因型鉴定。
2 结果
2.1 临床剖检
临床剖检患病猪,可见心包中有大量浑浊积液(图1-A),并混有血液;肺脏表面被乳白色纤维素性膜覆盖(图1-B),并与胸腔发生粘连,剥去被膜后肺脏出血、肿胀明显。
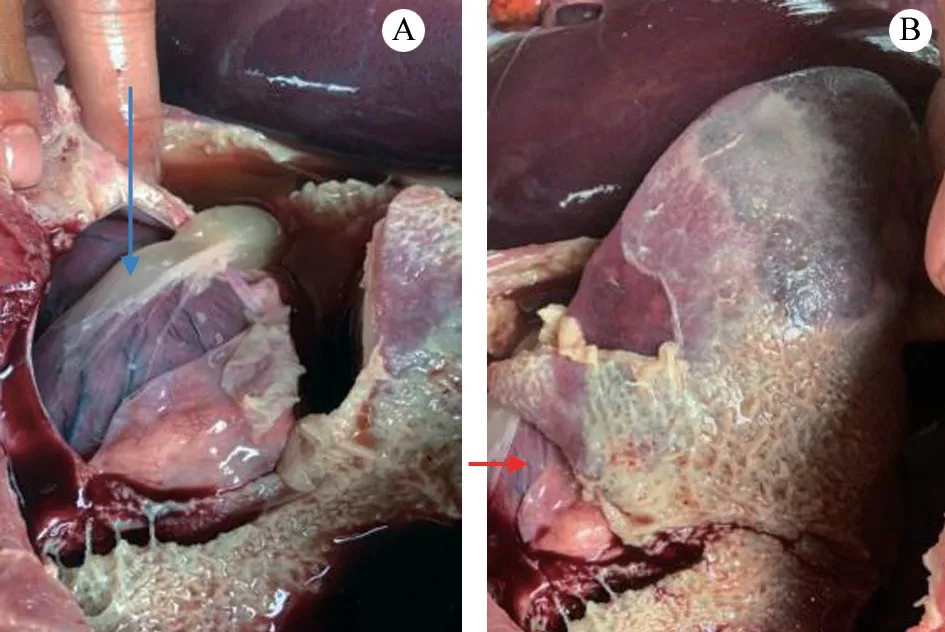
图1 发病猪剖检结果
2.2 病料PCR 检测
PCR 检测结果(图2)显示,病料样本中Hps和PCV3 两种病原均为阳性,其余5 种病原(App、PCV2、CSFV、PRRSV 和Mps)均为阴性。
对所选用的太阳能电池组件和蓄电池,有必要对它们的设计进行校核,以进一步了解系统运行中可能出现的情况,保证太阳能电池组件和蓄电池可以有效、协调工作。
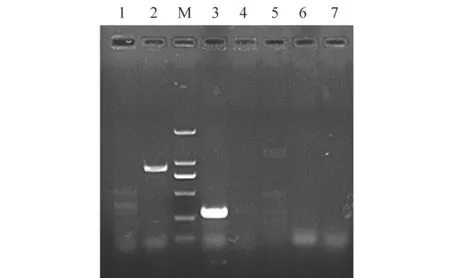
图2 病料PCR 检测结果
2.3 分离菌培养及形态特征
病料接种兔鲜血琼脂平板于37 ℃、5% CO2培养48 h 后,可见无色透明、边缘整齐、光滑湿润的圆形小菌落,菌落周围有溶血环(图3-A);纯培养的细菌为革兰氏阴性,多单个存在,呈球状、短杆状,部分以短链排列,呈丝状排布(图3-B)。

图3 分离菌培养及形态结果
2.4 分离菌16S rDNA 基因扩增及进化树分析
分离菌的16S rDNA 扩增结果见图4-A。测序后经Blast 比对,该菌与Hps 江西株(JN031031)同源性为100%(图4-B),可以确定分离菌为Hps,将其命名为YY-1。该序列已上传GenBank,登录号为ON645281。YY-1 与贵州、湖南、云南的Hps 菌株同源性较高,但与四川、江苏的同源性较低,说明Hps 在我国存在一定地域差异。

图4 YY-1 株16S rDNA 基因PCR 扩增结果及其与巴氏杆菌科主要成员的同源性比较结果
2.5 YY-1 菌株生长曲线
Hps YY-1 株生长曲线测定结果(图5)显示,该菌0~4 h 内生长较为缓慢,4 h 后上升趋势明显,10~14 h 上升最为显著,为该菌的对数生长期,18 h 后吸光值(OD600nm)趋于平缓,进入平台期。

图5 YY-1 株在TSB 培养基中的生长曲线
2.6 YY-1 菌株血清型鉴定
利用PCR 方法对YY-1 菌株进行血清学鉴定,结果发现该菌血清5 型wcwk基因扩增出450 bp 的目的条带,与预期相符,经测序比对确定YY-1 菌株为血清5 型(图6)。

图6 YY-1 菌株血清型鉴定结果
2.7 YY-1 菌株药敏试验
药敏结果显示:YY-1 菌株对头孢他啶、苯唑西林、新霉素、卡那霉素、氯霉素、米诺环素、多黏菌素B 和四环素表现为耐药,对头孢氨苄、丁胺卡那、氟苯尼考表现为中介,对头孢曲松、氨苄西林、羧苄西林、青霉素、头孢唑林、头孢哌酮、头孢呋辛、头孢拉定和多西环素等药物表现为敏感。
2.8 YY-1 菌株耐药基因检测
PCR 检测结果显示:YY-1 菌株中含有9 种耐药基因,分别是β-内酰胺类耐药基因blaVIM、blaISAbal、blaCARB和blaCMY-1(图7-A、B),氨基糖苷类耐药基因aadB(图7-C)和四环素类耐药基因tetB、tetK、tetM、tetO(图7-D)
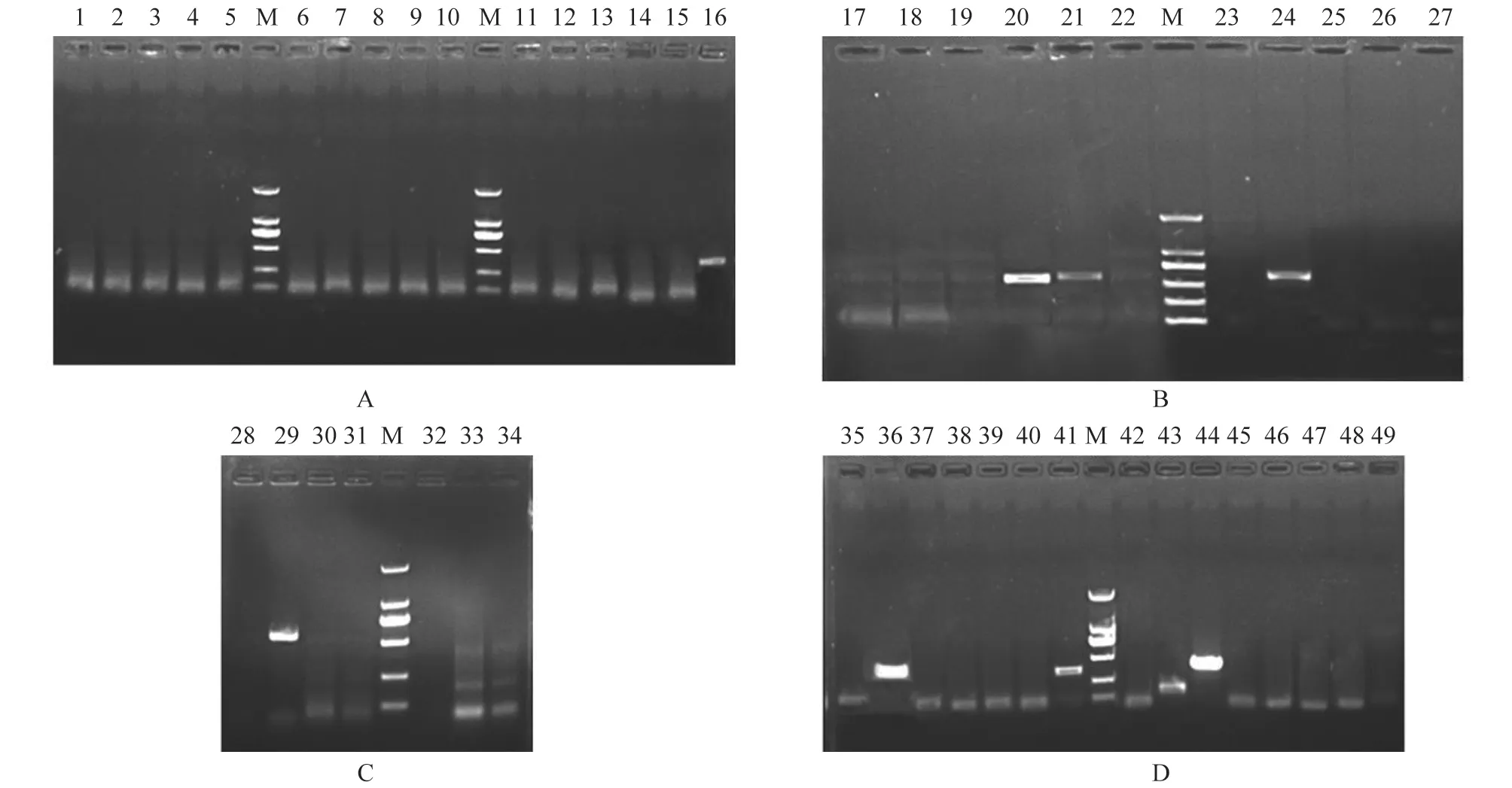
图7 YY-1 株β 内酰胺类、氨基糖苷类、四环素类耐药基因检测结果
2.9 PCV3 全基因组扩增
以送检样本提取的DNA 为模板进行PCV3 分段扩增。结果(图8)显示:经测序拼接,PCV3全基因组全长2 000 bp,GC 含量为50.45%;主要开放阅读框ORF1(216~1 106 nt)编码的复制酶蛋 白(replication-associated protein)共296 aa,ORF2(1 336~1 980 nt)编码的衣壳蛋白(capsid protein),共214 aa;ORF1 无经典起始密码子ATG,且ORF2 与ORF1 编码方向相反。将其命名为PCV3-CQ-YunYang,序列信息上传GenBank(登录号:ON505646)。

图8 PCV3-CQ-YunYang 株全基因组扩增结果
2.10 PCV3 全基因组系统进化树及基因型分析
系统进化树(图9)显示:本试验分离毒株与吉林MK178320 株位于同一分支,具有最高的同源性;与广西MH823221 株和美国最早报道的KT869077 株也具有较高的亲缘关系。基于Cap 蛋白氨基酸序列24/27 位点分型方法,确定本试验分离毒株为3a 基因型。

图9 PCV3-CQ-YunYang 全基因组序列与参考毒株系统进化树
3 讨论
多病原混合感染是当前猪病的典型特征之一,引起的症状更加复杂,仅凭临床表现往往无法准确判断其病因,需借助实验室手段严格检验并与临床结合方能得出准确结果。本试验中猪场发生的病情也符合这一点,剖检结果与多种病原感染较为相似,单靠肉眼观察并不能确定病因,因而实验室诊断十分必要。此外,一些新兴的诊断技术和方法应在临床中广泛推广,这样有利于提升诊断效率,迅速确定病因,从而降低经济损失。
Hps 是猪场中常见的细菌性病原,利用分子生物学技术可将其分为1~15 个血清型,其中1、5、10、12、13、14 型为高毒力型,2、4、8、15 型为中等毒力型,3、6、7、9、11 型为无毒力型[3]。根据以往的报道,2007—2014 年我国的优势血清型为2、4、5、12、13 型[24],2014—2020 年为4、5、7、13、14 型[25],2020—2021 年为4、5、12、13 型[26],可以看出4、5、13 型是在我国长期流行的优势血清型。本试验自重庆市分离到的YY-1 菌株,经鉴定为血清5 型,与上述报道的优势血清型一致。
Hps 另一个不容忽视的问题是耐药性严重。尽管目前已有针对Hps 的商品化疫苗(2 价、3 价、4 价),但由于在使用过程中往往并不清楚养殖场流行的优势菌株血清型,容易造成免疫失败,因而很多养殖场仍主要采用抗生素进行预防和治疗,导致菌株耐药现象非常普遍。孙华润等[27]对河南、湖北、湖南、山西、陕西、安徽和江西等7 个省份分离的104 株Hps 进行药敏试验发现,菌株对β内酰胺类氨苄西林耐药率为39.4%,对四环素、环丙沙星耐药率分别为51.9%和51.0%,对氨基糖苷类卡那霉素耐药率为10.6%,使得养殖场有效防控Hps 感染的药物逐渐减少。本试验分离的YY-1 菌株对多数的头孢类药物仍表现为敏感,但对氨基糖苷类和四环素类药物敏感性较差,并表现出较强的耐药性;随后的耐药基因检测结果也与之基本相符,头孢类耐药基因共检出blaVIM、blaISAbal、blaCARB和blaCMY-1,四环素类耐药基因(tetB、tetK、tetM、tetO)和氨基糖苷类耐药基因aadB均有检出,这也充分暴露出Hps 耐药严重的问题。
PCV3 是近几年刚发现但其实早已在猪场流行的,与PMWS、PDNS 等密切相关的病毒,目前对该病毒致病性研究的报道较少,主要是因为PCV3分离困难。研究人员曾尝试将阳性病料接种到传代细胞系PK15 和ST 细胞中,但由于不出现细胞病变而导致分离失败[4]。尽管如此,PCV3 的致病性不容忽视。吕志凯等[6]对PCV3 自然感染仔猪病例进行病理学研究发现,PCV3 单独感染病猪呈现典型的PMWS 症状,且病毒主要位于单核和巨噬细胞胞质中;Jiang 等[7]研究发现,通过病毒拯救获得的PCV3 病毒粒子可使仔猪产生PDNS 症状。因而对PCV3 临床感染病例进行研究是必要的。本研究中的患病猪由于是PCV3 和Hps 的混合感染,比单独感染引起的症状更为复杂。
基于PCV3 Cap 蛋白第24 位和27 位氨基酸差 异,将PCV3 基因型分为PCV3a、PCV3b 和PCV3c。本试验检测到的病毒属于3a 亚型,其第24 位和27 位氨基酸分别为丙氨酸(A)和精氨酸(R),这与2020 年在重庆市所检测到毒株基因型一致[28],说明PCV3a 可能是该地区的优势基因型。
病原混合感染往往会导致比单一感染更加严重的后果。本病例也存在类似情况,其发病率和死亡率均高于单一病原感染,但Hps 与PCV3 在感染过程中是否是某一病原起主导作用,或者是先感染某一病原,而后继发感染另一病原,其准确的感染机制有待于进一步研究。尽管如此,本研究对Hps和PCV3 的主要生物学特性进行了分析,其结果可为临床疫病防控提供参考。

