常见肉类成分荧光PCR 检测试剂盒的比较
史喜菊,杜思乐,蒲静,张伟,任彤,徐立伟,邓丛良,赵相鹏,高志强,汪琳,张佳玮,白子龙,张小寒,赖平安,宋悦谦
(中国海关科学技术研究中心,北京 100026)
动物源性食品是人类饮食结构的重要组成部分,而动物源性食品中肉类又居于首位,是人类动物蛋白的主要来源。国家统计局数据显示,2015年之前我国肉类总产量呈逐年上升趋势,2016—2018 年基本持平,2019 年开始出现下降,这种下降主要是由于原来占肉类总量60%以上的猪肉产量降低了21.3%,相反,牛肉和羊肉产量却分别增加了3.6%和2.7%。不同种属来源的肉,由于其营养价值、风味以及消费者宗教习俗等原因,价格差异很大,所以市场上肉类掺假现象层出不穷。肉制品掺假是全球性问题。国外对近千种肉制品的检测结果表明,有近20%的产品存在标识与品种不完全相符的现象,如2012 年沃尔玛的狐狸肉、2013年的欧洲马肉等事件[1]。在国内,有些不法肉食品企业使用相对廉价的猪肉、鸡肉等肉类原料,通过各种深加工手段,冒充牛、羊肉制品进行销售以谋取不当利益,严重侵犯了消费者的合法权益。
目前已知的肉及肉制品中肉类成分的鉴定方法众多,其中基于DNA 的PCR 检测技术被认为是精准有效的检测方法之一[2-5],我国也相应出台了一系列检测标准,如《常见畜禽动物源性成分检测方法 实时荧光PCR 法》[6]、《动物产品中牛、山羊和绵羊源性成分三重实时荧光PCR 检测方法》[7]、《食品、化妆品和饲料中牛羊猪源性成分检测方法实时荧光PCR 法》[8]等。随着这些标准的出台,市场上销售的各类肉源成分荧光PCR 检测试剂盒也层出不穷。本研究特选取了市场上常见的4 个品牌的5 种肉及肉制品(牛、羊、猪、鸡、鸭)荧光PCR 检测试剂盒,并对其特异性、灵敏性、成本效益等方面进行了比较,旨在为选择更合适的肉类成分检测试剂盒提供数据支撑。
1 材料与方法
1.1 材料
1.1.1 样品来源 从屠宰场和市场上购买牛肉、羊肉、猪肉、鸡肉和鸭肉各20 份。
1.1.2 主要试剂 动物组织DNA 提取试剂盒,购自天根生化科技有限公司;5 种肉类成分荧光PCR 检测试剂盒购自4 家生物公司,分别用A、B、C 和D 代表。
1.1.3 主要仪器 核酸提取仪、实时荧光定量PCR 仪、均质仪、研钵和研磨棒、微量移液器等。
1.2 方法
1.2.1 样品前处理
1.2.1.1 单一样品 去除样品中明显的脂肪组织并用灭菌水清洗干净;取100~200 mg 样品用手术剪剪碎,并用研磨棒充分研磨;取50 mg 研磨样品置于1.5 mL 无菌离心管中,加入200 μL 灭菌PBS(pH 7.2)用于核酸提取。每份样品做3 个重复。
1.2.1.2 混合样品 称取5 种肉类样品各100 mg,置于研钵中,用研磨棒充分研磨混匀;取50 mg 研磨样品置于1.5 mL 无菌离心管中,加入200 μL 灭菌PBS(pH 7.2)用于核酸提取。每份样品做3 个重复。
1.2.2 核酸提取 按照动物组织DNA 提取试剂盒说明书,分别从上述样品中提取DNA,置于-20 ℃冰箱备用。
1.2.3 核酸浓度测定 用NanoDrop 微量核酸蛋白浓度测定仪测定各样品核酸浓度,用于灵敏性试验。
1.2.4 肉类种属成分荧光PCR 检测 参加比对的4 种品牌肉类成分检测试剂盒均为荧光PCR 方法。按照各试剂盒说明书要求配制反应体系,设置反应条件,进行结果判定。具体见表1。
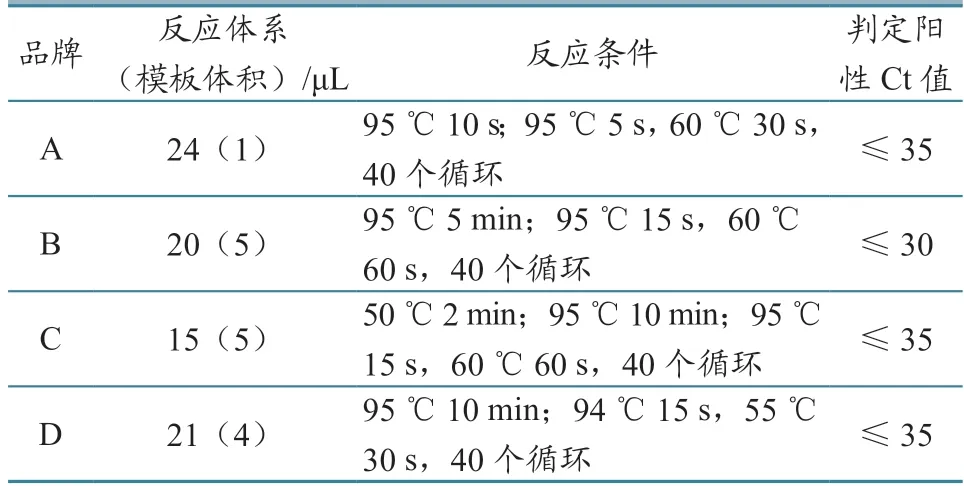
表1 4 种品牌肉类成分荧光PCR 检测试剂盒检测条件
1.2.5 特异性比较试验
1.2.5.1 单一样品 以单一样品提取的核酸为模板,分别用4 种品牌试剂盒进行荧光PCR 反应,试验检测单一样品的特异性。
1.2.5.2 混合样品 以混合样品提取的核酸为模板,分别用4 种品牌试剂盒进行荧光PCR 反应,试验检测混合样品的特异性。
1.2.6 灵敏性比较试验
1.2.6.1 单一样品 分别提取5种肉类样品核酸,测定浓度后进行10 倍倍比稀释;以倍比稀释的核酸为模板,分别用4 种品牌试剂盒进行荧光PCR 反应,试验检测单一样品的灵敏性。每种试剂盒检测出的最低核酸浓度即为该类源性成分的最低检测限。
1.2.6.2 混合样品 提取5种混合肉类样品核酸,测定浓度后进行10 倍倍比稀释;以倍比稀释的核酸为模板,分别用4 种品牌试剂盒进行荧光PCR 反应,试验检测混合样品的灵敏性。每种试剂盒检测出的最低核酸浓度即为该类源性成分的最低检测限。
1.2.7 成本与效率比较 计算4 种品牌试剂盒的反应时间及试剂耗材成本,比较成本与效率。
2 结果与分析
2.1 核酸浓度
测定的单一样品和混合样品的核酸纯度和浓度见表2。
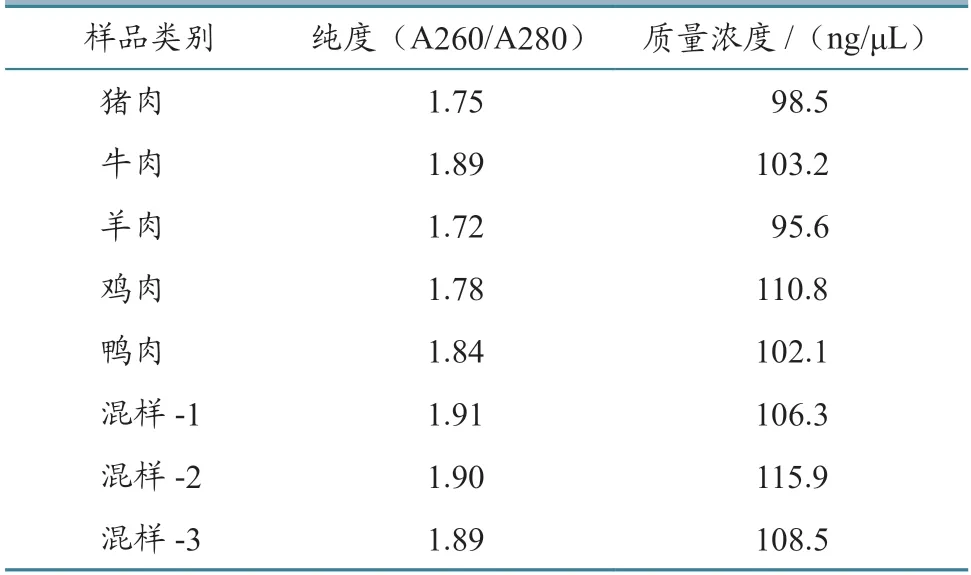
表2 核酸原始纯度及浓度
2.2 特异性比较试验
2.2.1 单一样品 结果(表3)显示:每种试剂盒均只能从单一样品中检出特异性扩增,而对其他肉类模板扩增均为阴性。说明各试剂盒的特异性均较好,不同肉类之间不存在交叉反应。

表3 各试剂盒检测单一样品特异性结果
2.2.2 混合样品 结果(表4)显示:每种试剂盒均只能从混合模板中检出特异的肉品种类,而对其他4 种肉类的扩增均为阴性。说明各试剂盒的特异性均较好,混合模板也未对特异性产生干扰。

表4 各试剂盒检测混合样品特异性结果
2.3 灵敏性比较试验
2.3.1 单一样品 不同试剂盒检测单一样品的最低检测限存在差异(表5):对于牛源性成分检测试剂盒,D 品牌的最低检测限为1.03 fg/μL,A 品牌为103 fg/μL,B 和C 品牌为10.3 pg/μL;对于羊源性成分检测试剂盒,B 和C 品牌的最低检测限为9.56 fg/μL,D 品牌为95.6 fg/μL,A 品牌为956 fg/μL;对于猪源性成分检测试剂盒,B 和C品牌的最低检测限为9.85 fg/μL,A 和D 品牌为98.5 fg/μL;对于鸡源性成分检测试剂盒,C 和D 品牌的最低检测限为11.08 fg/μL,A 和B 品牌为110.8 fg/μL;对于鸭源性成分检测试剂盒,D品牌的最低检测限为10.21 fg/μL,其他3 家均为102.1 fg/uL。
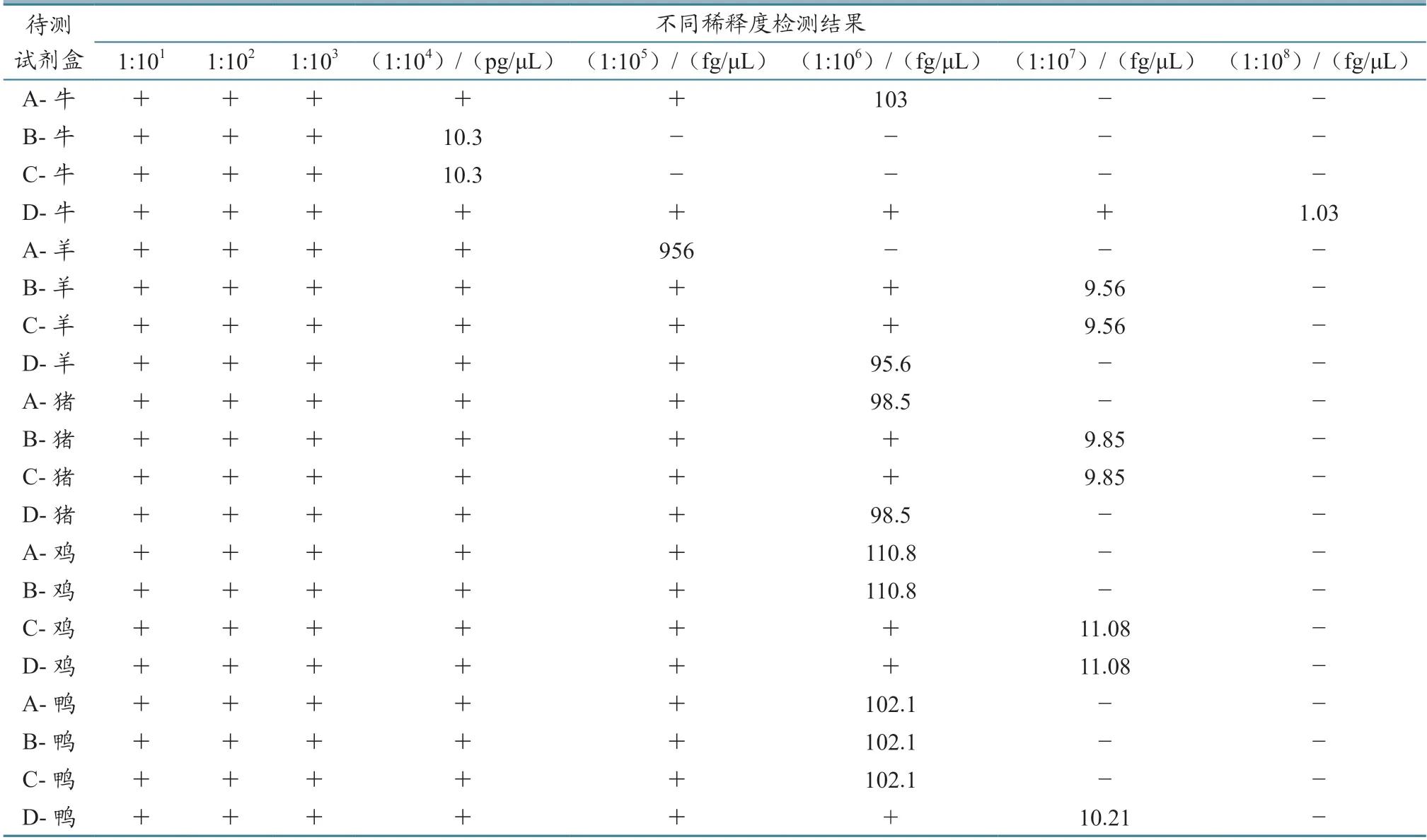
表5 各试剂盒检测单一样品最低检测限
2.3.2 混合样品 不同试剂盒检测混合样品的最低检测限存在差异(表6):A 品牌的5 种肉类成分检测试剂盒比较一致,最低检测限均为1.10 pg/μL,不同成分的试剂盒之间无差异;B 品牌的羊源和鸡源成分检测试剂盒最低检测限为1.10 pg/μL,其他3 种成分检测试剂盒的最低检测限为110.2 fg/μL,不同成分的试剂盒检测限相差10 倍;C 品牌的牛源和羊源成分检测试剂盒的核酸检测限为11.0 pg/μL,其他3 种成分检测试剂盒的核酸检测限约为110.2 fg/μL,不同成分的试剂盒检测限相差100 倍;D 品牌的5 种肉类成分检测试剂盒比较一致,最低检测限为110.2 fg/μL,不同成分的试剂盒之间无差异。
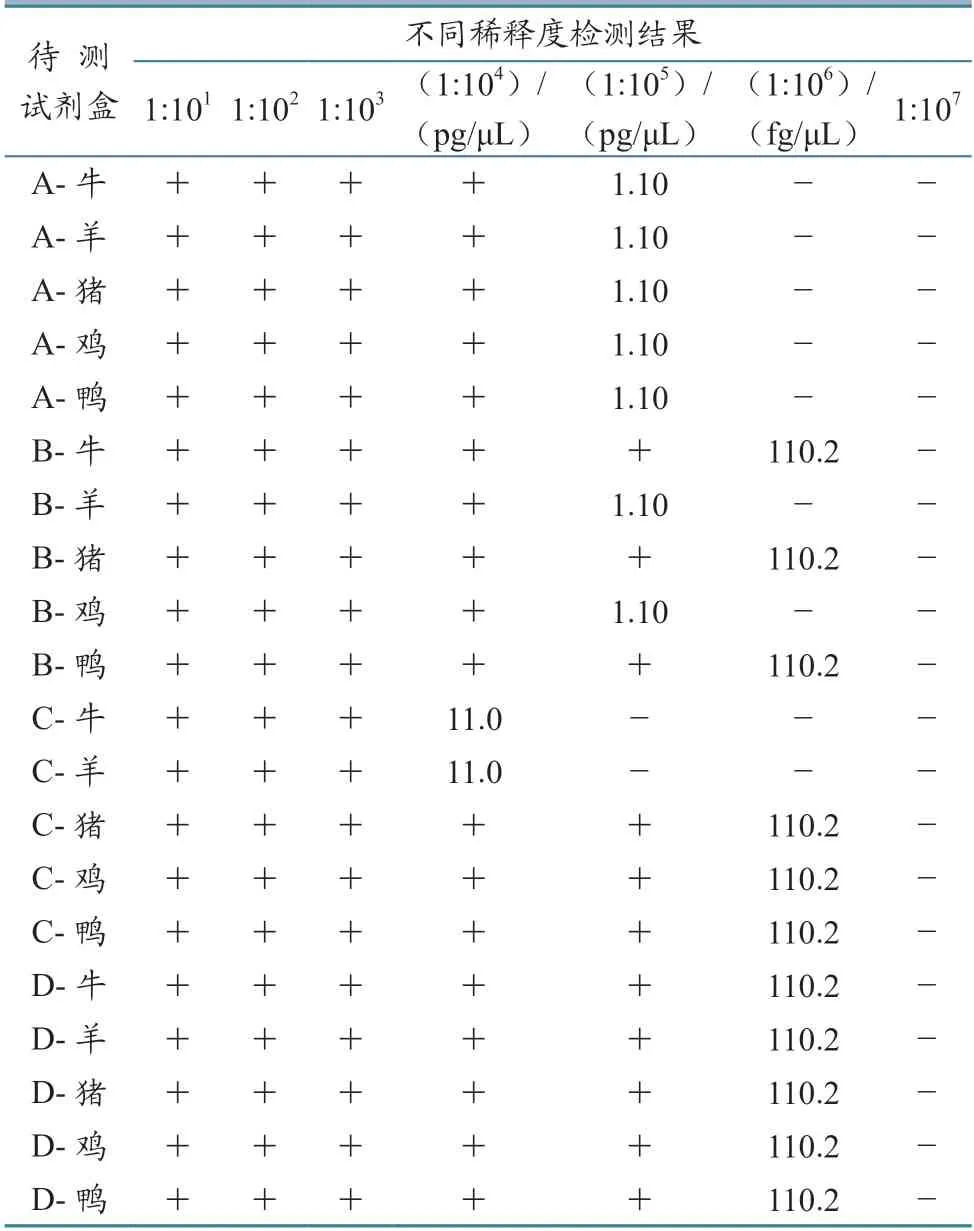
表6 各试剂盒检测混合样品最低检测限
2.4 成本和效率比较
分别计算4 种品牌试剂盒的反应时间及试剂耗材成本发现,不同品牌试剂盒的荧光PCR 检测时间及检测成本存在差异(表7):A 品牌试剂盒耗时最短,全程仅需52.5 min,总成本价66 元/份,价格适中;B 和C 品牌耗时均需80 min 以上,总成本价分别为62 和66 元,处于中间水平;D 品牌试剂盒耗时65.0 min,但是成本偏高,单份84 元。
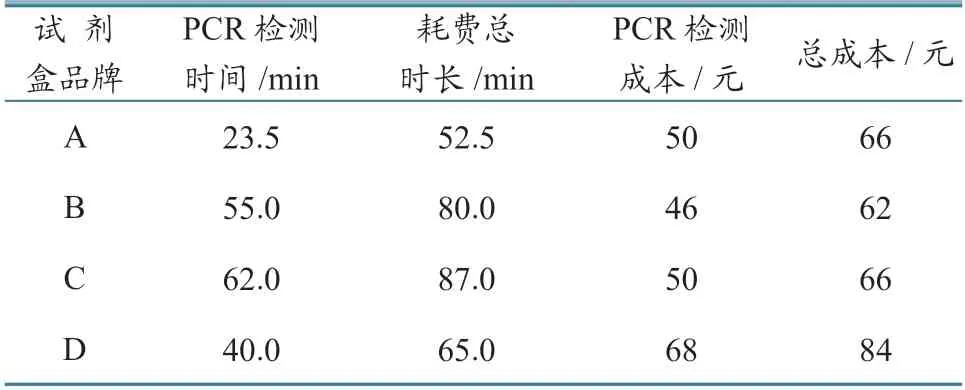
表7 4 种品牌试剂盒效率和成本比较
3 讨论
随着人们对生活品质的要求逐步提高,消费者越来越关注食用肉制品的质量问题,但市场上肉类掺假的现象屡见不鲜,引起了消费者及监管部门的广泛关注[1]。目前,已有显微镜法、PCR 法、荧光PCR 法、蛋白质谱及光谱学等多种肉类成分检测方法,其中荧光PCR 检测方法由于其灵敏、特异和快速等优点,已成为肉类成分检测领域的黄金标准,被广泛应用于肉类源性成分鉴别[3-4、9-11]。
本次研究分别从特异性、灵敏性、效率成本等方面,对市场上4 个品牌的5 种肉类成分荧光PCR 检测试剂盒进行了比较。经过试验,4 种品牌试剂盒特异性均较好,不同肉类之间没有交叉反应,与相关国家标准和行业标准的描述一致[6-8];而灵敏性则有较大区别,检测同一种肉类的不同品牌试剂盒灵敏性及同一品牌检测不同肉类的试剂盒灵敏性均存在差异,灵敏度高的可以达到fg 级别,差的只能到pg 级别,与王金斌等[9]、马炳存等[10]研究结果一致。分析原因,可能是由试剂盒的固有性能特征引起的,不同品牌的检测试剂追求的使用目的不同,有的追求高特异性,有的追求高灵敏性,这也是造成试剂盒间存在差异的根本原因。另外,不同品牌的试剂盒检测时间和成本也有差异,耗时短的试剂盒由于循环次数少,可能会存在弱阳性检出率低的情况,价格偏高的试剂盒通常灵敏度也要高一些,使用者可以根据试验目的和预算选择恰当的试剂盒。

