等温扩增技术概述及其在动物病原检测中的应用
禹兰平,王楷宬,潘俊慧,张富友,杨文静,周凯钰太,崔成都,孙福亮,王素春
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.延边大学,吉林延吉 133000;3.农业农村部动物生物安全风险预警及防控重点实验室(南方),山东青岛 266032)
随着全球家畜养殖规模不断扩大,动物疫病问题也越来越复杂,给养殖业带来巨大影响,对人类健康与公共卫生造成潜在威胁。对病原的及时检测,有助于及时控制动物疫病并减少损失。病原分离与鉴定是诊断动物疫病的金标准,但其耗时耗力,对实验人员和实验环境需求较高,还存在一定的生物安全风险[1]。聚合酶链式反应(polymerase chain reaction,PCR)是目前应用最广泛的病原检测技术。该技术可对病原核酸进行定性分析,而且特异性好、灵敏度高、准确率高,但须依赖精密的核酸扩增仪以实现不同温度的热循环扩增,多适用于实验室检测。20 世纪以来,等温扩增技术作为一种创新性病原核酸检测技术,得到逐步发展完善。此类技术可在一个恒定的温度下完成扩增反应,具有灵敏度高、特异性强、成本低、操作简单、耗时短等优点,可在野外环境下通过便携快速检测设备,用于动物疫病现场初筛。该技术与PCR 技术相结合,可为动物疫病的发现和处置争取时间,对动物疫病防控具有重要意义。本文从技术原理、优缺点及在动物疫病检测中的应用方面,对环介导等温扩增技术、重组酶等温扩增技术、依赖核酸序列的扩增技术、交叉引物等温扩增技术、赖解旋酶扩增技术等当前常见的几种恒温扩增技术进行分析总结,以期为动物疫病检测方法建立和防控策略制定提供参考。
1 环介导等温扩增技术
1.1 技术原理
2000 年,Notomi 等[2]研发了环介导等温扩增技术(loop-mediated isothermal amplification,LAMP),使用4~6 条引物通过BstDNA 聚合酶的链置换活性,对模板进行特定扩增。该方法有3 个反应阶段:第一,起始结构产生。外引物和内引物扩增出起始模板并限制扩增范围,同时为内引物提供扩增用模板。第二,哑铃状结构产生。内引物扩增的DNA 片段包含5'端DNA 的反向互补序列,而反向互补序列可以相互形成茎环结构;另一条内引物与互补序列退火杂交,经过链置换并合成后在扩增的DNA 片段另一端形成茎环结构,这样扩增后的片段拥有2 个茎环结构的哑铃状结构。第三,以上一阶段产生的哑铃状结构DNA 片段为模板进行循环扩增,最终生成重复并反向的茎环结构和多环花椰菜样结构的DNA 片段混合产物。
常用的LAMP 扩增产物检测方法有琼脂糖凝胶电泳、实时荧光、试纸条技术以及添加染料指示剂等。此外,LAMP 反应过程中,从脱氧核糖核酸三磷酸中析出的焦磷酸离子可与反应液中的镁离子反应而生成不溶于水的焦磷酸镁白色沉淀物,基于此设计了焦磷酸镁白色沉淀观察法、浊度检测法、金属离子指示法等检测方法。
1.2 优缺点和临床应用
LAMP 扩增技术简单高效,扩增反应和产物检测可一步完成,不依赖特殊设备,是目前发展较为成熟的等温扩增技术,在禽、羊、猪等动物的病原检测中都有应用(表1)。与传统的PCR 扩增反应相比,LAMP 技术耗时更短,扩增时间大多数在1 h 以内,灵敏度更高。但该方法对引物的设计要求较为复杂,需要的引物数量多,研发多重LAMP 检测方法有很大困难。该方法扩增后的产物呈花椰菜样结构,不适用于克隆测序,仅适用于结果的阴阳性判定。此外,若对产物进行琼脂糖凝胶电泳检测,就无法避免开盖检测问题,从而会产生气溶胶污染和结果假阳性问题,但结合实时荧光和染料指示剂能做到扩增反应结束即出检测结果,无需开盖,从而可以有效避免气溶胶污染问题,且操作简单,是目前较为常用的两种形式。例如,常攀峰等[3]建立的羊传染性脓疱病毒LAMP检测方法,通过在反应体系中添加染料指示剂,扩增反应结束时即可肉眼观察结果,不需要对产物进行额外操作,简化了操作流程,避免了气溶胶污染,灵敏度也是普通PCR 的10 倍以上,可作为羊传染性脓疱病毒的临床检测候选方式。有学者[4]建立了一些病原的RT-LAMP 检测方法,与已有的荧光RT-PCR 方法比较,两种检测方法灵敏度一致,但LAMP 方法特异性更强,耗时更短,阳性检出率更高,且对仪器依赖性低,更适用于病原的临床快速筛查。
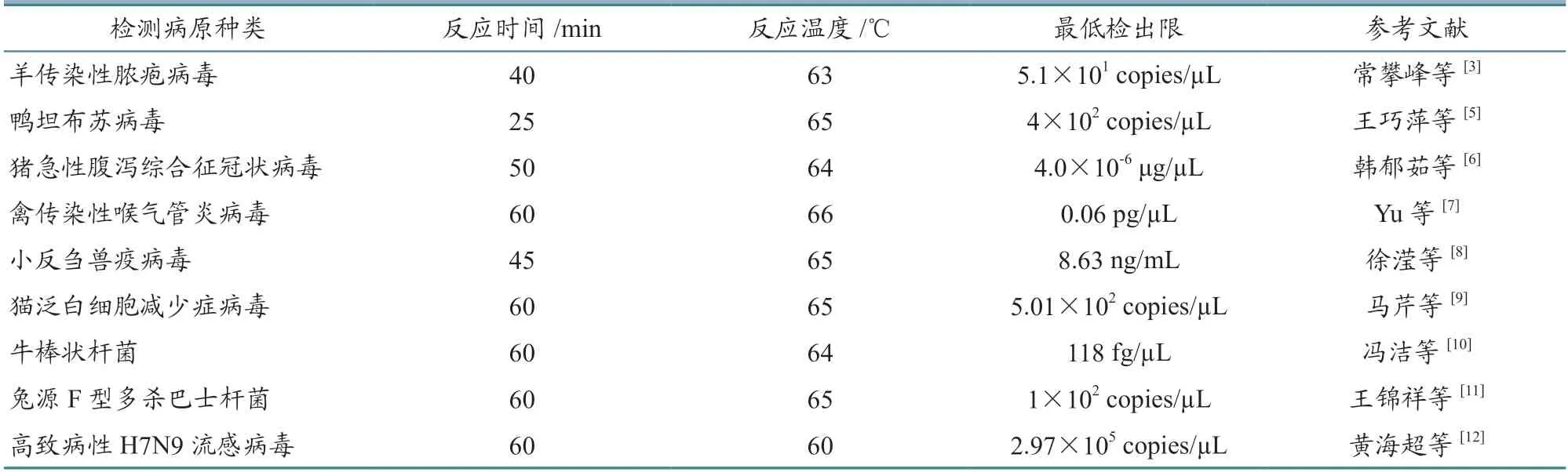
表1 LAMP 技术在动物病原检测中的应用举例
2 重组酶等温扩增技术
2.1 技术原理
重组酶等温扩增技术主要包括重组酶聚合酶扩增(recombinase polymerase amplification,RPA)和重组酶介导等温扩增(recombinase aid amplification,RAA)[13-14]。
RPA 是Piepenburg 等[15]在2006 年建立的方法,其扩增原理是先利用T4 类噬菌体中的重组酶蛋白UvsX 与特异性引物结合,形成重组酶-引物复合体,再对双链DNA 进行扫描和识别,识别到同源序列后,复合体插入双链DNA 形成D-环结构;为了防止新链和之前的母链配对,单链结合蛋白(gp32)与置换出的单链DNA 结合,随后ATP水解供能,使重组酶-引物复合体分解,在引物3'端与DNA 聚合酶结合并进行复制和延伸。RAA 扩增原理与RPA 相似,其创新点在于扩增反应中使用的重组酶来自细菌或真菌。这类酶来源更广泛,对温度的适应性更强,因而提高了反应稳定性,降低了试剂成本。
重组酶等温扩增技术的基础扩增产物可以通过凝胶电泳法进行鉴定,也可以结合荧光探针或荧光染料,实现扩增反应和结果判定一步化。此外,该方法还可以结合胶体金试纸条技术,实现对病原核酸的快速检测。
2.2 优缺点和临床应用
重组酶等温扩增技术在我国一直拥有很大的研究热度,研究人员已建立了禽、猪、牛等多种家畜的病原检测方法(表2)。该技术在检测过程中不受场地条件约束,5~30 min 即可完成扩增反应,反应温度(37~42 ℃)与人体温接近,甚至可以夹在腋下或握在手中进行反应。该方法操作简单,灵敏度高,且与LAMP 相比,扩增时间更短,反应温度更低,更容易实现现场快速检测。此外,RAA 方法将反应过程中用到的多种酶,按照需求量冻干在反应管中,这样既方便运输,又保证了酶的活性。
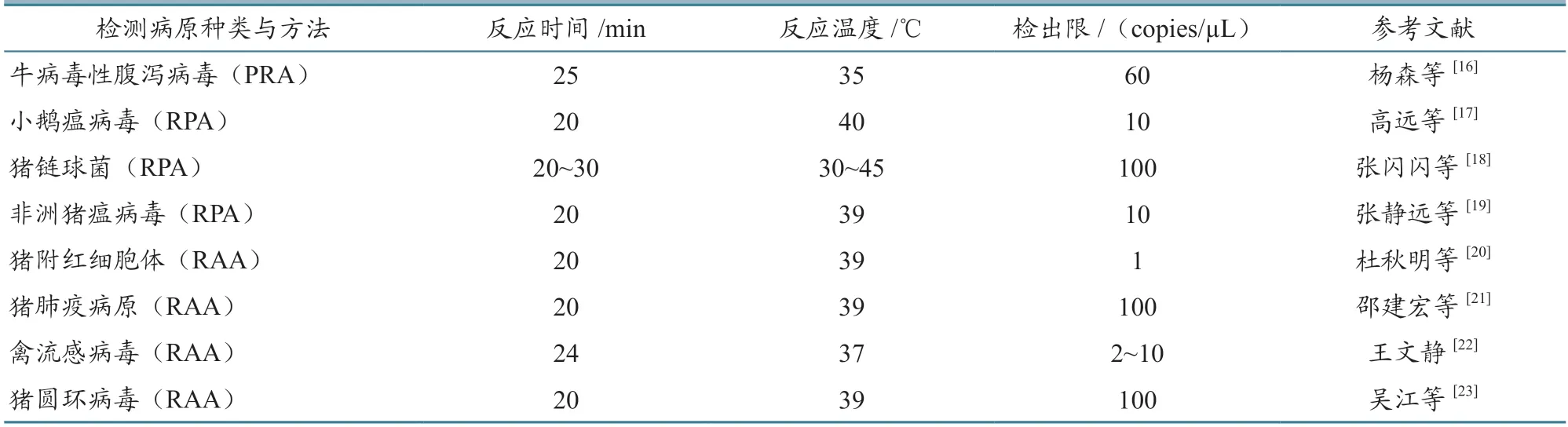
表2 重组酶等温扩增技术在动物病原检测上的应用举例
重组酶等温扩增技术一般用于实验研究。该方法的扩增产物需要通过琼脂糖凝胶电泳进行检测,可能会出现拖带现象,且容易出现气溶胶污染,因此在检测前需要对扩增产物进行反应阻断和纯化处理。将重组酶等温扩增技术结合荧光探针法,可以实时显示扩增结果,既提高了检测灵敏度和特异性,又缩短了反应时间,是目前较为常用的方式。但是该方法对引物和探针有特定要求,引物长度一般为30~35 bp,探针长度一般为46~53 个碱基,在探针设计时需要找出适合标记荧光信号、淬灭基团和四氢呋喃分子位点,设计要求较复杂,目前还没有专门设计这类探针的软件,只能依靠技术人员进行人工操作。
3 依赖核酸序列的扩增技术
3.1 技术原理
依赖核酸序列的扩增技术(nucleic acid sequence-based amplification,NASBA)由Compton[24]在1991 年建立,是一种在42 ℃条件下,由1 对特异性引物介导,在禽源成髓细胞瘤逆转录酶、核糖核酸酶H、噬菌体T7 RNA 多聚酶的共同作用下完成的连续等温扩增反应。该方法大致包括5 步:(1)引物Ⅰ与RNA 模板链3'端结合;(2)禽源成髓细胞瘤逆转录酶合成反义的DNA 链,形成DNA-RNA 杂交链;(3)核糖核酸酶H 降解杂交链中的RNA,留下DNA 链;(4)引物Ⅱ与DNA 的5'端结合;(5)噬菌体T7 RNA 多聚酶合成补偿链,进入第一步,开始循环反应。
目前扩增产物的初步鉴定主要是在琼脂糖甲醛变性凝胶电泳后用染料染色,并在紫外灯下观察片段长度或进行荧光检测[25]。在《禽流感病毒NASBA 检测方法》(GB/T l9440—2004)中,扩增后的产物用Nuclisens 阅读器进行检测,其原理是根据上游引物5'末端含有噬菌体T7 的依赖于DNA 的RNA 聚合酶起动因子序列,下游引物5'末端含有钌标电化学发光检测探针互补序列,在扩增过程中既能产生互补RNA 序列的模板,又能特异性结合检测步骤中的ECL 探针。此外,还可以使用与酶联免疫吸附测定结合建立的寡核苷酸检测[26]。
3.2 优缺点和临床应用
NASBA 技术扩增效率与RT-PCR 相当,保真度高,扩增产物不易污染实验室环境和物品,能有效避免交叉污染导致的假阳性。该方法将反转录和扩增反应合并到一起,缩短了反应时间,适合扩增RNA;如果扩增DNA 模板,则需要在反应过程中添加变性步骤[27]。
在NASBA 技术的早期发展过程中,研究者建立了部分畜禽和水生动物病原检测方法(表3)。我国2004 年发布了两项应用该技术进行病原检测的国家标准——《H5 亚型禽流感病毒NASBA 检测方法》(GB/T 19439—20040)和《禽流感病毒NASBA 检测方法》(GB/T l9440—2004),填补了禽流感病毒快速检测标准的空白。然而该技术在反应过程中需要用到3 种酶,因而反应成本偏高。与LAMP 和重组酶等温扩增技术相比,该方法耗时更长,并且反应过程中需要2 种温度,配备2 种反应液,操作过程相对复杂。随着技术缺点的逐渐凸显,利用该技术进行的疫病检测研究逐渐减少。
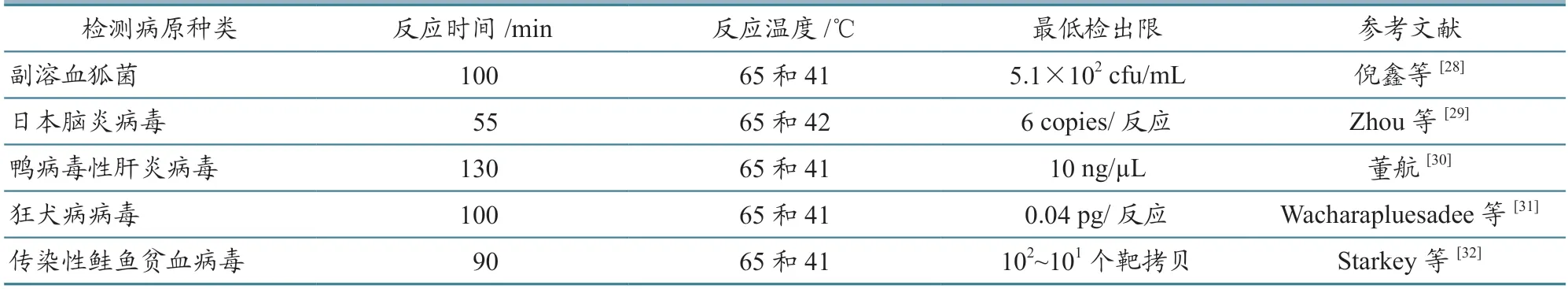
表3 NASBA 技术在动物病原检测上的应用举例
4 交叉引物等温扩增技术
4.1 技术原理
交叉引物等温扩增技术(crossing priming amplification,CPA)由杭州优思达生物公司研发,是我国第一个具有自主知识产权的核酸扩增技术[33]。该方法在63 ℃条件下,通过BstDNA 聚合酶、甜菜碱和交叉引物进行扩增,按照交叉引物数量的不同,可分为双交叉引物扩增(2 条交叉引物、2 条剥离引物)和单交叉引物扩增(1 条交叉引物,2 条剥离引物和2 条普通引物)。双交叉引物扩增是2 条交叉引物与模板互补结合并延伸后,由2 条剥离引物通过BstDNA 聚合酶剥离新合成的单链,被剥离的新单链成为模板并生成大量扩增产物。单交叉引物扩增是1 条交叉引物与模板结合并延伸形成双链,随后2 条剥离引物通过BstDNA 聚合酶剥离新合成的单链,2 条普通引物以被剥离的新单链为模板合成2 条长度不等的单链DNA,最后以这2 条单链DNA 为模板进行大量扩增。扩增产物通过胶体金试纸条技术可实现快速检测,也可通过添加染料指示剂或琼脂糖电泳进行检测。
4.2 优缺点和临床应用
CPA 技术操作相对简单,灵敏度高,特异性好,在63 ℃左右反应1 h 即可完成扩增。该技术的反应时间和反应温度与LAMP 方法相似,自问世以来,已经在禽、牛、猪等多种动物的病原检测中得到应用(表4)。但CPA反应体系配制过程相对繁琐,通过添加染料指示剂实现可视化结果判定时,对弱阳性结果存在一定的主观误差,容易造成假阳性或假阴性。

表4 CPA 技术在动物病原检测上的应用举例
5 赖解旋酶扩增技术
5.1 技术原理
赖解旋酶扩增技术(helicase dependent amplification,HDA)是由美国New Englang Biolabs 公司发明的一种模拟动物体内DNA 复制的新技术[41]。HDA 技术扩增反应主要包含5 个阶段:(1)利用解旋酶打开DNA 双链,使其变成游离的单链形式;(2)结合蛋白与解旋后的DNA 单链结合,以阻止互补链再结合;(3)利用2 条特异性引物和单链靶DNA 杂交,通过DNA 聚合酶延伸和模板退火的引物生成双链DNA;(4)新合成的双链DNA 作为DNA 解旋酶的底物进行下一步的扩增和循环,实现产物的大量扩增;(5)扩增完成后,可通过琼脂糖凝胶电泳、荧光DNA 结合剂、荧光和电化学等方法进行检测。
5.2 优缺点和临床应用
与其他等温扩增技术相比,HDA 技术仅需要2 条普通引物,且引物设计相对简单。但该方法的反应体系较为复杂,方法优化会受体系限制,且反应过程大部分需要分两步在2 个不同温度条件下完成,反应时间多为1~2 h,并不具备优势。该方法主要用于环状DNA 扩增,可以同时完成基因扩增和基因筛选[42],且扩增产物是均一的,可以直接用于测序,但是反应体系中解旋酶解旋的速度是有限制的,因此不适合扩增长序列。
在动物病原检测方面,已建立了一些HDA 检测方法(表5)。但是受多种因素影响,该技术在病原检测方面没有得到广泛应用。

表5 HDA 技术在动物病原检测上的应用实例
6 小结
5 种等温扩增技术,在不同方面都有自己的特点。在引物设计方面,LAMP 和CPA 技术需要设计2 条以上引物,引物设计难度与要求相对于其他3 种更高。在配制体系方面,NASBA 技术在反应过程中需要中途加入酶反应液,HDA 技术需要配制A、B 两种反应体系,其他3 种技术只需要配制1 种即可进行反应。在反应温度方面,LAMP、RPA、RAA、CPA 技术在整个扩增反应过程中仅需要1 个恒定温度即可,而NASBA 和HDA 技术需要2 个甚至3 个反应温度,反应过程相对复杂。在反应时间方面,RPA 和RAA 技术最具有优势,5~20 min 即可完成扩增检测,而其他3 种等温扩增技术反应时间普遍在1 h 左右。在产物检测方面,5 种技术均可通过琼脂糖凝胶进行扩增产物检测,但是这种方式容易产生气溶胶污染。RPA 和RAA技术可以结合荧光探针法,通过荧光信号进行实时检测,反应过程无需开盖,避免了污染问题。LAMP 和CPA 技术可通过在反应管盖上加入染料指示剂,反应结束后来回翻转使反应液与指示剂混合均匀,通过颜色变化来判断反应阴阳性,从反应开始到结果判定全程封闭,可避免气溶胶污染并且降低假阳性概率。NASBA 可以通过ECL 阅读器来判断反应是否扩增。5 种等温扩增技术也可以通过试纸条、胶体金和核酸扩增物快速检测板等检测方法实现肉眼可视化检测,但是把产物加入到试纸条检测并等待结果这一阶段时间容易产生气溶胶污染,因此市面上也出现了独立封闭的试纸条容器,反应管无需开盖直接放入容器进行检测,这样可有效降低检测结果假阳性概率,但其成本高于普通的试纸条,主要用于宠物或经济价值较高动物的疫病快速检测。
7 前景与展望
在动物疫病防控工作中,快速、高效、简单、便捷的病原检测方法,可以及早发现疫病并减少因疫病造成的损失,对促进我国养殖业健康发展起重要作用。等温扩增技术自问世以来,因其特有的技术优势而备受关注。近年来,等温扩增技术得到不断发展和创新,相关病原检测方法也层出不穷。
至今,我国已开发出多种商业化等温扩增检测试剂盒,并申请了相关专利[48-51],使等温扩增技术得到了进一步推广和应用。但是等温扩增技术作为一种新兴技术,虽然具备许多优点,也面临着诸多挑战,仍需要不断改进,例如在反应成本、反应过程稳定性、操作简便性等方面。因此,基于何种情况选择何种检测技术,需要根据不同需求和场景条件来选择。此外,等温检测技术还可以借助自身优势,与微流体芯片、纳米金、CRISPR 等技术联合应用,建立更加快捷、准确、简便的检测方法,从而为动物疫病检测提供更好的服务。

