一例由粪肠球菌感染引起的鸭死亡病例诊断
刘 云,徐小艳,陈昌海,邱冬,董永毅,羊扬
(1.江苏省动物疫病预防控制中心,江苏南京 210036;2.扬州大学兽医学院,江苏扬州 225000)
粪肠球菌(Enterococcus faecalis,E.faecalis)是一种广泛存在于动物肠道的条件致病菌,属于兼性厌氧革兰氏阳性菌,同时也是人兽共患病原菌之一[1]。粪肠球菌会导致禽败血症及腹泻等症状[2],不仅危害动物健康,还威胁人类公共卫生安全[3]。有研究发现,粪肠球菌已逐渐成为人兽共患病原菌中的第二大革兰氏阳性菌[4],在医院分离出的致病菌中,粪肠球菌排名前三[5]。2022 年3 月,江苏省某养殖户饲养的青年鸭突然出现不明原因发病和死亡。研究人员对病例进行了流行病学调查和临床剖检,并采集病料进行了实验室病原学检测,证实该起死亡病例是由粪肠球菌感染引起。本研究为进一步探究粪肠球菌感染的诊断和防治提供了技术支撑。
1 流行病学调查及剖检病变
该养殖户共饲养鸭1 800 只,调查时现栏存鸭中仍有发病鸭13 只。经现场查看,鸭场附近有池塘,饲养环境不佳。据农户口述,鸭群在21 日龄时接种过重组禽流感病毒(H5+H7)三价灭活疫苗。鸭群在调查1 周前开始发病,病鸭表现为歪头斜颈、食欲不振,后期有绿色稀便,当天死亡2 只,另有3 只呈神经症状。现场剖检病鸭5 只,发现肝脏呈肿大、质地变脆、有纤维素性渗出物等病理变化。
2 实验室诊断
2.1 主要试剂与仪器
麦康凯琼脂平板、营养肉汤、胰酪大豆胨液体培养基(TSB)、绵羊血平板、革兰氏染色液、DNA/RNA 提取试剂盒、禽流感病毒实时荧光RT-PCR 检测试剂盒、全自动微生物分析系统、MALDI Biotyper 全自动快速生物质谱仪、生物安全柜、恒温培养箱等。
2.2 病料采集
无菌采集1 例发病死亡鸭心脏,用无菌袋密封后放于采样箱中,并尽快送回实验室,置于-20 ℃冰柜中保存备用。
2.3 实验室检测
2.3.1 禽流感病毒检测 取病变明显的心脏样品1 份,经充分研磨后离心取上清,按照RNA 提取试剂盒说明书提取病毒RNA,按照禽流感病毒实时荧光RT-PCR 检测试剂盒说明书配制反应体系,对样本RNA 进行检测,同时设立阴、阳性对照。
2.3.2 细菌分离 火焰灼烧接种环后插入样品组织内部,无菌沾取组织液,划线接种于绵羊血平板和麦康凯琼脂平板,于37 ℃恒温培养箱中培养过夜;挑取形态特征一致的单个菌落再次接种于上述两种培养基,观察菌落生长情况和形态特征;至细菌生长状态稳定且良好后,挑取单菌落接种于TSB 或血平板中增殖备用[6-7]。
2.3.3 染色镜检 挑取培养板上的典型单菌落涂抹于载玻片上,按照革兰氏染色说明书要求,对细菌实施染色,镜检观察染色结果,并结合细菌生长特性和染色结果进行初步判定。
2.3.4 全自动微生物分析系统鉴定 根据染色镜检结果,参照全自动微生物分析系统SOP,选择相应的鉴定卡片;同时按照操作指南的培养要求对镜检细菌进行培养,配置菌悬液并且调整为合适的菌液浓度后,进行全自动微生物分析鉴定。
2.3.5 微生物质谱鉴定 挑取单菌落涂抹于金属鉴定板上,滴加1 μL 70%甲酸晾干后,滴加1 μL 基质溶液;将金属鉴定板放入真空仓,应用MALDI Biotyper微生物快速鉴定质谱仪进行鉴定。
2.3.6 16SrDNA测序按照DNA提取试剂盒说明书提取细菌DNA,扩增16S rDNA 基因进行测序。16S rDNA 的通用上游引物为5'-AGAGTTTGATCCTGGCTCAG-3',下游引物为5'-GGCTACCTTGTTACGACT-3'。PCR 扩增体系及反应程序参照文献[8]进行。PCR 扩增产物经琼脂糖凝胶电泳检测,阳性PCR 产物连接载体,转化感受态,将鉴定为阳性的重组菌液送至生物公司测序,并将所得序列与GenBank 数据库中的序列进行比对分析。
2.3.7 雏鸭致病性试验 将10 只1 日龄雏鸭饲养3 d 后随机分成两组,每组5 只。试验组采取肌肉注射方式接种预制的细菌悬液0.2 mL/ 只(7.0 ×108CFU/mL);对照组雏鸭采取相同的方式注射TSB 0.2 mL/只。两组雏鸭接种后放于同等条件下进行常规饲养,观察记录发病死亡情况。
3 结果
3.1 禽流感病毒检测
结果(图1)显示,阴、阳性对照均成立,而待测样品无Ct值,说明样品为禽流感病毒核酸阴性。
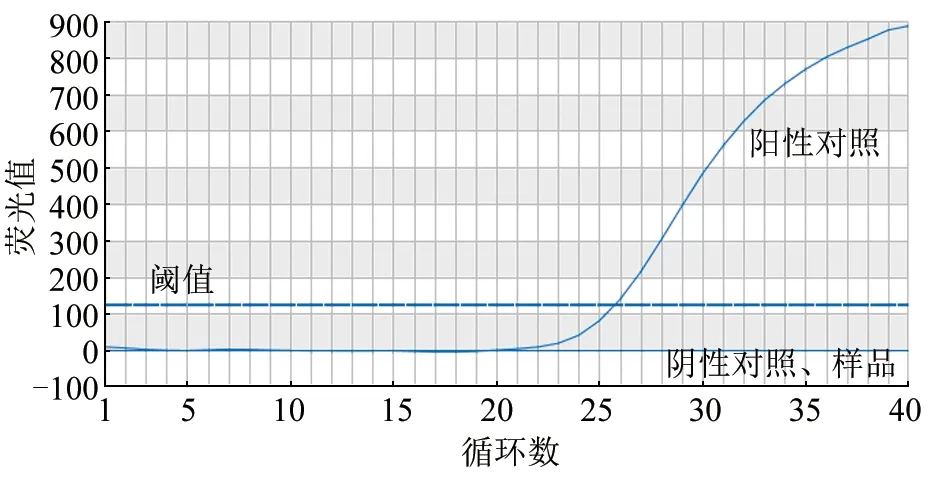
图1 禽流感病毒荧光定量RT-PCR 检测结果
3.2 细菌分离
从心脏中分离的细菌经过37 ℃恒温过夜培养后,在绵羊血平板上呈灰白色、不透明、表面光滑的菌落(图2-A),在麦康凯琼脂平板上不生长[9](图2-B)。

图2 菌落培养形态
3.3 染色镜检
结果(图3)显示,在显微镜下,细菌染色后呈紫色,圆形或椭圆形,呈链状或成对排列。
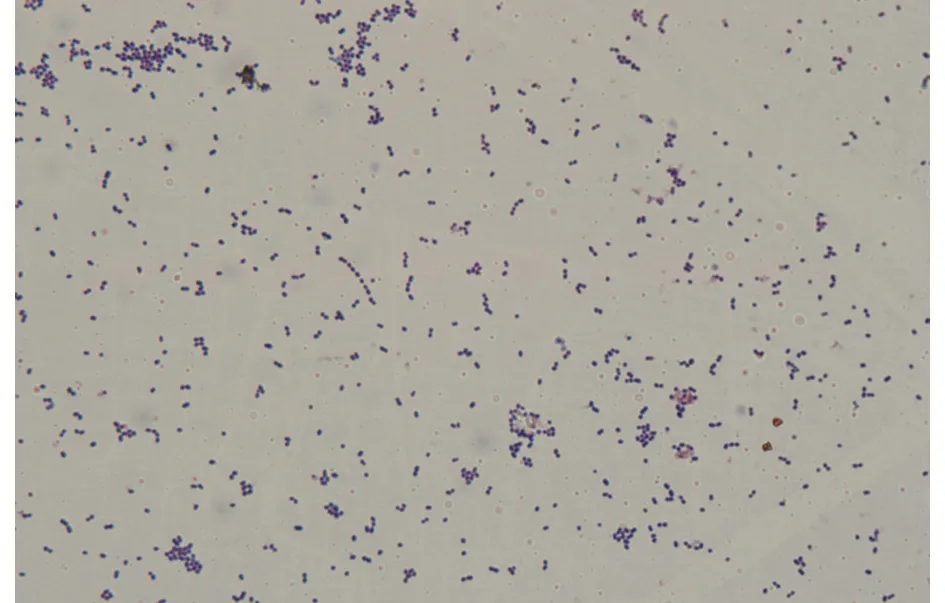
图3 染色镜检形态
3.4 全自动微生物分析系统鉴定
将鉴定卡片放入全自动微生物分析系统进行分析,经对照VITEK 2 Systems 细菌鉴定目录,确认分离的细菌为粪肠球菌(图4)。
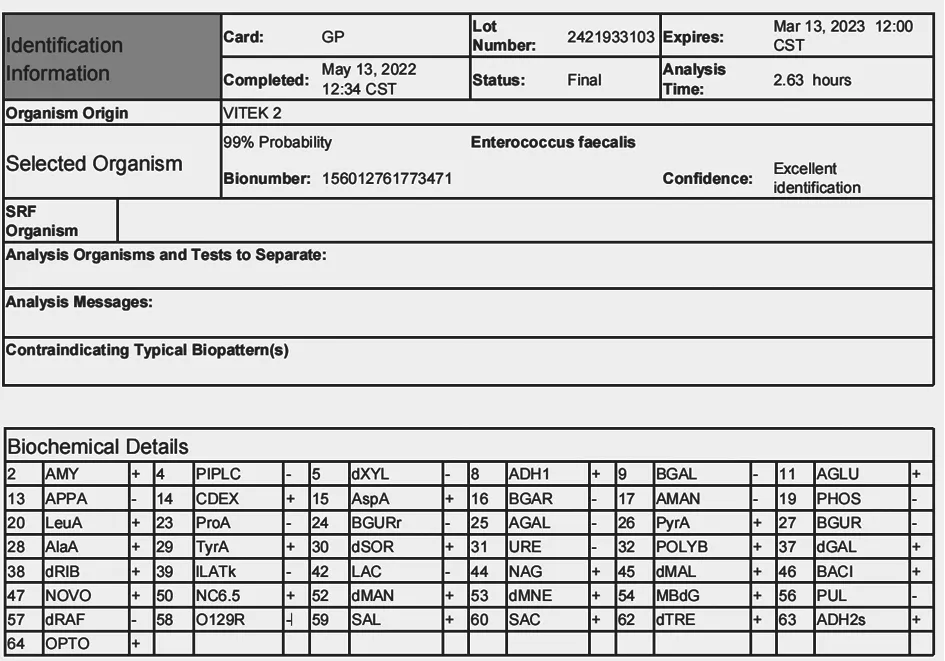
图4 全自动微生物分析系统鉴定结果
3.5 微生物质谱鉴定
将待测的指纹图谱与菌种库中的标准指纹图谱进行比对,分数>2.0,代表结果可靠[10],确认分离的细菌为粪肠球菌(图5)。

图5 微生物质谱鉴定结果
3.6 16S rDNA 测序
结果(图6)显示,目的条带大小约1 426 bp。将扩增产物与粪肠球菌参考株(GenBank 登录号为MN833019.1)进行序列比对,同源性达99.86%。
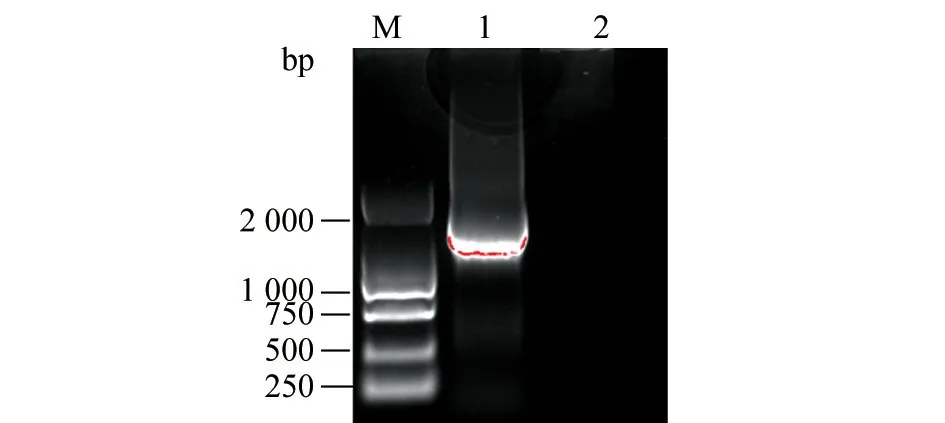
图6 16S rDNA 扩增结果
3.7 雏鸭致病性试验
试验组雏鸭接种菌液3 d 后,有2 只出现临床症状,主要表现为精神沉郁、不思饮食、羽毛蓬乱、喜卧恶动、扎堆昏睡、眼睑浑浊、排绿色稀便;接种后5 d,试验组5 只鸭均发病,至14 d 试验结束时,1 只鸭死亡。对照组雏鸭在观察期内均正常活动,无发病死亡现象。剖检发现,试验组雏鸭心脏和肝脏有轻微的纤维素性渗出。
4 防治措施
4.1 加强日常饲养管理
预防粪肠球菌感染要提高鸭群的饲养管理水平,消除发病诱因。重视饲料和饮水的清洁卫生,根据鸭群的生长阶段、发育情况等科学配比饲料,尤其是要控制好微量元素、矿物质、维生素等成分,提高群体抵抗力。合理控制饲养密度,使饲养密度不超过10 只/m2。配备智能温控系统或安装温湿度感应器,监测并调整栏舍内温湿度。做好栏舍通风换气工作,有效降低有毒有害气体(如氨气)浓度。加强消毒,使用0.2%~0.5%的过氧乙酸水溶液对垫料、笼框、场地等进行喷洒消毒等。
4.2 做好生物安全防控
把好引种关,经检疫合格后引进健康鸭群,做到不从疫区引种,防止引入疫病,引进的雏鸭隔离饲养15~30 d 后,再混群饲养。隔离传染源,对来往车辆以及场区周边环境、工作人员的随身物品等展开严格消毒,限制外来人员进入养殖区域。杜绝鸟、鼠等动物与鸭群接触。
4.3 科学合理用药
粪肠球菌感染属于细菌性疫病,抗生素治疗有一定效果。临床上粪肠球菌对多种抗生素敏感,例如红霉素、新霉素以及头孢类药物等,用药前建议先进行药敏试验。本病例使用硫酸新霉素(质量分数为0.01%~0.02%,连饮3 d)进行饮水治疗,同时对重症病鸭用庆大霉素(3 000~5 000 国际单位/kg)加阿莫西林(20~50 mg/kg)混合注射,1 次/d,连用3 d。采取上述防治措施6 d 后,鸭群恢复健康。
5 讨论
本病例发病突然,为此研究人员首先采集病料进行了禽流感病毒实时荧光RT-PCR 检测,排除了禽流感。粪肠球菌的某些菌株会引发禽败血症及腹泻等症状[11-12],在临床上很容易与鸭传染性浆膜炎、鸭流感、鸭病毒性肝炎混淆。鸭传染性浆膜炎患鸭一般两腿无力、无法站立,头颈乱摆,身体后翻或者朝一侧倒,做转圈运动;鸭流感患鸭头和颜面部水肿,皮肤发绀,有的表现神经症状及下痢;鸭病毒性肝炎患病雏鸭常伏地、缩颈,蹬脚做划桨动作,病鸭在3~4 d 内死亡,死亡时头后仰,呈角弓反张状。因此,本研究采集了发病鸭心脏组织,通过实验室病原学检测,成功分离并鉴定致病菌为粪肠球菌,并确认该起病例由粪肠球菌感染引起。2008 年江苏省扬州市宝应县曾报道过一起鸭粪肠球菌感染[13],但粪肠球菌是否在扬州市存在地区性流行有待进一步研究。本病例为粪肠球菌感染鸭并引起发病提供了新的证据,确认了粪肠球菌感染鸭的事实。同时也提醒广大养殖户在实际生产过程中,要提高对粪肠球菌感染的重视程度,做好日常饲养管理,预防粪肠球菌感染的发生。
下一步,将对江苏省其他地区水禽粪肠球菌感染以及其他常发细菌病展开调研并对菌株进行耐药性研究,以摸清流行情况并指导江苏省养殖户用药,确保鸭产业的高效健康发展。

