基层兽医实验室样品采集、工作中必须注意的问题与建议
姚奕蕾(甘肃省动物疫病预防控制中心,甘肃 兰州 730046)
基层兽医实验室样品采集、工作中必须注意的问题与建议
姚奕蕾
(甘肃省动物疫病预防控制中心,甘肃 兰州730046)
摘要:样品采集、包装与运送工作是基层兽医实验室承担的一项经常性的重要工作。此项工作技术含量不高,但其过程中的好多要素和细节会直接影响检测结果的准确性和检测结论的科学性。本文主要从采集方法、部位、种类、数量、样品质量、包装、运送以及人员防护等方面分别进行阐述和分析,对科学全面掌握系统化的样品采集与运送工作、提高检测结果的准确性和检测结论的科学性具有重要的指导意义。
关键词:样品采集;病料;包装;运送;人员防护
样品采集、运送工作是基层动物疫病预防控制机构在动物疫病防控工作中承担的一项经常性的重要工作。该项工作中采样方法、部位、种类、数量、样品质量、包装和运送等每个环节都会直接影响检测结果的准确性和检测结论的科学性。但是,由于基层动物疫病预防控制机构对样品采集工作认识不到位,机构改革致命人员频繁流动,加之实验室工作相对艰苦、人员素质参差不齐或非专业人员等原因,使得样品采集工作在具体实施和实际操作中存在很多问题,不但影响了检测结果的准确性和检测结论的科学性,而且对相关人员的健康安全构成严重的威胁。笔者就采样工作的相关要求和多年从事样品采集工作的经验分析如下。
1 样品与病料的概念
1.1样品(sample)
取自动物或环境,拟通过检测反应动物个体、群体或环境有关状况的材料或物品。
1.2病料(specimen)
来自患病或可疑患病动物的被(待)检样品。
2 样品采集人员要求
必须是具备动物传染病感染、传播、流行与预防的相关知识,熟练掌握采样方法和动物保定技术,熟悉样品采集与采样器具使用的兽医专业技术人员。并熟悉《动物疫病实验室检验采样方法》(NY/ T 541-2002)和《高致病性动物病原微生物菌(毒)种或者样本运输包装规范》。
3 样品(病料)采集的标准依据
根据不同检测目的,样品分用于免疫抗体检测和疫病诊断检测(即病料)两类;前者通常指血清,而后者通常指病料。样品采集必须严格执行《动物疫病实验室检验采样方法》(NY/T 541-2002)。
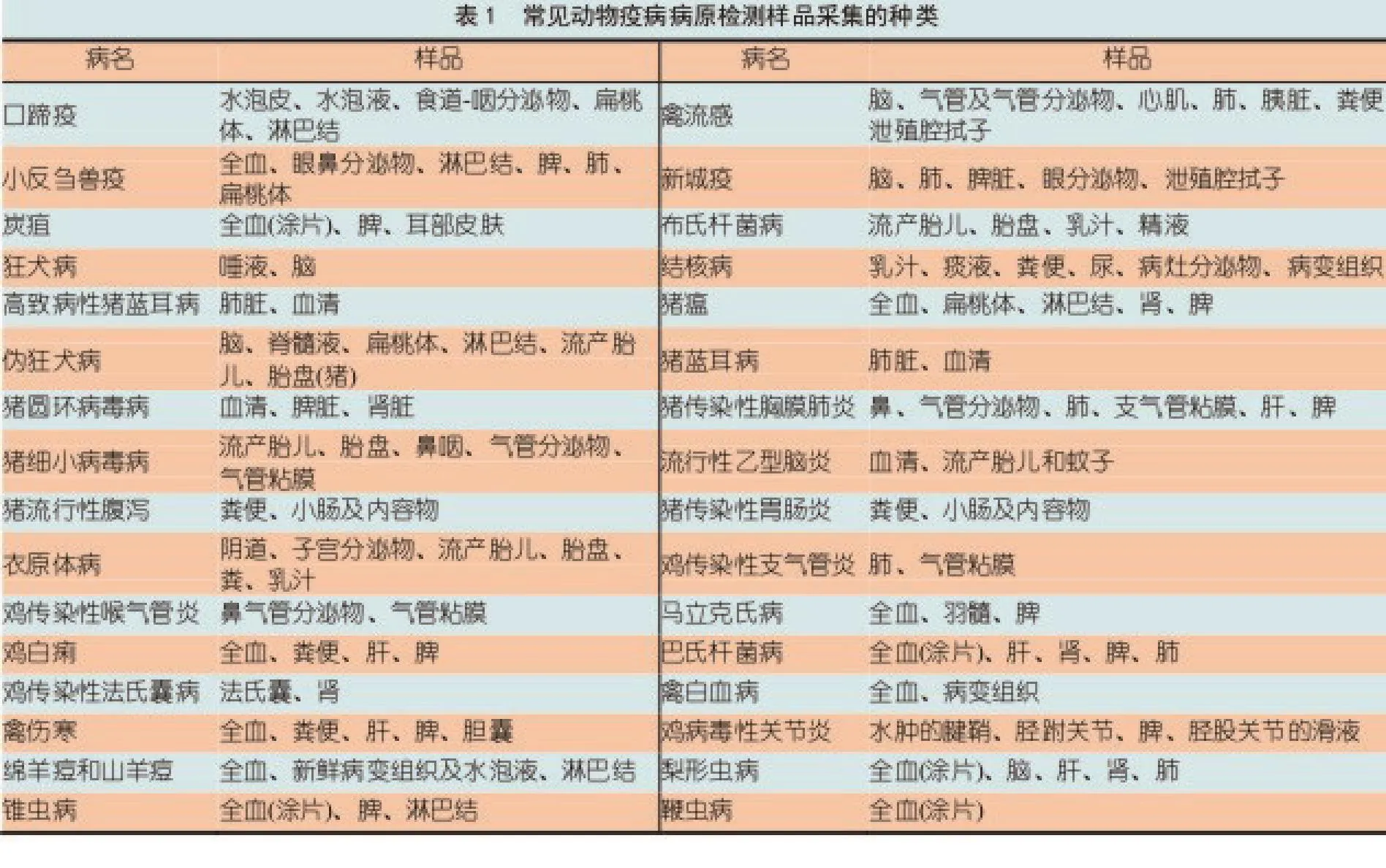
4 动物疫病病原检测样品采集的种类
常见动物疫病病原检测样品采集种类见表1。其他动物疫病样品采集种类应参阅相关国家标准或资料。
5 样品采集数量的确定
5.1免疫抗体检测用血清
应坚持随机采样与固定采样相结合的原则。样品采集采用随机抽样的方法进行,使所采样品具有群体代表性。对被采集样品的畜禽个体和样品本身进行编号。跟踪检测可实现对群体相应指标的动态监控,对研究动物疫病免疫抗体水平随时间变化的规律并以此指导免疫工作具有重要意义。100头/只规模以下,至少应采集10份;100头/只以上规模,每群采集数量不少于20份;每份血清禽类最好不少于500 μL,畜类不少于800 μL;
5.2疫病诊断检测用样品
疫病诊断检测用样品即病料,包括血清、全血和血涂片、组织病料、渗出液、排出物、分泌液等,具体详见《动物疫病实验室检验采样方法》(NY/T 541-2002)。每群畜类不少于2~3头/只,禽类不少于5羽的相应样品。组织样品禽类每份不应少于2 g,雏禽脾脏、胰脏等病料建议完整取样;畜类每份不少于5 g,厚度最好不要小于1 cm,液体病料不应少于5 mL,用于保存棉拭子的PBS液以淹过棉拭子为准,最少不应少于1 mL;流行病学监测样品群采集数量详见农业部印发的年度《国家动物疫病监测与流行病学调查计划的通知》。
6 样品采集、保存与运送过程应注意的问题
6.1血清样品注意事项
6.1.1采血器械
使用有效期内的一次性注射器、真空采血管(器)、1.5 mL、5 mL和10 m L的塑料离心管;
6.1.2扎针
采样人员应熟练掌握采血技术,选准采血进针点,掌握好进针方向、角度和深度;针尖进入血管后顺着血管方向向前推进,否则易刺穿血管引起血肿。特别是采集雏鸡等小型畜禽个体翅血液时要格外小心,由于其血管细、管壁薄容易刺穿,刺穿后立即停止采血并按压止血1 min~3 min,更换采血部位或个体重新采。但应注意同一个体多次采样不成功会引起养殖户反感,后续采样工作将可能受到影响或无法以完成;
6.1.3采集血液的转移
用注射器采集的血液尽快转移到离心管中,转移时血液时沿管壁缓慢注入,不要用力挤压、震荡,否则易造成细胞破裂发生溶血进而影响检测结果;倾斜静置离心管让血清自然析出。需离心分析血清速度不应超过3 000 rpm,样品禁止置于阳光下曝晒或户外受冻造成溶血;用真空采血管采集血液样品时选用不含抗凝剂或含促凝剂或分离胶的真空采血管。
6.2全血样品采集注意事项
用一次性注射器(采血器)采集抗凝血时,可事先在注射器内吸入少量抗凝剂。血液采出后来回颠倒注射器,以让血液与抗凝剂混匀,然后转移到加抗凝剂的离心管再次颠倒混匀。用真空采血管采血应选用含枸橼酸钠或EDTA抗凝剂的真空采血管。
6.3用于血涂片检查的血液采集注意事项
采血部位采用酒精消毒,等酒精完全挥发后,或直接用干棉签擦净后方可采集,血液量以绿豆大小为宜,玻片应经2 %~3 %盐酸处理。
6.4病料样品采集注意事项
(1)选择正在发病具有明显临床症状的畜禽个体,采集病变组织和健康组织交界处组织;流行病学监测用样品采用随机抽样的方法进行样品采集,使所采样品具有群体代表性;
(2)一般情况下用于病原检测的样品每份不要多于50 g,多于50 g不便于包装、运输及检测取样,所用采样器械和盛装容器应经过消毒;
(3)采样前对采样环境喷洒消毒液降尘,吹风时进行顺风向采样,尽量保持采样全过程无菌;
(4)每种病料样品先独立包装后,同一个体的样品一同包装,同群样品一起包装。
6.5样品的保存与运送
6.5.1保存
(1)样品编号选用油性记号笔。水性记号笔编写的号码常因样品保存和运输过程中温度变化形成的冷凝水汽使号码消失;
(2)编号应尽量做到唯一,避免检测时,不同包装袋里同一个编号的样品放在一起发生无法辨认的现象;
(3)计划24 h内开展检测或送检的样品应作冷藏保存;24 h以上检测或送检的血清样品应作冷冻保存。用于病原检测的组织或液体样品冷藏保存,并要求于24 h内送到检测实验室;
(4)填写样品采集和送检信息单,样品送检信息单一式三份,一份随样品送实验室,一份寄去,另一份备案。样品信息内容记录应包括以下内容:抗体检测样品包括畜主姓名、畜禽场地址、动物品种及其饲养量、样品数量、免疫情况、疫苗种类、免疫时间、送检者姓名、地址、邮编、电话及送检日期;病料样品除前述信息外,还包括样品种类、首发病例日期、发病与死亡数量、临床症状、发病年龄、治疗情况、检测项目等。
6.5.2运送
样品运送前的包装严格执行《动物疫病实验室检验采样方法》(NY/T 541-2002)。运送过程中,应尽量避免样品包装箱剧烈震动,防止液体样品洒出,并保持温度在要求的范围内。用于进行高致病性病原微生物诊断检测的样品,包装和运输应符合《高致病性动物病原微生物菌(毒)种或者样本运输包装规范》的要求。
7 样品采集过程中需要注意的生物安全问题
样品采集工作在保证样品质量的同时,必须要做好消毒和采样废弃物的无害化处理工作,防止因处置不当而导致病原扩散。特别是在采集用于或者疑似布鲁氏菌病、结核病、棘球蚴病、炭疽、狂犬病等人兽共患病检测样品时,必须做好人员防护工作,保证采样人员的健康安全。
7.1提高人员的自我保护意识
(1)做好被采样畜禽个体的保定,即能提高采样速度和质量,又能防止对采样人员造成伤害,防止被采样畜禽血管被针头刺穿而使采样无法完成;
(2)采样操作时小心使用刀片、注射器、剪刀等尖锐器械,防止被刺伤、割伤。因伤口更易被布鲁氏菌病、狂犬病等人兽共患病感染;采集、转移组织液等液体样品时,动作要轻要慢,防止形成含有病原的气溶胶,造成病原扩散和人员感染。
7.2人员的生物安全防护措施
事先应根据拟检测项目、疫病传染性、是否为人兽共患病以及传播途径等因素,综合分析,做好相应的生物安全防护工作。特别是在采集疑似患有人兽共患病畜禽的样品时,主要应注意以下几点:
(1)选戴N95级(含)以上的口罩做好呼吸道防护。戴好后用口吹气和吸气来检查口罩是否佩戴正确:即吸气呼气时口罩边缘均没有空气流动,而口罩中央部位吸气时凹陷,呼气时凸起。否则需要调整口罩边缘的密封效果。禁止佩戴普通一次性口罩,该口罩仅用于阻挡吸入灰尘和防止佩戴者口鼻中调出的物质落到操作部位,不能过滤样品采集过程中产生的含病原气溶胶。
(2)必要时佩戴护目镜,防止样品溅出物和采样过程中产生的气溶胶进入眼中造成感染。
(3)采集患人兽共患病畜禽样品时,建议戴双层手套,先戴丁腈手套后戴乳胶手套。戴前应检查口罩是否完好,操作过程中发现手套破裂立即更换。
(4)穿正规的防护服,长筒雨鞋或戴鞋套。避免被畜禽溅出的血液、排出的粪便和喷出的唾液等分泌物污染皮肤、衣服而感染疫病。
7.3废弃物处理和采样环境消毒
7.3.1一次性器械、物品的处理
针头、刀片使用完毕后,放入锐器盒带回处理;一次性针管、防护用品应装入事先准备好的密封袋中做焚烧或实验室高压消毒处理。
7.3.2尸体与环境处理
采样后的畜禽尸体,喷洒消毒药后进行焚烧或深埋等无害化处理。采样结束,采样人员进行更衣消毒,对被污染环境严格进行清洁消毒。□□
中图分类号:S855.3
文献标识码:C
文章编号:1001-0769(2016)05-0093-03

