Auer小体对初诊非M3型急性髓细胞白血病患者预后的影响
江 娟, 江 源, 申 虹, 祝文娟
(安徽省池州市人民医院血液内科, 安徽 池州 247100)
作为临床常见血液系统恶性肿瘤疾病,急性髓系白血病(AML)主要指的是来源于造血干祖细胞的恶性克隆性血液疾病,未成熟的前体细胞经过长时间异常积累,会对正常造血细胞生长产生影响,患者表现为不同程度感染、出血,部分伴随髓外组织器官浸润,病情进展速度快,临床表现复杂,严重威胁患者生命安全[1]。随着现代医疗卫生技术的进步,靶向治疗、化疗及干细胞移植被应用于AML治疗中,在改善患者症状、延长生存期方面具有一定的作用。但从整体上看,患者临床结局存在异质性,有学者在研究中提出,AML患者生存结局是遗传、基因突变及表面分子等多种因素共同作用的结果,掌握AML细胞生物学特征对于患者预后评估及治疗方案选择至关重要。国外学者在研究中发现Auer小体在AML诊断中具有较高的特异性,Auer小体是由嗜苯胺蓝颗粒融合而成,形态多样。本研究收集于2017年1月至2022年1月初诊非M3型AML患者124例,探究Auer小体与非M3型AML患者预后的关系,结果如下。
1 资料与方法
1.1一般资料:回顾性收集2017年1月至2022年1月池州市人民医院初诊非M3型AML病例124例,男性69例,女性55例;年龄18~78岁,平均年龄(56.28±6.53)岁;病程3个月至3年,平均病程(1.31±0.54)年。研究申请得到医学伦理委员会批准。纳入标准:①CT、超声及病理学初诊确诊为非M3型AML,符合WHO 2008年髓系肿瘤诊断的相关标准[2]。②年龄18~80岁;③患者交流无障碍,可配合研究;④资料齐全,无重大器质性疾病;⑤可收集到患者完整的临床检查资料。排除标准:①重要脏器严重受损;②合并精神类疾病;③合并其他类型恶性肿瘤疾病;④存在全身感染症状者;⑤近期接受过抗感染治疗、免疫抑制治疗等患者;⑥免疫功能异常或凝血障碍;⑦有听觉、语言交流障碍,不能与医师有效沟通;⑧合并严重并发症患者;⑨继发性AML。剔除标准:①临床资料缺失者;②研究期间出现威胁患者生命的严重并发症者;③患者中途自愿退出者。
1.2方 法
1.2.1患者资料:调查并记录患者年龄、性别、病史等一般资料,评估患者有无发热、出血、疼痛、贫血症状,检查是否合并心血管疾病或消化系统疾病,评估疾病危险度分级(低危、中危、高危)。
1.2.2实验室指标检测:清晨采集患者空腹外周静脉血4mL,3800r/min离心15min。分离血清,保存于-80℃冰箱环境中。血常规指标包括白细胞计数(WBC)、血小板(PLT)、血红蛋白(Hb)、乳酸脱氢酶(LDH),采用华仁生物动物血液分析仪VH20(南京华仁生物科技有限公司)。
1.2.3细胞形态学检查:采集患者外周血、骨髓液,将其制备成为涂片,经过干燥处理后,实施HE染色,结合诊断需求实施细胞化学染色,对有核细胞比例进行计数,做好相应的记录。检测是否存在Auer小体,当白细胞胞质中出现红色细杆状物质,1个或数个,长约1~6μm,提示存在Auer小体。
1.2.4细胞遗传学检查:应用染色体显代技术实施细胞遗传学检查,严格按照人类染色体命名的国际规则(ISCN)相关固定对染色体进行检测与判断。
1.2.5分子遗传学检查:采用聚合酶链反应(PCR)技术对AML相关融合基因进行检测,并进行免疫学分型检查。
1.2.6治疗方法:按照柔红霉素、阿糖胞苷(DA)方案或去甲柔红霉素、阿糖胞苷(IA)方案对患者实施标准诱导化疗。柔红霉素来源于海正辉瑞药业有限公司,国药准字H33020925,规格:20mg(按C27H29NO10计),按照45~60mg/m2的剂量实施静脉滴注;阿糖胞苷来源于Actavis Italy S.P.A,进口药品注册证号H20160403,规格:0.1g×瓶×盒,按照100mg·m2·d-1的剂量静脉滴注;去甲柔红霉素来源于Actavis Italy S.P.A进口药品注册证号H20181213,规格10mg×瓶×盒,按照8~12mg·m2·d-1的剂量静脉滴注。
1.3观察指标:记录患者的年龄、性别、疾病危险度分级、实验室指标、基因突变等临床特征,随访患者临床结局及预后情况,绘制Kaplan-Meier生存曲线,对比两组患者的总生存期(OS)。完全缓解标准:经过治疗患者原始细胞下降80%以上。

2 结 果
2.1两组患者一般及临床资料比较:124例非M3型AML患者中,54例为Auer小体阳性,70例Auer小体阴性。两组在年龄、性别构成比、病史、发热、出血、疼痛、贫血、疾病危险度分级方面差异比较,差异无统计学意义(P>0.05),在合并心血管疾病及消化系统疾病占比方面比较,差异有统计学意义(P<0.05)。见表1。

表1 两组患者一般及临床资料比较
2.2两组患者实验室指标比较:两组患者WBC、PLT、Hb、LDH水平比较,差异无统计学意义(P>0.05),融合基因占比情况比较,差异无统计学意义(P>0.05),见表2。

表2 两组实验室指标比较
2.3两组患者临床结局比较:随访患者预后,结果显示两组患者完全缓解率、复发率比较,差异无统计学意义(P>0.05),但Auer小体阳性组死亡率明显低于Auer小体阴性组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者临床结局比较n(%)
2.4两组患者生存情况分析:Kaplan-Meier生存曲线显示,两组患者DFS差异无统计学意义(P>0.05),但Auer小体阳性组OS明显高于Auer小体阴性组,差异有统计学意义(P<0.05)。见图1、图2。

图1 两组患者的OS Kaplan-Meier生存曲线
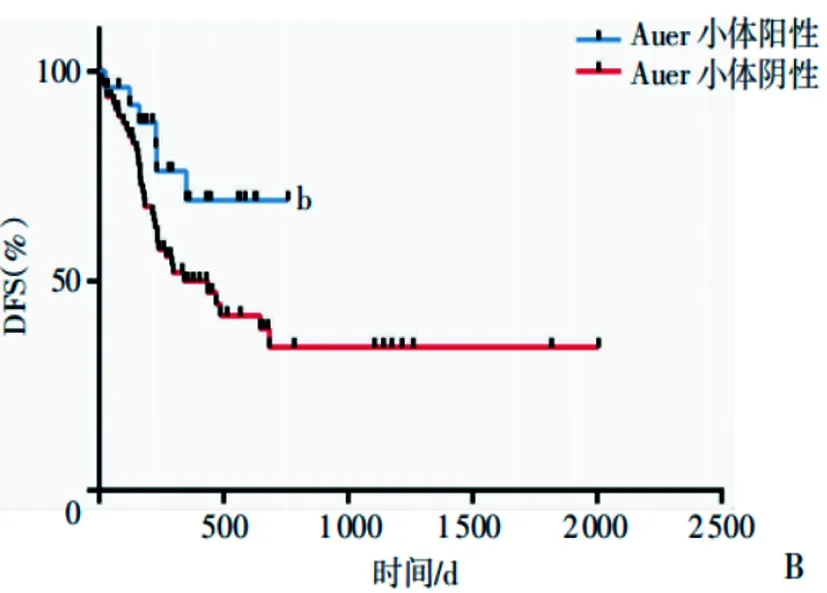
图2 两组患者的DFS Kaplan-Meier生存曲线
3 讨 论
流行病学调查研究发现,AML在所有白血病中占55%~60%,在形态学、免疫表型及细胞遗传学等方面呈现出明显的异质性,随着疾病进展会向骨髓、血液及其他组织浸润,典型临床表现为出血、贫血及发热等,AML病因机制复杂,考虑是物理、化学、遗传等多种因素共同作用的结果[3,4]。临床强调针对不同个体应采用对应治疗方法,以实现精准治疗,提高患者预后。AML患者预后与宿主因素及疾病因素等密切相关,前者主要包括年龄、合并症以及体能状态等;后者包括实验室指标、基因突变及遗传学改变等,AML又分为M0-M7共8个亚型,其中M3这个亚型又称之为急性早幼粒细胞白血病,治愈率比较高。不管是哪种亚型的急性髓系白血病,还可以再进行预后分层,对于低危的AML患者预后相对较好,治愈率相对较高,生存期较长。对于高危的AML患者则治愈率相对较低,预后相对较差,生存期相对较短。通过对患者相关指标的观察与检测,能够实现对AML患者预后的评估,提升治疗方案的针对性与有效性,延长患者生存期。
作为一种针状内容物,Auer小体主要来源于细胞浆,是AML的特殊病理特征,可见于原始、成熟细胞。调查研究发现AML患者30%~55%可见Auer小体表达[5],从结构上看表现为层纹状,排列规整、有序,经过胞浆嗜天青颗粒融合生成。有学者认为Auer小体对于白血病疾病诊断具有较高的临床价值,且能够实现病理分型[6]。Auer小体对于急性白血病的诊断以及细胞类型的鉴别是有参考价值的,最常见于急性粒细胞性白血病,尤其是急性早幼粒细胞白血病。本研究分析了Auer小体与初诊非M3型AML患者预后的关系,从研究结果看124例非M3型AML患者中,54例为Auer小体阳性,70例Auer小体阴性[7]。对比两组患者一般资料显示在年龄、性别构成比、病史、发热、出血、疼痛、贫血、疾病危险度分级方面差异无统计学意义(P>0.05),但Auer小体阳性组合并心血管疾病占比更低,消化系统疾病占比则高于Auer小体阴性组,差异显著。上述结果提示,Auer小体阳性、阴性非M3型AML患者在出血、贫血、感染以及肢体疼痛等方面基本一致。Auer小体常见于急性非淋巴细胞白血病,是急性非淋巴细胞白血病一个具有诊断意义的形态学特征。患有急性非淋巴细胞白血病后,白血病细胞大量增殖,并分化停滞在原始或幼稚细胞阶段,使染色质中出现大量核分裂现象,分裂后的染色质可以聚集成小棒状,通常不会累及心血管系统与消化系统,因此合并心血管疾病与消化系统疾病较少。AML患者多伴随骨骼疼痛,考虑与骨髓腔压力升高有关[8]。Auer小体阳性患者更易发生消化系统疾病,而心血管病症占比低,其原因需要更深一步探索。在实验室指标WBC、PLT、Hb、LDH水平两组患者差异无显著性,说明上述指标与Auer小体阳性无明显关系。
近年来,关于非M3型AML的免疫学分型诊断成为临床探讨的重点,从本研究结果看,在融合基因AML-ETO和CBFβ-MYHll占比方面,两组患者比较,无统计学意义(P>0.05)。本研究随访患者预后,结果显示Auer小体阳性组死亡率低于Auer小体阴性组,差异有统计学意义(P<0.05),且经过Kaplan-Meier生存曲线分析,显示Auer小体阳性组OS高于Auer小体阴性组,差异有统计学意义(P<0.05),说明与Auer小体阴性组相比,Auer小体阳性患者预后更好,死亡率更低总生存期更长。国外学者研究发现,Auer小体阳性能够对AML细胞残留终末分化能力起到弱化作用,降低残留分化潜力,从而改善患者预后[9]。本研究就Auer小体对非M3型AML患者预后的影响进行了观察,但病例少、随访时间有限,可能有所偏倚,后续仍需大样本研究,挖掘其临床价值,更好的服务于临床。
由上可知,Auer小体阳性能够降低初诊非M3型AML患者死亡率,延长总生存期,且与Auer小体阴性相比,心血管病症发生率低,临床上应加强Auer小体检测,有助于评估患者预后,提升治疗的精准性,以改善患者预后,提高生存质量。

