参竹心康汤通过miRNA-21调控EndMT影响心肌纤维化的实验研究*
瞿双勇,陈志红,成笑楠,朱筱婧,赵 启,喻正科
(1.天长市中医院,安徽 天长 239300;2.湖南省中医药研究院附属医院,湖南 长沙 410006;3.湖南中医药高等专科学校,湖南 株洲 412012)
心肌纤维化(myocardial fibrosis,MF)的特点是细胞外基质(extracellular matrix,ECM)的产生和降解不平衡,导致ECM过度积累的过程。而过量的ECM沉积引起心肌结构、表型和功能发生改变,使心肌僵硬,心脏顺应性降低,影响心脏收缩与舒张功能,最终导致心力衰竭。心肌纤维化是决定心血管疾病预后的主要因素。因此,如何有效改善心肌纤维化具有重要意义。但心肌纤维化原因复杂,发生发展机制尚不十分清楚。KUMARSWAMY R等[1]通过TGF-β1诱导内皮向间充质细胞转化(endothelial-to-mesenchymal transition,EndMT)并调节微小RNA-21(miRNA-21)基因表达发现,miRNA-21能促进心肌纤维化的发生发展,其部分作用是通过TGF-β1介导的EndMT实现的。LI F P等[2]通过实验发现,miRNA-21的表达可以下调PTEN水平。而磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)具有磷脂酰肌醇3-磷酸酶活性,能够独立地抑制PI3K/Akt通路[3],Akt具有促进细胞增殖的作用。由此可知,miRNA-21可以通过下调PTEN水平,从而促进PI3K/Akt通路的表达,导致内皮细胞过度克隆,向间质转化,引起内皮-间质转化,最终促进MF的发生,而中医药改善心肌纤维化有一定优势[4]。
参竹心康汤是本团队临床上用于治疗慢性心力衰竭心肌纤维化的有效方药,具有益气养阴、活血化瘀的功效。临床研究[5]提示,参竹心康汤可以改善心力衰竭患者症状,提高射血分数(ejection fraction,EF),提升心力衰竭患者的生活质量。前期动物实验[6-7]表明,参竹心康汤作用于心力衰竭模型大鼠后,能够改善其心肌重构,具有抗心肌纤维化作用。本研究通过观察参竹心康汤对EndMT的影响及其对miRNA-21调控PTEN/PI3K/Akt通路的影响,探讨其作用机制,现报告如下。
1 材料
1.1 实验动物 6~8周龄SPF级健康雄性SD大鼠20只,体质量180~200 g,购自湖南斯莱克景达公司,动物生产许可证号:SCXK(湘)2019-0004。饲养条件:温度23~25 ℃,相对湿度50%~60%,自然光照,自由饮水、饮食。实验经湖南省中医药研究院医学实验动物伦理委员会批准,批准号:NO.2020-0063。所有操作均严格遵循实验动物管理相关规定。
1.2 细胞 人脐静脉内皮细胞(HUVEC)(批号:8000)购于上海中乔新舟生物科技有限公司。
1.3 药物与试剂 参竹心康汤,方药组成:党参20 g,麦冬15 g,炙黄芪20 g,五味子5 g,玉竹15 g,丹参20 g,田三七5 g,黄精15 g,葶苈子6 g,姜黄10 g,泽兰10 g。上述药材均购自湖南省中医药研究院附属医院中药房,由湖南省中医药研究院附属医院田其学主任药师、周知午主任药师鉴定符合2020年版《中华人民共和国药典》规定。将以上饮片以6倍清水浸泡20 min后,煎煮40 min,取药液,分离药渣;再以5倍清水煎煮药渣40 min,合并两次药液,混匀,浓缩至生药浓度为4.5 g/mL,4 ℃保存。卡托普利(囯药准字H42020384,批号:20190022)购自华中药业公司,研磨成细粉后加入蒸馏水中以超声震荡制成质量浓度为3.25 mg/mL的混悬液,4 ℃冰箱冷藏备用;mRNA逆转录试剂盒(批号:CW2569)、miRNA逆转录试剂盒(批号:CW2141)、UltraSYBR Mixture(批号:CW2601)均购自北京康为世纪有限公司;CD31一抗(批号:ab24590)、FSP1一抗(批号:ab197896)、α-SMA一抗(批号:ab7817)、TIMP1一抗(批号:ab109125)、MMP-9一抗(批号:ab38898)均购自abcam公司;PTEN一抗(批号:22034-1-AP)、PI3K一抗(批号:21890-1-AP)、Akt一抗(批号:10176-2-AP)、p-Akt一抗(批号:66444-1-Ig)、β-actin一抗(批号:66009-1-Ig)、FSP1、CD31、CoraLite488-conjugated Goat Anti-Rabbit IgG(批号:SA00013-2)、HRP goat anti-mouse IgG(批号:SA00001-1)、HRP goat antirabbit IgG(批号:SA00001-2)均购自proteintech公司。
1.4 主要仪器 DH-160I型直热式二氧化碳培养箱(上海三藤仪器公司);DSZ2000X型倒置生物显微镜(北京中显恒业仪器公司);DHP-500型电热恒温培养箱(北京永光明医疗公司);MB-530型多功能酶标分析仪(深圳汇松公司);PIKOREAL96型荧光定量RCP仪、SPL0960型荧光P CR板(美国Thermo公司);BioPrep-24型生物样品均质仪(杭州奥盛公司);DYY-2C型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40D型转膜仪(北京六一公司)。
2 方法
2.1 含药血清制备 SD大鼠按照随机数字表法分为中药组和空白组,每组10只。前期研究表明,参竹心康汤灌胃剂量在44 g/kg时对心肌纤维化大鼠疗效最佳[8],故本次研究中大鼠每日灌胃剂量为44 g/kg。中药组大鼠灌胃给予参竹心康汤,44 g/(kg·d);空白组大鼠灌胃给予生理盐水,10 mL/kg,1次/d,连续7 d。最后一次灌胃1 h后,以10%水合氯醛按0.3 mL/100 g腹腔注射麻醉。腹主动脉采血,采用颈椎脱臼法处死实验大鼠。血液标本以4 ℃2 500 r/min离心15 min取血清,放入56 ℃水浴锅灭活补体,0.22 μm微孔滤膜过滤除菌,获得含药血清及空白血清,置-20 ℃冰箱保存。
2.2 HUVEC细胞分组 取HUVEC细胞分为对照组、模型组、阳性对照组和参竹心康汤组。其中对照组不做特殊处理,模型组使用10 ng/mL TGF-β1+20%空白血清处理,阳性对照组使用10 ng/mL TGF-β1+10 μmol/L卡托普利+20%空白血清处理,参竹心康汤组使用10 ng/mL TGF-β1+20%含药血清处理。
2.3 细胞免疫荧光法(IF)测定EndMT相关标志物CD31、α-SMA、FSP1蛋白的表达水平 取指数生长期细胞,分组培养;用4%多聚甲醛固定30 min后,用PBS洗涤3次,5 min/次;5%BSA 37 ℃封闭60 min;滴加1∶50稀释的一抗(CD31、FSP1、α-SMA),4 ℃过夜。PBS冲洗3次,5 min/次;滴加50~100 μL抗-Mouse、Rabbit、Mouse-IgG标记荧光抗体(稀释比例1∶200),37 ℃孵育90 min,PBS冲洗3次,5 min/次;DAPI工作液37 ℃染核10 min,PBS冲洗3次,5 min/次;缓冲甘油封片;避光保存。然后在荧光显微镜下观察。使用image pro plus软件分析,得到各组IOD值。
2.4 ELISA法检测collagenⅠ含量 收集细胞培养液上清液,严格按说明书操作测定上清液中collagen Ⅰ的含量。
2.5 RT-qPCR 法检测miRNA-21 mRNA、PTEN mRNA、PI3K mRNA、Akt mRNA相对表达量 提取总RNA后,以组织总mRNA为模板,逆转录cDNA。涡旋振荡混匀,4 ℃12 000 r/min离心15 min,使管壁上的溶液收集到管底;50 ℃孵育50 min,85 ℃孵育5 min。反应结束后,4 ℃12 000 r/min离心10 min,置于冰上冷却;逆转录产物可直接用于PCR反应和荧光定量PCR反应,用1 mmol/L Tris(pH=8.0)来稀释10 mmol/L ATP:即将ATP稀释50倍(1 μL的10 mmol/L ATP加49 μL的1 mmol/L Tris,pH=8.0)。向冰浴中预冷的无RNase反应管中加入试剂至总体积20 μL;4 ℃7 500 r/min离心5 min,将液体收集于管底,37 ℃孵育15 min。修饰后miRNA cDNA第一链合成的过程:向冰浴中预冷的无RNase反应管中加入试剂,至终体积20 μL;混匀反应液,4 ℃7 500 r/min离心5 min,将液体收集于管底。42 ℃孵育50 min;85 ℃孵育5 min,终止反应。程序设置:95℃,10 min;95 ℃,15 s;60℃,30 s,循环40周期。
使用SYBR法,NCBI搜索目的基因序列,primer5软件设计引物,由上海生工合成引物。引物序列见表1。采用2-ΔΔCt法计算结果。

表1 实时定量逆转录-PCR 引物序列
2.6 蛋白免疫印迹法检测PTEN、PI3K、Akt、pAkt及TIMP1、MMP-9蛋白相对表达量 冰预冷PBS洗涤细胞1次,加入200 μL RIPA裂解液,细胞悬液超声破碎1.5 min;冰上裂解10 min;4 ℃,12 000 r/min离心15 min;上清液转移至1.5 mL的离心管。配制11%分离胶,4.8%的浓缩胶。72 V电泳130 min。300 mA恒定电流转膜,用1×PBST配制5%脱脂奶粉,将膜浸入后,室温放置90 min。加入一抗孵育,室温放置90 min,其中抗体稀释浓度为PTEN抗体(1∶2 000),PI3K抗体(1∶1 000),Akt抗体(1∶1 000),pAkt抗体(1 ∶2 000),TIMP1 抗体(1 ∶1 000),MMP-9 抗体(1∶1 000)以及β-actin抗体(1:20 000)。孵育结束,1×PBST洗3次,15 min/次。二抗孵育90 min;1×PBST洗3次,10 min/次。使用ECL化学发光液与膜孵育1 min,显影冲洗。quantity one软件进行分析,得到PTEN/β-actin、PI3K/β-actin、TIMP1/β-actin、MMP-9/β-actin、Akt/β-actin、pAkt/β-actin数据,净光密度用于目的蛋白表达水平的比较。
2.7 统计学方法 采用SPSS 23.0软件分析数据,所有数据都进行正态性和方差齐性检验,计量资料以“均数±标准差”(±s)表示,多组间比较使用单因素方差分析,两两比较采用LSD-t法。若不满足正态性,选用Games Howell检验。以P<0.05为差异有统计学意义。
3 结果
3.1 各组HUVEC细胞EndMT标志指标CD31、α-SMA、FSP1免疫荧光比较 细胞特异性蛋白CD31、α-SMA、FSP1染为绿色荧光,无特异性的细胞核染色为蓝色荧光,MERGE为两者融合。与对照组比较,模型组HUVEC细胞中CD31荧光强度明显降低(P<0.05),α-SMA、FSP1荧光强度均明显升高(P<0.05);与模型组比较,阳性对照组、参竹心康汤组HUVEC细胞中CD31荧光强度均明显升高(P<0.05),α-SMA、FSP1荧光强度均不同程度降低(P<0.05);与阳性对照组比较,参竹心康汤组HUVEC细胞中CD31荧光强度明显升高(P<0.05),α-SMA、FSP1荧光强度均明显降低(P<0.05)。(见图1~3、表2)

图1 各组HUVEC 细胞中CD31 免疫荧光光镜图(×400)

图2 各组HUVEC 细胞中α-SMA 免疫荧光光镜图(×400)

图3 各组HUVEC 细胞中FSP1 免疫荧光光镜图(×400)
表2 各组HUVEC 细胞中CD31、α-SMA、FSP1 积分光密度值比较 (±s,n=3)

表2 各组HUVEC 细胞中CD31、α-SMA、FSP1 积分光密度值比较 (±s,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05
组别CD31(×103)α-SMA(×103)FSP1(×103)对照组154.61±6.9628.91±2.785.01±0.43模型组8.40±1.04a100.27±2.31a89.76±4.83a阳性对照组34.31±2.32ab64.76±2.90ab 58.85±1.50ab参竹心康汤组 85.28±1.51abc47.44±0.72abc 33.60±1.84abc F 290.239168.067178.613 P 0.0000.0000.000
3.2 各组HUVEC细胞中TIMP-1、MMP-9蛋白相对表达量比较 与对照组比较,模型组HUVEC细胞中TIMP-1蛋白相对表达量明显降低(P<0.05),MMP-9蛋白相对表达量明显升高(P<0.05);与模型组比较,阳性对照组、参竹心康汤组HUVEC细胞中TIMP-1蛋白相对表达量均明显升高(P<0.05),MMP-9蛋白相对表达量均明显降低(P<0.05);与阳性对照组比较,参竹心康汤组HUVEC细胞中TIMP-1蛋白相对表达量明显升高(P<0.05),MMP-9蛋白相对表达量明显降低(P<0.05)。(见图4、表3)

图4 各组HUVEC细胞中TIMP-1、MMP-9蛋白表达免疫印迹图
表3 各组HUVEC 细胞中TIMP-1、MMP-9 蛋白相对表达量比较 (±s,n=3)

表3 各组HUVEC 细胞中TIMP-1、MMP-9 蛋白相对表达量比较 (±s,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05
组别TIMP-1/β-actinMMP-9/β-actin对照组0.38±0.020.06±0.01模型组0.08±0.01a0.42±0.06a阳性对照组0.20±0.03ab0.27±0.01ab参竹心康汤组0.28±0.01abc0.18±0.01abc F 45.48226.885 P 0.0000.000
3.3 各组HUVEC细胞中collagen Ⅰ含量比较 与对照组比较,模型组HUVEC细胞中collagen Ⅰ含量明显升高(P<0.05);与模型组比较,阳性对照组、参竹心康汤组HUVEC细胞中collagen Ⅰ含量均明显降低(P<0.05);与阳性对照组比较,参竹心康汤组HUVEC细胞中collagen I含量明显降低(P<0.05)。(见表4)
表4 各组HUVEC 细胞中collagen Ⅰ含量比较(±s,ng/mL,n=3)

表4 各组HUVEC 细胞中collagen Ⅰ含量比较(±s,ng/mL,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05
组别collagen Ⅰ对照组3.12±0.10模型组14.21±0.06a阳性对照组8.27±0.06ab参竹心康汤组5.07±0.11abc F 3 352.953 P 0.000
3.4 各组HUVEC细胞中miRNA-21相对表达量比较 与对照组比较,模型组HUVEC细胞中miRNA-21相对表达量明显升高(P<0.05);与模型组比较,阳性对照组、参竹心康汤组HUVEC细胞中miRNA-21相对表达量均明显降低(P<0.05);与阳性对照组比较,参竹心康汤组HUVEC细胞中miRNA-21相对表达量降低,但差异无统计学意义(P>0.05)。(见表5)
表5 各组HUVEC 细胞中miRNA-21 相对表达量比较(±s,n=3)

表5 各组HUVEC 细胞中miRNA-21 相对表达量比较(±s,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
组别miRNA-21对照组0.98±0.02模型组8.03±0.89a阳性对照组3.20±0.23ab参竹心康汤组2.84±0.10ab F 42.322 P 0.000
3.5 各组HUVEC细胞中PTEN mRNA、PI3K mRNA、Akt mRNA相对表达量比较 与对照组比较,模型组HUVEC细胞中PTEN mRNA相对表达量明显降低(P<0.05),而PI3K mRNA、Akt mRNA相对表达量均明显升高(P<0.05);与模型组比较,阳性对照组、参竹心康汤组HUVEC细胞中PTEN mRNA相对表达量均明显升高(P<0.05),而PI3K mRNA、Akt mRNA相对表达量均明显降低(P<0.05);与阳性对照组比较,参竹心康汤组HUVEC细胞中PTEN mRNA相对表达量明显升高(P<0.05),而PI3K mRNA、Akt mRNA相对表达量均明显降低(P<0.05)。(见表6)
表6 各组HUVEC 细胞中PTEN mRNA、PI3K mRNA、AKT mRNA 相对表达量比较 (±s,n=3)

表6 各组HUVEC 细胞中PTEN mRNA、PI3K mRNA、AKT mRNA 相对表达量比较 (±s,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05
组别PTENPI3KAkt对照组1.06±0.051.00±0.021.08±0.03模型组0.20±0.02a5.51±0.28a5.61±0.48a阳性对照组0.46±0.04ab3.88±0.09ab3.23±0.09ab参竹心康汤组 0.76±0.04abc1.78±0.23abc 1.89±0.07abc F 98.982117.43464.972 P 0.0000.0000.000
3.6 各组HUVEC细胞中PTEN、PI3K、pAkt、Akt蛋白相对表达量比较 与对照组比较,模型组HUVEC细胞中PTEN蛋白相对表达量明显降低(P<0.05),而PI3K蛋白相对表达量及pAkt/Akt值均明显升高(P<0.05);与模型组比较,阳性对照组、参竹心康汤组HUVEC细胞中PTEN蛋白相对表达量均明显升高(P<0.05),而PI3K蛋白相对表达量及pAkt/Akt值均明显降低(P<0.05);与阳性对照组比较,参竹心康汤组HUVEC细胞中PTEN蛋白相对表达量明显升高(P<0.05),而PI3K蛋白相对表达量及pAkt/Akt值明显降低(P<0.05)。(见图5、表7)

图5 各组HUVEC 细胞中PTEN、PI3K、pAkt、Akt蛋白表达免疫印迹图
表7 各组HUVEC 细胞中PTEN、PI3K、pAkt、Akt 蛋白相对表达量比较 (±s,n=3)
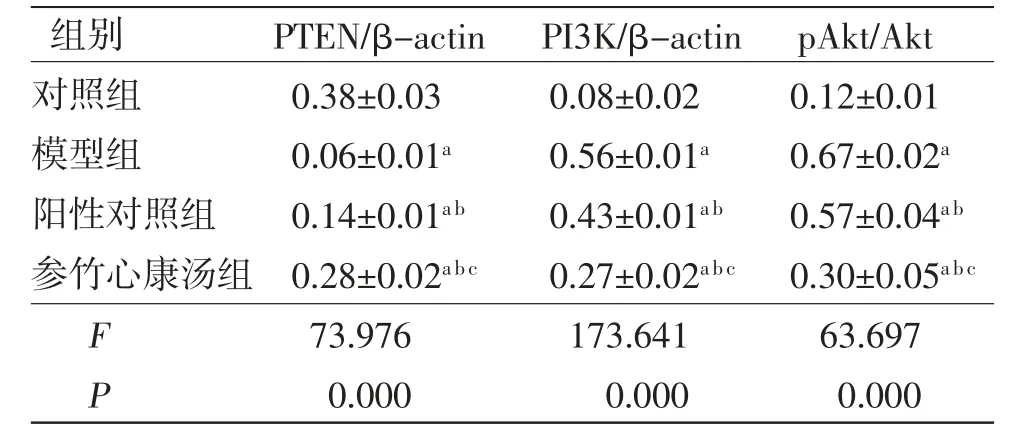
表7 各组HUVEC 细胞中PTEN、PI3K、pAkt、Akt 蛋白相对表达量比较 (±s,n=3)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05
组别PTEN/β-actin PI3K/β-actin pAkt/Akt对照组0.38±0.030.08±0.020.12±0.01模型组0.06±0.01a0.56±0.01a0.67±0.02a阳性对照组0.14±0.01ab0.43±0.01ab0.57±0.04ab参竹心康汤组 0.28±0.02abc0.27±0.02abc 0.30±0.05abc F 73.976173.64163.697 P 0.0000.0000.000
4 讨论
心肌纤维化是慢性心力衰竭发生发展的一个重要病理过程,是心肌重构的主要表现[9]。心肌成纤维细胞是心肌纤维化过程的主要效应细胞,而心肌成纤维细胞的增加主要来源于心脏原位细胞增殖、骨髓干细胞增殖及EndMT的内皮细胞,其中后者约占成纤维细胞增加来源的32%[10]。EndMT具体表现为细胞内骨架蛋白重新排列,并可出现伪足;内皮细胞的特异性标志物,如血小板内皮细胞黏附分子-1/CD31(PECAM-1/CD31)表达逐渐减弱或丧失,转而表达活化的成纤维细胞特异性标志物,如α-平滑肌肌动蛋白(α-SMA)、成纤维细胞特异性蛋白-1(FSP-1)等;同时伴有细胞间连接减少,细胞从血管内皮层脱离,而迁移和增殖的能力增强。研究[11-12]表明,EndMT与心肌纤维化之间存在着密切的联系,抑制EndMT可明显改善心功能[13]。
小分子RNA(MicroRNA,miRNA)是真核生物中长为20~25个核苷酸、具有调控功能的非编码RNA。miRNA可通过5’端碱基识别靶mRNA的3’-非翻译区(Untranslatedregion,UTR),促进mRNA降解、阻遏mRNA翻译、隔离mRNA靶基因,从而调节细胞的分化、凋亡、增殖与发育[14-15]。近几年,研究表明,miRNA在很多疾病(如心力衰竭、心肌肥厚、心肌纤维化、肺纤维化等)中都有不同程度的异常表达。THUM T等[16]发现心功能不全的心肌成纤维细胞中,miRNA-21表达显著上调。在垂体后叶素所导致的大鼠心肌损伤与心肌纤维化模型中,L7DG通过调节miR-21表达,从而减少TGF-β诱导的心肌纤维化[17-18]。TGF-β可诱导发生EndMT,而下调miRNA-21可部分抑制EndMT发生,表明miRNAs可能参与了EndMT的调控[19]。GUO Y M等[20]研究表明,人组织激肽释放酶结合蛋白(Kallistatin)可抑制通过miRNA-21调控由TGF-β诱导的人脐静脉内皮细胞EndMT。PTEN具有磷脂酰肌醇3-磷酸酶活性,是一个很有效的PI3K/Akt通路负性调节因子,能催化3’4’5’-三磷酸脂肌醇(PIP3)的3位脱磷酸酶,从而下调PIP3的水平。PIP3能激活原癌基因产物丝氨酸/苏氨酸激酶(Akt),后者通过激活下游级联反应,从而参与细胞的生长、分化、凋亡和迁移的调控。PTEN能独立通过抑制PI3K/Akt信号通路来控制凋亡和细胞周期,抑制PTEN/Akt通路可能延缓心室重构和心力衰竭的病程进展[21]。迄今有文献记载的miRNA-21介导的心血管效应的靶基因有4个,磷酸脂酶-张力蛋白同源物(PTEN)是其中之一。ROY S等[22]研究发现在缺血/再灌注诱导小鼠的心脏重构模型中,PTEN是miR-21在心肌成纤维细胞上的靶基因。
心肌细胞外基质(ECM)代谢失衡是引发心肌纤维化的重要原因。间质型胶原Ⅰ型(CollagenⅠ)在心肌纤维化过程中占有重要的地位。基质金属蛋白酶(MMPs)和基质金属蛋白酶抑制剂(TIMPs)是调控心肌ECM合成与降解的重要酶系,当MMPs与TIMPs表达失衡会导致ECM合成与降解异常,引起心肌纤维化。MMP-9又称明胶酶B,可降解ECM中的胶原,影响细胞外基质重塑。TIMP-1是MMP-9的特异性抑制剂。如果降解的胶原蛋白被缺乏链接结构的纤维性间质所取代,纤维胶原网络被破坏则导致心肌纤维化[23]。研究表明,MMPs/TIMPs比值通常决定ECM蛋白降解和组织重塑的程度,比值降低时,可以改善纤维化[24]。
本研究结果表明,模型组HUVEC细胞CD31荧光强度,PTEN mRNA相对表达量,TIMP-1、PTEN蛋白相对表达量均明显降低;α-SMA、FSP1荧光强度,collagenⅠ含量,miRNA-21 mRNA、PI3K mRNA、Akt mRNA相对表达量,MMP-9、PI3K、蛋白相对表达量及pAkt/Akt值均明显升高。提示内皮细胞来源的成纤维细胞中CD31含量降低,α-SMA、FSP1含量升高。TGF-β1可诱导HUVEC产生EndMT。参竹心康汤组HUVEC细胞中CD31荧光强度升高,α-SMA、FSP1荧光强度均降低,显示参竹心康汤能抑制成纤维细胞分泌α-SMA、FSP1,并促进CD31表达,说明该方能抑制HUVEC出现EndMT。在此基础上,本研究观察了参竹心康汤对TGF-β1诱导的HUVEC间质细胞转化后的影响,其结果显示,干预后TIMP-1蛋白相对表达量明显升高,MMP-9蛋白相对表达量、collagen Ⅰ含量均明显降低,提示参竹心康汤具有抗心肌纤维化的作用。进一步观察表明,参竹心康汤可下调miRNA-21的表达,同时能抑制PI3K mRNA、Akt mRNA表达,降低pAkt/Akt比值;上调这一过程中PTEN mRNA表达及蛋白含量。这可能是其抑制HUVEC出现EndMT的机制之一。
综上所述,参竹心康汤可以抑制EndMT,从而起到抗心肌纤维化作用。其可能机制与该方下调miRNA-21水平,抑制PTEN/PI3K/AKT通路有关。

