超微加味丹参饮对氯化钴诱导损伤的大鼠冠状动脉血管内皮细胞的影响
米热阿依·木太力甫,克徳尔阿依·木太力甫,米尔斯曼古力·米吉提
(1.喀什地区第一人民医院,新疆 喀什 844000;2.喀什地区食品药品检验所,新疆 喀什 844000)
血管内皮细胞是覆于血管、淋巴管内腔表面的单层扁平鳞状上皮,具有吞噬异物、细菌、坏死组织等功能,还可参与调节血管张力、抗血小板凝集、抗血栓、调节机体免疫等生理活动[1]。近年来的研究[2-3]认为,血管内皮功能障碍是导致动脉粥样硬化(atherosclerosis,AS)、冠状动脉心脏病(coronary heart disease,CHD)、缺血性脑卒中(ischemic stroke,IS)等心脑血管疾病的诱因之一,且血管内皮功能障碍存在于此类疾病发生发展的整个进程中。因此,改善血管内皮功能已成为防治心脑血管疾病的研究热点。加味丹参饮由丹参、檀香、赤芍、川芎、红花、当归、生地黄组成,具有活血化瘀、行气止痛之功效,是治疗冠心病-胸痹心痛心血瘀阻证的经典名方[4]。然而,其对心律失常、心力衰竭、冠心病等心血管疾病的治疗作用是否与改善血管内皮功能有关,目前鲜有报道。因此,本研究通过氯化钴(cobalt chloride,CoCl2)诱导形成大鼠冠状动脉内皮细胞损伤模型,观察超微加味丹参饮对血管内皮细胞的保护作用及对单核细胞趋化蛋白-1(monocyte chemoattractant protein,MCP-1)和血管内皮细胞钙黏蛋白(vascular endothelial cadherin,VE-cadherin)表达的影响。
1 材料
1.1 实验动物 8周龄SPF级SD雄性大鼠25只,体质量为(200±20)g,购自南京市青龙山动物繁殖场,动物生产许可证号:SCXK(苏)2020-0609。常规饲养于新疆鼎举动物技术有限公司动物实验中心,室温(24±3)℃,湿度40%~65%,同笼饲养,自然通风,自由摄食饮水,昼夜明暗交替时间12 h/12 h。本研究获得喀什地区第一人民医院实验动物管理和使用委员会(institutional animal care and use committee,IACUC)批准通过,伦理审批号:2020-0325,遵循3R原则。
1.2 药物与试剂 丹参(批号:181108-1)、檀香(批号:171129-1)、赤芍(批号:170325-1)、川芎(批号:180910-1)、红花(批号:180809-1)、当归(批号:170508-1)、生地黄(批号:180623-1)中药饮片均购自江苏省医药有限公司,经检验均符合2020年版《中华人民共和国药典》的质量标准;氯化钴(CoCl2)(批号:449766)、Ⅱ型胶原蛋白酶(批号:9301)、鼠尾胶原蛋白(批号:1093)均购自美国Sigma公司;内皮细胞培养基(endothelial cell medium,ECM)(批号:0025)购自美国ScienceCell公司;胰蛋白酶(批号:1720856)、MTT(批号:180512)均购自Gibco公司;BCA蛋白检测试剂盒(批号:P0011)购自日本TAKARA公司;抗B-细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)兔多克隆抗体(批号:PAB13118)、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)多克隆抗体(批号:LZ-R3414)、兔抗活化型半胱氨酸天冬氨酸特异性蛋白水解酶-3(cleaved cysteinyl aspartate specific proteinase-3,cleaved Caspase-3)多克隆抗体、抗β-肌动蛋白(β-actin)兔多克隆抗体(批号:GH0813)均购自美国Cell Technology公司;MCP-1酶联免疫吸附试验(ELISA)试剂盒(批号:GOY-SJH074)、VE-cadherin ELISA试剂盒(批号:CK-E10028)均购自美国TSZ公司;Trizol试剂(批号:15596-026)、逆转录试剂盒(批号:E22064)均购自Invitrogen公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号:A001-3)、丙二醛(malondialdehyde,MDA)试剂盒(批号:A003-1-1)、活性氧(reactive oxygen species,ROS)试剂盒(批号:A012)均购自南京建成生物工程有限公司。
1.3 主要仪器 CJ-2F型超净工作台(北京东联哈尔仪器制造有限公司);Heracell 240i型细胞培养箱(Thermo Fisher Scientific);ALLEGRA 25R型低温离心机(美国Beckman公司);Tecnaig2 Spirit型高倍显微镜(尼康仪器有限公司);318C型全自动酶联免疫分析仪(美国BioTek公司);Lambda 35型紫外分光光度仪(美国Perkin Elmar公司)。
2 方法
2.1 药物配制 超微加味丹参饮按以下方法制备:取丹参20 g,檀香6 g,赤芍10 g,川芎6 g,红花6 g,当归6 g,生地黄12 g,置于搅拌机中,通入120~180 ℃食品级蒸汽搅拌灭菌30 min,转移至粉碎机中进行粗粉碎,得到药材粗粉,将粗粉混合物置于棒磨机中再次粉碎,将所得细粉通过风送专用双向气流筛分机过200~400目筛,即得0.75 μm以下细粉末,加1 L蒸馏水浸泡1 h后,煎煮回流提取约2 h,过滤去渣,将滤液置于水浴上浓缩至相当于生药含量1 g/mL,保存备用。
2.2 含药血清的制备 取20只大鼠采用随机数字表法分为空白血清组、超微加味丹参饮高剂量组、超微加味丹参饮中剂量组、超微加味丹参饮低剂量组,每组5只。超微加味丹参饮高、中、低剂量组参考人与动物给药剂量换算法(大鼠剂量=成人常用量×人鼠换算系数0.018/大鼠体质量,其中按成人常用量86 g,大鼠体质量200 g进行换算),分别给予24、16、8 g/kg的超微加味丹参饮药物溶液,1次/d,连续给药7 d。于末次灌胃1 h后行腹主动脉采血(采血前12 h禁食,不禁水)6 mL,在室温下静置2 h后,以3 000 r/min离心10 min,取上清液,56 ℃灭活30 min,用0.22 μm滤膜过滤除菌,分装,在-80 ℃冰箱中保存备用。空白血清组大鼠给予等体积的蒸馏水进行灌胃,其他处理同前。
2.3 大鼠冠状动脉内皮细胞的培养 颈椎脱臼处死剩余5只大鼠,碘伏局部消毒后,逐层打开胸腔,断开肋骨,暴露冠状动脉,分离结缔组织后切取冠状动脉主干,置于无菌PBS溶液中漂洗去除附壁血细胞,将冠状动脉内膜外翻并剪成1~2 mm宽的环状,平铺于培养瓶中,于37 ℃、5%CO2培养箱中静置1 h,加入内皮细胞专用培养基,置于细胞培养箱中培养,每2~3 d更换一次培养基,待细胞生长致密单层后,用胰蛋白酶消化传代,当传至3~5代时即可用于后续实验。采用倒置显微镜观察内皮细胞的形态。
2.4 内皮细胞损伤模型的建立[5]取对数生长期的大鼠冠状动脉内皮细胞,经胰蛋白酶和EDTA消化后,采用DMEM培养基制备成密度为1×105个/mL的细胞悬液,将细胞悬液种植于96孔培养板,每孔100 μL,于细胞培养箱内培养24 h使其贴壁,换用不含血清的DMEM培养基培养12 h,加入浓度为700 mmol/L的CoCl2培养24 h,诱导形成内皮细胞损伤模型。
2.5 分组与给药 实验共设对照组、模型组、超微加味丹参饮高剂量组、超微加味丹参饮中剂量组、超微加味丹参饮低剂量组,每组各设置6个复孔。对照组为正常大鼠冠状动脉内皮细胞,模型组和超微加味丹参饮组为CoCl2诱导的内皮细胞损伤模型,超微加味丹参饮高、中、低剂量组分别用“2.2”项下制备的不同剂量含药血清替换培养基,孵育24 h。模型组和对照组给予等体积空白血清。
2.6 内皮细胞生存率检测 采用MTT比色法检测冠状动脉内皮细胞的生存率,待对照组、模型组、超微加味丹参饮高剂量组、超微加味丹参饮中剂量组、超微加味丹参饮低剂量组同步孵育24 h后,取出样本,每孔加入浓度为5 μg/mL的MTT溶液20 μL,孵育4 h,吸弃上清液,加入100 μL DMSO溶解结晶,震荡10 min,于490 nm下测定各孔的吸光度值(OD)。
2.7 氧化应激指标的检测 将各组内皮细胞孵育24 h后,以RIPA细胞裂解液裂解,在冰浴下超声破碎细胞,低温离心,取上清液,采用黄嘌呤氧化酶(xanthine oxidase,XOD)法检测其中SOD的活性,以荧光酶标仪检测其中ROS的含量,以硫代巴比妥酸(thiobarbituric acid,TBA)法检测其中MDA的含量,所有操作均严格按照试剂盒说明书进行。
2.8 Western blotting法检测凋亡相关蛋白的表达 将各组内皮细胞孵育24 h后,加入200 μL RIPA裂解液裂解细胞,采用BCA法测定总蛋白,取40 μg总蛋白,上样,12%十二烷基磺酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate- polyacrylamide gel electrophoresis,SDS-PAGE)电泳90 min后转膜,以5%TBST脱脂奶粉封闭,加一抗,4 ℃孵育过夜,TBST漂洗3次,加二抗,37 ℃振荡孵育90 min,于室温下将PVDF膜置于ECL混合液中振荡温育,加入ECL发光液,应用Image Lab软件分析计算各组细胞中Bcl-2、Bax和cleaved Caspase-3蛋白的相对表达量。
2.9 ELISA法检测细胞中MCP-1和VE-cadherin的表达 采用ELISA检测各组细胞中MCP-1和VE-cadherin蛋白的表达情况,所有操作均严格按照试剂盒说明书进行,于490 nm下测定OD值。
2.10 统计学方法 采用SPSS 22.0软件进行统计分析,计量资料以“均数±标准差”(±s)表示,多组比较采用单因素方差分析,两组比较采用SNK法,以P<0.05为差异有统计学意义。
3 结果
3.1 内皮细胞形态学观察 采用倒置显微镜观察内皮细胞的形态,原代细胞在培养5~7 d后可见少量多角形或短梭形的游离内皮细胞;培养至12~13 d时,迁移出的细胞呈现片状,约70%单层融合,分布不均。大鼠冠状动脉内皮细胞在传代后2 h开始贴壁生长,24 h后约90%细胞贴壁;48 h后可见细胞呈现梭形或鹅卵石形,单层互不重叠,边界清晰,胞浆丰富,核清晰;3 d后可见细胞呈小片状集落生长,细胞生长速度增快;5 d后细胞生长融合成片,排列紧密,部分可见典型的“铺路石”状单层排列;培养至7~8代后,可见细胞分化,分泌物增多,呈现老化状态,细胞纯度>95%。(见图1)
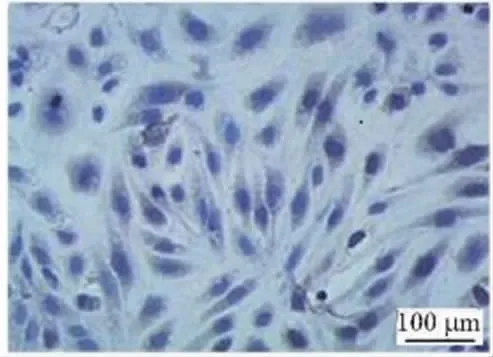
图1 原代大鼠冠状动脉内皮细胞 (×100)
3.2 各组内皮细胞生存率 与对照组比较,模型组内皮细胞生存率明显降低(P<0.05);与模型组比较,超微加味丹参饮高、中、低剂量组内皮细胞生存率均明显升高(P<0.05),且超微加味丹参饮高剂量组内皮细胞生存率>超微加味丹参饮中剂量组内皮细胞生存率>超微加味丹参饮低剂量组内皮细胞生存率,差异均有统计学意义(P<0.05)。(见图2)
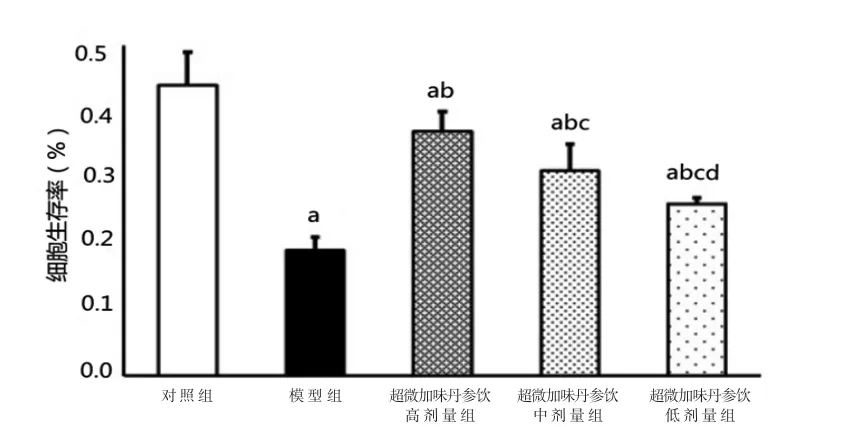
图2 各组内皮细胞生存率比较 (±s,n=6)
3.3 各组内皮细胞中SOD活性及MDA、ROS含量比较 与对照组比较,模型组内皮细胞中SOD活性明显降低(P<0.05),MDA、ROS含量均明显升高(P<0.05);与模型组比较,超微加味丹参饮高、中、低剂量组内皮细胞中SOD活性均明显升高(P<0.05),MDA、ROS含量均明显降低(P<0.05),且超微加味丹参饮高、中、低剂量组内皮细胞中SOD活性及MDA、ROS含量比较,差异均有统计学意义(P<0.05)。(见表1)
表1 各组内皮细胞中SOD 活性及MDA、ROS 含量比较(±s,n=6)
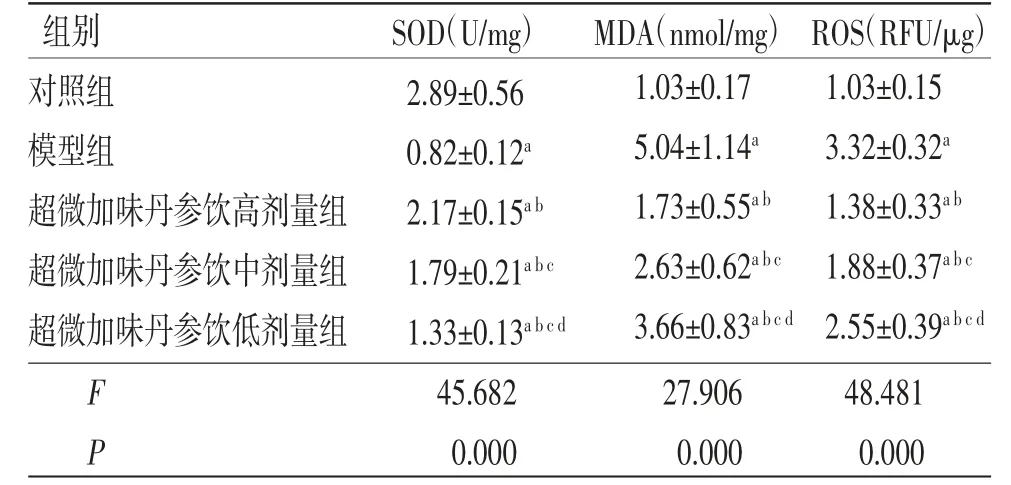
表1 各组内皮细胞中SOD 活性及MDA、ROS 含量比较(±s,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与超微加味丹参饮高剂量组比较,cP<0.05;与超微加味丹参饮中剂量组比较,dP<0.05
组别SOD(U/mg)MDA(nmol/mg) ROS(RFU/μg)对照组2.89±0.56模型组0.82±0.12a超微加味丹参饮高剂量组2.17±0.15ab超微加味丹参饮中剂量组1.79±0.21abc超微加味丹参饮低剂量组1.33±0.13abcd F 45.68227.90648.481 P 0.0000.0000.000 1.03±0.17 5.04±1.14a 1.73±0.55ab 2.63±0.62abc 3.66±0.83abcd 1.03±0.15 3.32±0.32a 1.38±0.33ab 1.88±0.37abc 2.55±0.39abcd
3.4 各组内皮细胞中凋亡相关蛋白相对表达量比较 与对照组比较,模型组内皮细胞中Bcl-2蛋白相对表达量明显降低(P<0.05),Bax和cleaved Caspase-3蛋白相对表达量均明显升高(P<0.05);与模型组比较,超微加味丹参饮高、中、低剂量组内皮细胞中Bcl-2蛋白相对表达量均明显升高(P<0.05),Bax和cleaved Caspase-3蛋白相对表达量均明显降低(P<0.05),且超微加味丹参饮高、中、低剂量组内皮细胞中Bcl-2、Bax和cleaved Caspase-3蛋白相对表达量比较,差异均有统计学意义(P<0.05)。(见表2、图3)
表2 各组内皮细胞中Bcl-2、Bax 和cleaved Caspase-3 蛋白相对表达量比较 (±s,n=6)
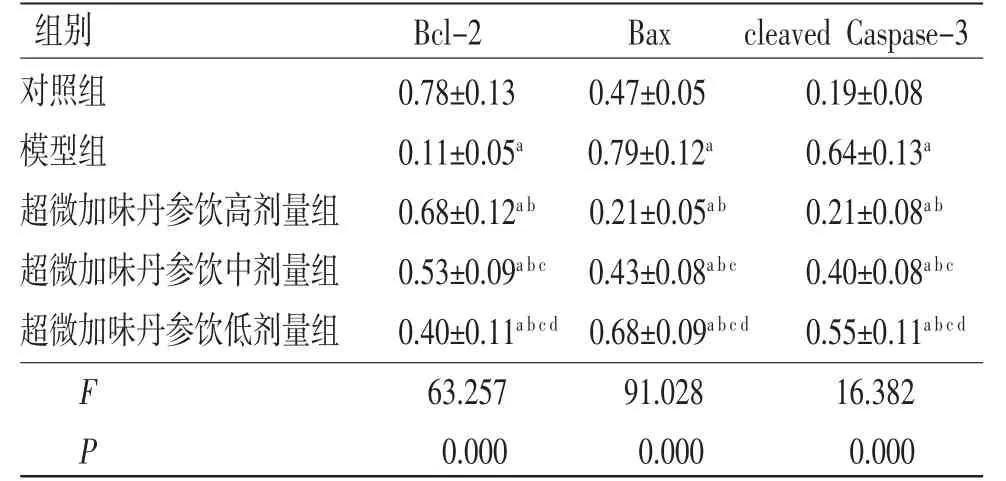
表2 各组内皮细胞中Bcl-2、Bax 和cleaved Caspase-3 蛋白相对表达量比较 (±s,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与超微加味丹参饮高剂量组比较,cP<0.05;与超微加味丹参饮中剂量组比较,dP<0.05
组别Bcl-2Baxcleaved Caspase-3对照组0.78±0.130.47±0.050.19±0.08模型组0.11±0.05a0.79±0.12a0.64±0.13a超微加味丹参饮高剂量组0.68±0.12ab0.21±0.05ab0.21±0.08ab超微加味丹参饮中剂量组0.53±0.09abc 0.43±0.08abc0.40±0.08abc超微加味丹参饮低剂量组0.40±0.11abcd 0.68±0.09abcd0.55±0.11abcd F 63.25791.02816.382 P 0.0000.0000.000
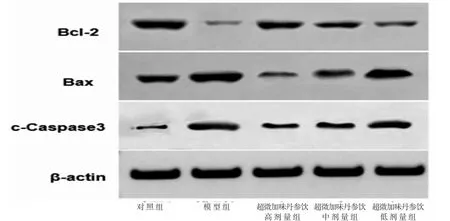
图3 各组内皮细胞中Bcl-2、Bax 和cleavedCaspase-3 蛋白表达Western blotting 图
3.5 各组内皮细胞MCP-1和VE-cadherin表达水平比较 与对照组比较,模型组内皮细胞MCP-1和VE-cadherin表达水平均明显升高(P<0.05);与模型组比较,超微加味丹参饮高、中、低剂量组内皮细胞MCP-1和VE-cadherin表达水平均明显降低(P<0.05),且超微加味丹参饮高、中、低剂量组内皮细胞MCP-1和VE-cadherin比较,差异均有统计学意义(P<0.05)。(见表3)
表3 各组内皮细胞MCP-1 和VE-cadherin 表达水平比较(±s,n=6)
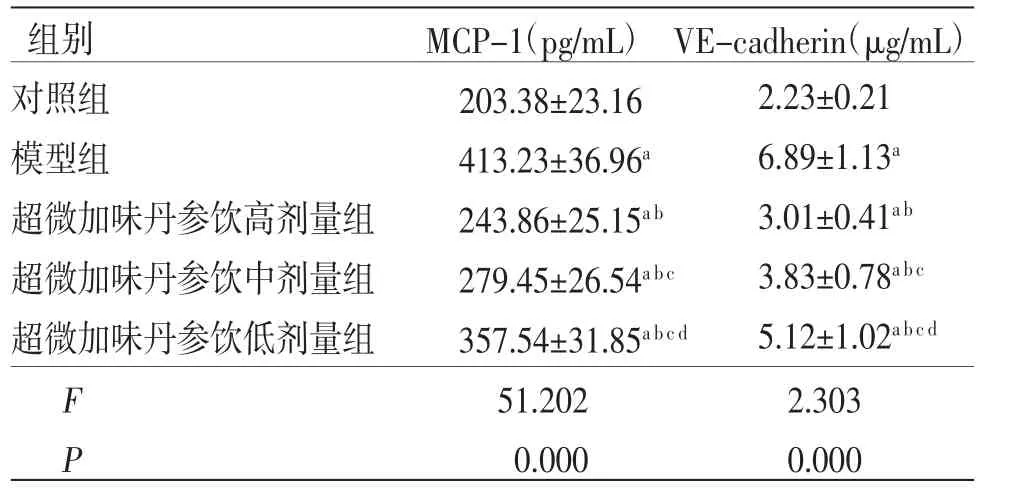
表3 各组内皮细胞MCP-1 和VE-cadherin 表达水平比较(±s,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与超微加味丹参饮高剂量组比较,cP<0.05;与超微加味丹参饮中剂量组比较,dP<0.05
组别MCP-1(pg/mL) VE-cadherin(μg/mL)对照组203.38±23.16模型组413.23±36.96a超微加味丹参饮高剂量组243.86±25.15ab超微加味丹参饮中剂量组279.45±26.54abc超微加味丹参饮低剂量组357.54±31.85abcd F 51.2022.303 P 0.0000.000 2.23±0.21 6.89±1.13a 3.01±0.41ab 3.83±0.78abc 5.12±1.02abcd
4 讨论
加味丹参饮由《时方歌括》中活血化瘀、行气止痛的中药名方丹参饮化裁而得。方中丹参苦微寒,归心、肝经,专入血分,内达脏腑而化瘀滞,外利关节而通脉络,具有活血、行气、止痛之功效,重用为君药;檀香辛温芳香,入脾、胃、肺经,为“理气要药”,善入气分,行气化滞,散寒止痛,为臣药;赤芍、川芎、红花活血祛瘀、行气止痛,同时可加强当归、生地黄扶正,养血活血通经之功效;诸药配合,共奏行气活血、通络止痛、祛瘀生新之效[6]。现代药理学研究[7-8]表明,丹参、檀香、赤芍、川芎、红花和当归均具有抗炎、抗氧化、抑制血小板聚集、抗血栓、抗动脉粥样硬化的作用,并可改善微循环、扩张冠脉血管、增加冠脉血流量、抗心肌损伤、保护血管内皮细胞。目前该方已广泛用于冠心病、心绞痛、心肌梗死、动脉粥样硬化、脑血栓等心脑血管疾病的治疗。
以往研究多探讨加味丹参饮对冠心病血管内皮细胞的影响[10],中药超微饮片是指通过超微粉体技术将传统中药饮片粉碎至1~75 μm的超微粉,既保留了中药材固有的生物活性物质基础,又可大大增加药材的比表面积,加快有效成分的溶出和吸收,可使临床用量减少至传统中药饮片的1/3,提高生物利用度、节约药材,具有广泛的应用前景[9]。目前超微加味丹参饮对冠心病血管内皮细胞的研究较少,故研究对此进行了分析。CoCl2为常见的化学性缺氧模拟剂,Co2+离子可通过置换细胞内脯氨酸羟化酶辅因子中的Fe2+离子,阻断低氧诱导因子-1α(hypoxia-inducing factor-1α, HIF-1α)的降解,可诱导内皮细胞、心肌细胞、PC12细胞和N9小胶质细胞等多种细胞缺氧损伤,是建立细胞缺氧损伤模型的理想药剂,具有高稳定性和高重复性的优点[11-12]。
近年来在对心血管疾病发病机制的研究中,多数学者均支持内皮损伤学说[13-15]。血管内皮细胞在诸如炎症因子、脂质浸润、血管痉挛等生理或病理因素的刺激下,细胞膜信号转导系统被激活,相关凋亡调控因子继而被启动,从而导致内皮细胞的凋亡。因此,保护内皮细胞功能和减少其凋亡可能成为治疗心血管疾病的新靶点。本研究应用CoCl2诱导形成大鼠冠状动脉内皮细胞损伤模型,观察不同剂量的超微加味丹参饮对内皮细胞的保护作用,结果显示:高、中、低剂量的超微加味丹参饮均可显著提高内皮细胞的生存率,改善凋亡相关蛋白Bcl-2、Bax和cleaved Caspase-3的相对表达,且3组之间存在量效关系,即随着超微加味丹参饮剂量的增大,对内皮细胞的保护作用越显著。吴若霞等[16]研究发现,加味丹参饮可有效提高缺氧损伤心肌细胞的存活率,减少其凋亡,从而对心肌细胞起到良好的保护作用。仇卫峰等[9]的研究表明,加味丹参饮对CHD所致内皮损伤的血管具有良好的保护作用,药物干预后血流速率加快,炎症因子表达降低,受损的内皮细胞形态得到显著的改善。
氧化应激指标可反映细胞的损伤程度,当血管内皮细胞发生缺血缺氧损伤时,ROS的表达水平升高,从而导致糖类、脂类、核酸及结构蛋白等的氧化性损伤[17];SOD为机体内重要的氧自由基清除剂,可借助于抗氧化和抗自由基功能而有效抵御氧自由基对机体的损伤,对减少机体的氧化应激损伤至关重要[18];MDA是机体氧化反应的产物之一,其表达水平可体现体内氧自由基的水平,进而反映机体氧化应激的损伤程度[19]。本研究中,高、中、低剂量的超微加味丹参饮可显著改善内皮细胞的氧化应激状态,且随着剂量的增大,其改善效果越明显,提示超微加味丹参饮可对抗细胞的氧化应激损伤,增强对氧自由基的清除能力,增加SOD的活性并减少MDA的产生,从而发挥对内皮细胞的保护作用。
血管内皮细胞钙黏蛋白(vascular endothelial cadherin,VE-cadherin)是钙黏素家族中的重要一员。MCP-1为趋化因子超家族中的一员,是一种重要的促炎性细胞因子,在机体发生炎症反应时由单核细胞、巨噬细胞、血管内皮细胞等分泌产生,且对单核/巨噬细胞具有特异性趋化激活作用,与动脉粥样硬化、类风湿关节炎、急性冠状动脉综合征等多种疾病的发生发展密切相关[20]。在内皮功能损伤的早期,MCP-1可促进单核细胞、巨噬细胞及T淋巴细胞等细胞在受损的血管内皮部位聚集、渗透,转变成巨噬细胞,进而吞噬脂质并形成泡沫,导致损伤的进一步加重[21]。VE-cadherin是钙黏素家族的重要一员,主要分布于各类上皮细胞,是血管内皮细胞之间黏附连接的关键分子,可调节血管内皮细胞极性、促进内皮细胞形态的变化、提高血管通透性,对维持内皮细胞的正常生理功能具有至关重要的作用[22-23]。当血管内皮损伤后,VE-cadherin会释放入血,导致患者血清VE-cadherin的升高。李世英等[24]的研究表明,MCP-1和VE-cadherin与内皮细胞功能密切相关,其表达水平与脑梗死及颈动脉粥样硬化的病情严重程度呈正相关。周晓艳等[25]的研究表明,MCP-1和VEcadherin分别具有趋化和黏附的功能,可加强炎症因子对内皮细胞的损伤,进一步加重脑梗死及动脉粥样硬化的发生发展,且急性前循环脑梗死及动脉粥样硬化患者的MCP-1和VE-cadherin的表达水平高于健康人群;该指标可反映患者的病情及临床类型。本研究结果同样显示,CoCl2诱导缺氧损伤的冠状动脉内皮细胞MCP-1和VE-cadherin的表达水平显著高于对照组,而经超微加味丹参饮干预后,其表达水平显著降低。目前,国内外对于加味丹参饮对MCP-1和VE-cadherin的表达研究甚少,主要研究集中在血清炎症因子,如IL-6及TNF-α的表达方面[26]。本研究探究了MCP-1和VE-cadherin的表达,主要是为机制的探究进行铺垫。本研究结果提示超微加味丹参饮可显著改善内皮细胞损伤,可能对心血管疾病具有一定的防治作用。此外,本研究仅选择了单一性别的雄性大鼠,主要是由于雄性大鼠对急性毒物(药物)耐受性强,对慢性毒物更敏感[27],此外也排除了雌性大鼠发育、生育对实验的干扰。
综上,超微加味丹参饮对CoCl2诱导损伤的大鼠冠状动脉内皮细胞具有良好的保护作用,可有效提高内皮细胞的存活率,改善凋亡相关蛋白的表达和氧化应激状态,降低MCP-1和VE-cadherin的表达。然而本实验并未研究其具体作用靶点,后续研究仍需对其分子机制进一步的深入研究。

