基于BMP/Smads/Runx2信号通路探讨桃红四物汤对创伤性股骨头坏死模型大鼠成骨化表达和病理形态学的影响
吴智恒,吴睿哲,荣 尚,马文元,孙绍裘
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第二附属医院,湖南 长沙 410005)
股骨头坏死(femoral head necrosis)为骨科、伤科的临床难治病,有着早期病情隐匿、临床进展快等特点。目前该病的治疗案例更多为侵入性治疗,这与以保髋为优先的临床倡导不适应,也不满足多数病患的社会生活及心理需求。该现状也向股骨头坏死的早期防治提出挑战。在尚缺乏特效药的情况下,近年国内临床诊疗指南提出了防治以保护血运、改善应力以延缓骨坏死程度等为目标,并倡导在早中期及功能需求高的患者人群中结合中医药的“活血化瘀”治法[1]。桃红四物汤作为“活血化瘀”法的经典方,在中医骨伤科疾病中的临床应用广泛,常用于股骨头坏死的防治。股骨头坏死的修复期,细胞成骨化对新骨再生十分重要[2-3]。经典的研究在生长因子对骨组织细胞成骨化的调节方面已有深刻认识[4-5]。近期研究提示,BMP/Smads/Runx2信号通路为间充质干细胞成骨分化的重要通路,并对骨组织细胞损伤有保护及修复意义[6-7]。而该信号通路的调控对治疗创伤性股骨头坏死的影响及桃红四物汤治疗股骨头坏死的具体机制尚待研究。创伤性股骨头坏死(traumatic osteonecrosis of the femoralhead,TONFH)是股骨头坏死的一大临床分型,该病病因相对确定(明显的创伤史),因此该类型早诊、早治疗较非创伤性股骨头坏死有利,疾病模型更单纯,基于这类模型的研究对股骨头坏死的早期诊疗和防治有较高参考价值。本实验通过手术模拟创伤建立创伤性股骨头坏死大鼠模型,用桃红四物汤口服汤剂进行干预对比,观察模型大鼠股骨头病理组织形态变化并观测骨组织BMP2、Smad1/5/8、Runx2的表达情况,进一步探讨桃红四物汤治疗创伤性股骨头坏死的作用机制。
1 材料与方法
1.1 实验动物 12周龄SPF级SD雄性大鼠35只,体质量250~300 g,由湖南斯莱克景达实验动物有限公司提供,实验动物质量合格证号:430727211100405535。实验单位使用许可证号:SYXK(湘)2019-0009。大鼠在实验室动物饲养间适应性喂养1周后开始实验。饲养条件:所有实验大鼠在同一屏障系统同一饲舍内分笼饲养,温度保持在20~25 ℃,湿度控制在40%~70%,每12 h交替开关饲舍内灯光模拟昼夜变化,空气由实验室内循环系统消杀过滤,提供标准大鼠饲料及蒸馏水,每日定时定量进行2次投喂,保持饲舍、饲笼清洁。实验中需取材或结束实验时,大鼠均采用过量麻醉法处死。实验大鼠涉及喂养、处置方式经湖南中医药大学动物实验福利伦理审查,伦理审查批准编号:LL2021031002。
1.2 药物与试剂 桃红四物汤,方药组成:生地黄20 g,当归20 g,赤芍20 g,川芎10 g,桃仁20 g,红花10 g。上述中药材超微颗粒剂由湖南中医药大学第二附属医院药剂科提供。BMP2兔抗体(批号:18933-1-AP)、Smad1兔抗体(批号:10429-1-AP)、HRP goat anti-mouse IgG(批号:SA00001-1)、HRP goat anti-rabbit IgG(批号:SA00001-2)均购于美国proteintech公司;Smad5兔抗体(批号:bs-13890R)、Smad8兔抗体(批号:bs-8844R)、Runx2兔抗体(批号:bs-1134R)均购于博奥森公司;mRNA逆转录试剂盒(批号:CW2569)、miRNA逆转录试剂盒(批号:CW2141)均购于北京康为世纪公司;苏木素-伊红染色试剂盒(批号:20210918)、Masson染色试剂盒(批号:20210918)均购于Wellbio公司。
1.3 主要仪器 TS-型1摇床、GL-88B型旋涡混合器(江苏其林贝尔公司);H1650R型台式冷冻离心机(湖南湘仪公司);PIKOREAL96型荧光定量RCP仪、SPL0960型荧光PCR板(美国Thermo公司);DYY-2C型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40D型转膜仪、DYCP-31DN型水平琼脂糖电泳槽(北京六一股份有限公司);JB-13型磁力搅拌器、PHS-3C型精密PH计(雷磁科技股份有限公司);JJ224BC型电子天平(美国双杰股份有限公司);BioPrep-24型生物样品均质仪(杭州奥盛科技公司);M199型切片刀(莱卡技术股份有限公司);YD-315型切片机(浙江金华益迪公司);BMJ-A型包埋机(常州中威电子仪器股份有限公司);BA210T型显微镜(Motic公司)。
1.4 造模与分组 35只SD大鼠适应性喂养1周后,采用完全随机分组法分成空白组、模型组、桃红四物汤低剂量组、桃红四物汤中剂量组、桃红四物汤高剂量组。除空白组外,其余4组大鼠参考经典股骨头血供剥离法造模[8]。具体操作:术前禁水、禁食12 h,腹腔麻醉大鼠,取俯卧位,由臀部背侧入路,切开皮肤、皮下组织及臀肌,定位在转子部不断分离软组织及韧带至髋关节囊,切断圆韧带并脱离股骨头,尽量剥离周围肌肉组织并剪出部分软组织,复位后清洗术口并逐层缝合。术后3 d内给予青霉素(5万U/d)肌内注射预防感染。造模过程中无大鼠死亡。造模后自然喂养4周。以大体形态学方法检验造模是否成功[9],即每组随机各抽取1只大鼠,用过量稀释水合氯醛麻醉处死,取术侧股骨头样本进行标本大体形态观察,若见股骨头关节软骨表面色泽暗淡无光泽,表面欠平整,股骨头结构扁平化、变形和塌陷甚至头颈分离,可证明造模成功。手术过程情况见图1,检验造模成功情况见图2。
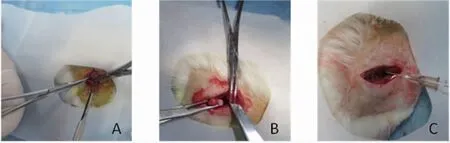
图1 股骨头造模手术过程示意图
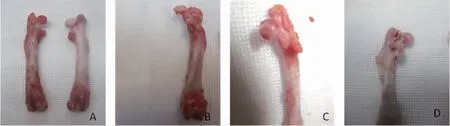
图2 抽取验证造模情况的股骨头大体观察
1.5 实验给药 根据人与动物用药剂量换算[9],D鼠=D人×R鼠/R人(D为给药剂量,R为动物与人体表面积比值系数的查表数值)计算桃红四物汤给药剂量,得出280 g体质量大鼠给药量约为2.5 g(8.9 g/kg),以此标准作为桃红四物汤中剂量组给药量,结合饲养中大鼠体质量增长变化情况,分组剂量按照2倍方式递增,将桃红四物汤低、中、高剂量组大鼠分别以4.4、8.9、17.8 g/kg给药,2次/d。空白组及模型组大鼠则灌服等体积生理盐水,2次/d,自然喂养,连续给药6周。
1.6 观察指标 干预6周后,所有大鼠进行股骨头取材。过量稀释水合氯醛麻醉处死大鼠后,同造模时入路,显露股骨周围肌肉组织后逐步剥离髋关节端及股骨下端直至股骨离体,清除骨面残余软组织。从中部将股骨横断,其中近股骨头段取切片进行HE染色及Masson染色观察骨组织病理形态;股骨下端部分组织在-80 ℃条件下冰冻保存,用于骨组织蛋白质及mRNA检测。
1.6.1 观察骨组织病理形态及计算空骨陷窝率 股骨头端骨浸入4%多聚甲醛通用型固定液固定1周后,进行常规脱钙后石蜡固定,切片后,以60 ℃烤片12 h,使用二甲苯用乙醇脱蜡、染色(分别进行苏木素-伊红染色和Masson试剂染色),最后用梯度酒精脱水,封存成片。光镜下观察HE染色骨组织切片,主要观察骨细胞、骨髓内造血组织、骨小梁形态、脂肪组织情况,再对每张切片光镜×200视野下随机抽取5个区域,计数空骨陷窝数[10],计算5张随机视野的平均空骨陷窝率。空骨陷窝率=(空骨陷窝数/50)×100%。光镜下观察Masson染色骨组织切片,观察骨组织及周围组织的肌肉组织情况和纤维组织情况。肌纤维组织染色呈红色,胶原纤维组织染色呈蓝色。计算机测算IOD/Area值代表胶原纤维图像占比。
1.6.2 RT-PCR检测骨组织BMP2 mRNA、Smad1/5/8 mRNA、Runx2 mRNA表达水平 Trizol提取骨组织总RNA,紫外分光光度计测定浓度;以组织总mRNA为模板,逆转录cDNA;SYBR法加入对应引物进行PCR扩增,最终反应体系为30 μL,确定扩增条件为95 ℃,并进行10 min的预变性,在95 ℃条件下变性15 s,在60 ℃条件下退火30 s,如此循环40次,充分延展后电泳成像,扫描定量。各指标的引物序列见表1。

表1 基因引物序列
1.6.3 Western blotting测定骨组织BMP2、Smad1/5/8、Runx2蛋白表达水平 剪取骨组织,预冷PBS清洗骨组织,加入350 μL RIPA裂解液研磨,冰上、裂解后移至离心管内,预冷离心机以12 000 r/min离心15 min,经TEMED制胶。取200 μL蛋白上清,加入50 μL 5×loading buffer混匀、煮沸、速冷,根据蛋白定量结果,以75 V电压行凝胶电泳分离130 min,湿法转膜,PBST配制5%脱脂奶粉静置低温过夜封闭,混合工作浓度1∶500的兔抗大鼠BMP2一抗转膜60 min,1∶1 000的兔抗大鼠Smad1/5/8一抗70 min、1∶1 000的兔抗大鼠Runx2一抗90 min,加入PBST 1∶5 000稀释HRP标记的二抗,室温孵育90 min,ECL发光,暗盒显影,以Quantity One系统分析蛋白条带并获取并分析其灰度。以目标条带灰度值和内参蛋白灰度值比值代表蛋白相对表达量。
1.7 统计学方法 采用SPSS 26.0统计软件进行分析,计量资料以(±s)表示,若数据满足正态性、方差齐性,多组比较采用单因素方差分析,两两比较采用LSD法;不满足方差齐性,则采用Games-Howell法比较。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠股骨头病理形态学描述 HE染色显示,空白组大鼠股骨头钙化组织严密,骨小梁排列整齐,骨小梁中散在一定量的含红细胞、造血细胞组织,骨细胞、软骨细胞饱满,细胞核清晰,脂肪细胞少;模型组大鼠股骨头钙化组织比例低,骨小梁松散,排列无规则,造血细胞少,骨细胞及软骨细胞欠饱满,脂肪细胞比例高;桃红四物汤低、中、高剂量组大鼠骨小梁组织多且排列紧密,造血细胞丰富,骨细胞、软骨细胞少于空白组,而多于模型组,脂肪细胞比例多于空白组,少于模型组,骨小梁内造血细胞含量较多。Masson染色显示,在大鼠股骨头肌纤维比例比较中,空白组大鼠股骨头肌纤维分布更加紧密连贯,模型组大鼠肌纤维含量比例低于空白组,桃红四物汤低、中、高剂量组大鼠肌纤维含量比例高于模型组;在大鼠股骨头胶原纤维比例比较中,空白组大鼠胶原纤维比例最低,模型组大鼠胶原纤维比例高于空白组,桃红四物汤高、中、低剂量组大鼠胶原纤维比例均低于模型组,桃红四物汤中、高剂量组大鼠胶原纤维比例均低于桃红四物汤低剂量组,桃红四物汤中剂量组与桃红四物汤低剂量组胶原纤维比例差异不明显。(见图3~4)
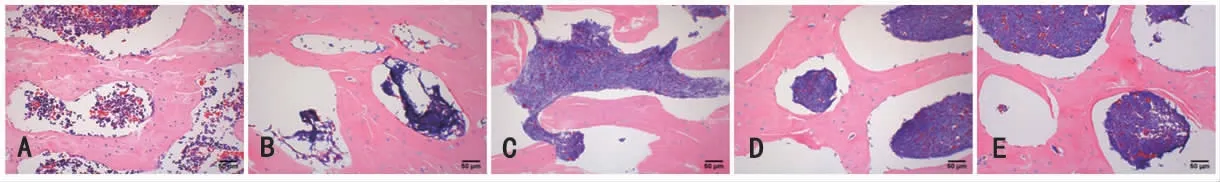
图3 各组大鼠股骨头切片标本HE 染色情况 (×200)
2.2 各组大鼠股骨头空骨陷窝率、IOD/Area比值比较 与空白组比较,模型组大鼠股骨头空骨陷窝率、IOD/Area比值均明显升高(P<0.05);与模型组比较,桃红四物汤低剂量组大鼠股骨头空骨陷窝率、IOD/Area比值均明显升高(P<0.05),桃红四物汤高剂量组大鼠股骨头空骨陷窝率、IOD/Area比值均明显降低(P<0.05);桃红四物汤中剂量组大鼠股骨头空骨陷窝率明显低于模型组(P<0.05),IOD/Area比值明显高于模型组(P<0.05);桃红四物汤高剂量组大鼠股骨头空骨陷窝率、IOD/Area比值与空白组比较,差异无统计学意义(P>0.05)。(见图5、表2)
表2 各组大鼠股骨头空骨陷窝率及IOD/Area比值比较 (±s)
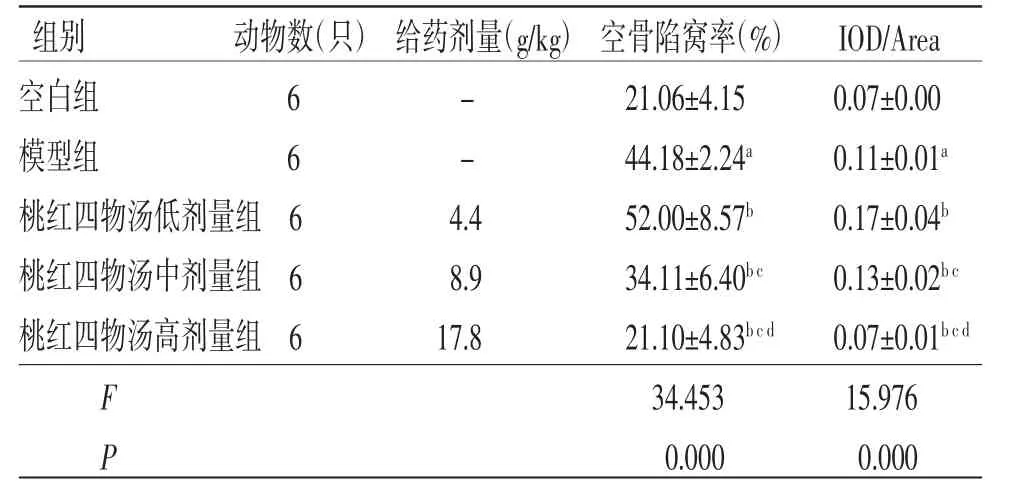
表2 各组大鼠股骨头空骨陷窝率及IOD/Area比值比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与桃红四物汤低剂量组比较,cP<0.05;与桃红四物汤中剂量组比较,dP<0.05
组别动物数(只) 给药剂量(g/kg) 空骨陷窝率(%) IOD/Area空白组6-21.06±4.150.07±0.00模型组6-44.18±2.24a0.11±0.01a桃红四物汤低剂量组 64.452.00±8.57b0.17±0.04b桃红四物汤中剂量组 68.934.11±6.40bc0.13±0.02bc桃红四物汤高剂量组 617.821.10±4.83bcd0.07±0.01bcd F 34.45315.976 P 0.0000.000
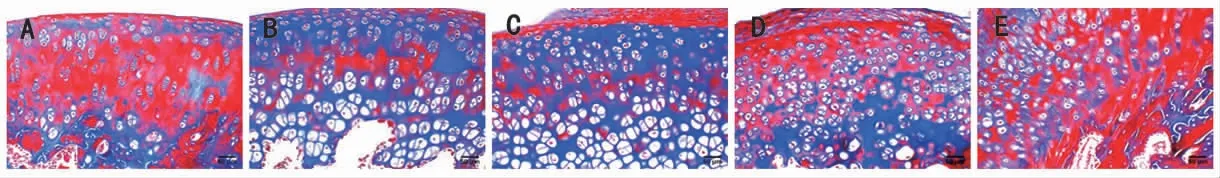
图4 各组大鼠股骨头切片标本Masson 染色情况 (×200)
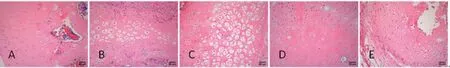
图5 各组大鼠股骨头空骨陷窝情况 (×200)
2.3 各组大鼠股骨头局部组织细胞中的BMP2 mRNA、Smad1 mRNA、Smad5 mRNA、Smad8 mRNA、Runx2 mRNA相对表达量比较 与空白组比较,模型组大鼠股骨头局部组织细胞中的BMP2 mRNA、Smad1 mRNA、Smad5 mRNA、Smad8 mRNA、Runx2 mRNA相对表达量均明显降低(P<0.05);与模型组比较,桃红四物汤低、中、高剂量组大鼠股骨头局部组织细胞中的BMP2 mRNA、Smad1 mRNA、Smad5 mRNA、Smad8 mRNA、Runx2 mRNA相对表达量均明显升高(P<0.05),且桃红四物汤高剂量组大鼠股骨头局部组织细胞中的BMP2 mRNA、Smad1 mRNA、Smad5 mRNA、Smad8 mRNA、Runx2 mRNA相对表达量均明显高于桃红四物汤中剂量组(P<0.05);桃红四物汤中剂量组大鼠股骨头局部组织细胞中的BMP2 mRNA、Smad1 mRNA、Smad5 mRNA、Smad8 mRNA、Runx2 mRNA相对表达量均明显高于桃红四物汤低剂量组(P<0.05)。(见表3)
表3 各组大鼠股骨头局部组织细胞中BMP2 mRNA、Smad1 mRNA、Smad5 mRNA、Smad8 mRNA、Runx2 mRNA相对表达量比较 (±s)
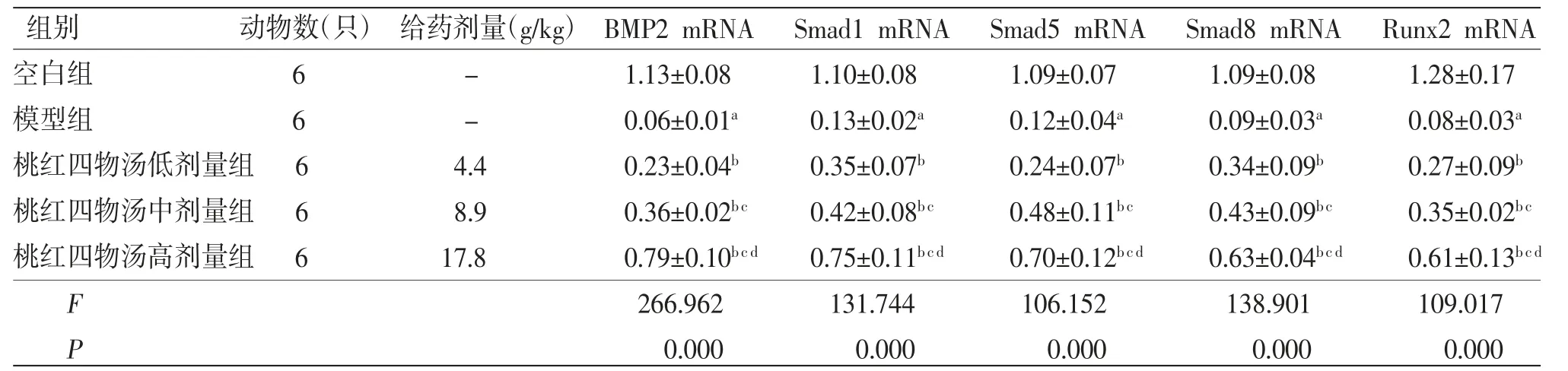
表3 各组大鼠股骨头局部组织细胞中BMP2 mRNA、Smad1 mRNA、Smad5 mRNA、Smad8 mRNA、Runx2 mRNA相对表达量比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与桃红四物汤低剂量组比较,cP<0.05;与桃红四物汤中剂量组比较,dP<0.05
组别动物数(只) 给药剂量(g/kg) BMP2 mRNA Smad1 mRNA Smad5 mRNA Smad8 mRNA Runx2 mRNA空白组6-1.13±0.081.10±0.081.09±0.071.09±0.081.28±0.17模型组6-0.06±0.01a0.13±0.02a0.12±0.04a0.09±0.03a0.08±0.03a桃红四物汤低剂量组 64.40.23±0.04b0.35±0.07b0.24±0.07b0.34±0.09b0.27±0.09b桃红四物汤中剂量组 68.90.36±0.02bc0.42±0.08bc0.48±0.11bc0.43±0.09bc0.35±0.02bc桃红四物汤高剂量组 617.80.79±0.10bcd0.75±0.11bcd0.70±0.12bcd0.63±0.04bcd0.61±0.13bcd F 266.962131.744106.152138.901109.017 P 0.0000.0000.0000.0000.000
2.4 各组大鼠股骨头局部组织细胞中BMP2、Smad1、Smad5、Smad8、Runx2蛋白相对表达量比较 与空白组比较,模型组大鼠股骨头局部组织细胞中的BMP2、Smad1、Smad5、Smad8、Runx2蛋白相对表达量均明显降低(P<0.05);与模型组比较,桃红四物汤低、中、高剂量组大鼠股骨头局部组织细胞中的BMP2、Smad1、Smad5、Smad8、Runx2蛋白相对表达量均明显升高(P<0.05),且桃红四物汤高剂量组大鼠股骨头局部组织细胞中的BMP2、Smad1、Smad5、Smad8、Runx2蛋白相对表达量均明显高于桃红四物汤中剂量组(P<0.05);桃红四物汤中剂量组大鼠股骨头局部组织细胞中的BMP2、Smad1、Smad5、Smad8、Runx2蛋白相对表达量均明显高于桃红四物汤低剂量组(P<0.05)。(见表4、图6)
表4 各组大鼠股骨头局部组织细胞中BMP2、Smad1、Smad5、Smad8、Runx2 蛋白相对表达量比较 (±s)
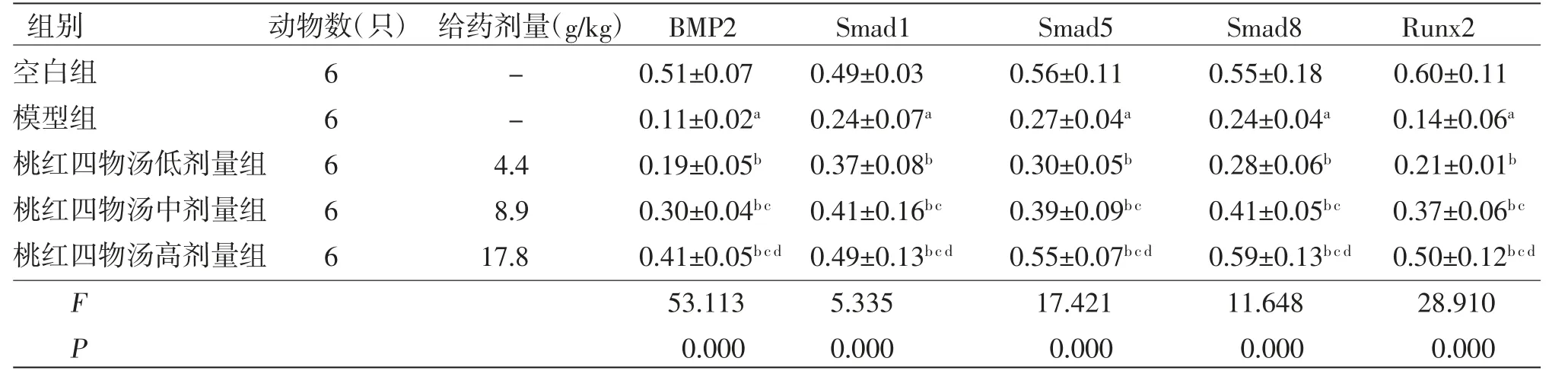
表4 各组大鼠股骨头局部组织细胞中BMP2、Smad1、Smad5、Smad8、Runx2 蛋白相对表达量比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与桃红四物汤低剂量组比较,cP<0.05;与桃红四物汤中剂量组比较,dP<0.05
组别动物数(只) 给药剂量(g/kg) BMP2Smad1Smad5Smad8Runx2空白组6-0.51±0.070.49±0.030.56±0.110.55±0.180.60±0.11模型组6-0.11±0.02a0.24±0.07a0.27±0.04a0.24±0.04a0.14±0.06a桃红四物汤低剂量组64.40.19±0.05b0.37±0.08b0.30±0.05b0.28±0.06b0.21±0.01b桃红四物汤中剂量组68.90.30±0.04bc 0.41±0.16bc0.39±0.09bc0.41±0.05bc0.37±0.06bc桃红四物汤高剂量组617.80.41±0.05bcd 0.49±0.13bcd0.55±0.07bcd0.59±0.13bcd 0.50±0.12bcd F 53.1135.33517.42111.64828.910 P 0.0000.0000.0000.0000.000
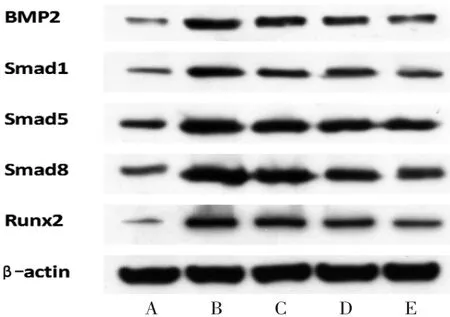
图6 各组大鼠股骨头局部组织细胞中BMP2、Smad1、Smad5、Smad8、Runx2 蛋白表达Western blotting 图
3 讨论
创伤性股骨头坏死本质为一种股骨头的缺血性坏死[11],是常见于骨折后因外力因素造成股骨头血液供应被直接破坏进而引起的严重并发症。外伤致股骨颈/头骨折常为其原发疾病。损伤部位可伴随着急慢性骨关节炎[12]、骨细胞缺乏正常营养等,且骨组织的修复能力相对低下时,该疾病的一般病程表现为股骨头部发生骨细胞的变性、坏死,骨小梁结构改变,最终可出现骨组织塌陷[13],从而影响髋关节结构和功能。中医学中多把股骨头坏死认定为以“血瘀”为主的伤科疾病,且在病程的早中期以“活血化瘀”为基本治法。桃红四物汤为清代吴谦所著《医宗金鉴·妇科心法要诀》中收载的活血化瘀之要方,后世以其活血化瘀兼补血养血的方义而广泛应用于骨伤疾病。其配伍精当,活血而不留瘀,对于骨折病、下肢血栓、股骨头坏死等骨科疾病有明确疗效[14],同时对骨科术后应激反应也有缓解作用[15]。康斯文等[16]研究发现,在运用保髋手术的基础上使用该方能显著提高股骨头坏死患者血清骨碱性磷酸酶水平,降低骨钙素水平,并能促进髋关节功能的恢复。姚金龙等[17]以患者疼痛症状和髋关节活动度评价桃红四物汤治疗股骨头坏死的疗效,结果表明桃红四物汤在改善临床症状方面疗效肯定。
成骨本身即是血管系统和间叶细胞成骨分化的共同结果。徐世红等[18]使用桃红四物汤含药血清干预骨髓间充质干细胞,与对照组比较,发现ALP表达上调,同时细胞群组吸光度的提升证明了该方对骨髓间充质干细胞的增殖影响。一些对桃红四物汤单药的药理研究实验证明了川芎嗪、当归多糖、赤芍总苷等单药成分是促进骨细胞再生、骨髓内造血细胞增生和血管内皮重构、抑制炎症因子及抗凝血、抗血栓形成的有效成分[19-23]。这为探讨桃红四物汤治疗骨损伤和骨坏死疾病的机制提供了研究方向。
成骨化蛋白信号层面的研究已开展多年。早期就有研究发现骨形态发生蛋白(bone morphogenetic protein,BMP)、Smads是经典的成骨信号蛋白因子。BMP是一种多功能的细胞生长因子,它在骨形成、修复、再生中发挥关键性作用[24]。其亚型BMP2在促进骨形成和成骨分化中较活跃。BMP2在骨细胞分化过程中是重要的细胞外信号[25],可结合间充质干细胞细胞膜上的两种跨膜丝氨酸/苏氨酸激酶受体向胞内传达成骨、成软骨等诱导信号[26-27]。Smads是BMP胞内信号转导的介导蛋白,分为受体调节型Smads(R-Smads)、共同中间型Smads(Co-Smads)、抑制性Smads(I-Smads)三大类。亚型中Smad1/5/8都是受体调节型,可与Co-Smads形成异源复合物后将胞浆内信号转导入胞核[28]。近年研究发现BMP-Smads通路的成骨信号在胞内转导有诸多因子的参与。其中Runx2又称核结合因子(core-binding factor subunit alpha-1,Cbfα1),为重要的成骨细胞分化转录因子,其向上表达受到BMP对Smad1/5/8通路的调节,使成骨化信号发生不可逆调整[29]。
近年来,研究者对BMP2/Smads/Runx2成骨化信号通路的成骨化机制展开了探究。一些实验着眼于该信号通路对细胞内外的经典细胞因子的调控。离体实验[30-33]证明BMP2、Smad1/5、Runx2的表达上调对成骨细胞因子ALP、CollagenⅠ、骨钙素、BGP、OPN有上调作用。田照[34]研究认为BMP2/Smads/Runx2-Osterix成骨分化通路中,Runx2和Osterix有时序性差异。也有研究揭示了BMP2/Smads/Runx2通路在骨及骨组织损伤的保护作用对成骨化起到了协同作用,如骨质疏松症所致的骨量丢失是成骨破骨平衡破坏的常见结果。骨质疏松症的相关研究[35-37]发现,BMP2/Smads/Runx2通路信号上调,有利于抗骨量丢失和骨组织形成,从而提高骨密度。有研究显示骨损伤的保护和BMP2/Smad1/Runx2通路上调与超氧化物歧化酶、丙二醛水平降低有关[38]。上述研究证明BMP2/Smads/Runx2信号通路可通过调节成骨信号表达、抗骨量丢失和缓解骨组织损伤等多个方面促进成骨化。
与空白组比较,模型组大鼠于大体观察和骨组织病理切片中均存在明显的骨与钙质的丢失,空骨陷窝率高,骨小梁结构破坏严重,骨质含量低,造血细胞含量少,抗组织胶原纤维化能力差,骨组织细胞中BMP2 mRNA、Smad1/5/8 mRNA、Runx2 mRNA相对表达量低,骨组织细胞中BMP2、Smad1/5/8、Runx2蛋白表达量低;与模型组比较,桃红四物汤低、中、高剂量组大鼠骨小梁结构、骨质含量、造血细胞等方面有不同程度改善,骨组织细胞中BMP2、Smad1/5/8、Runx2的蛋白表达及mRNA相对表达量均明显升高;桃红四物汤高剂量组大鼠股骨头空骨陷窝率、IOD/Area比值均明显低于模型组。本研究结果结合他人研究和论述显示,上述信号因子之间在间充质干细胞的成骨分化中有连贯的、促进性的通路关系,但无法证明该通路的成骨作用的优势性。桃红四物汤低、中、高剂量组中各个因子在组织及细胞内表达量的差异提示该信号通路的表达上调程度与桃红四物汤药物剂量可能呈正相关关系。桃红四物汤能改善股骨头损伤表现和延缓股骨头坏死进程的病理学表现,且各组空骨陷窝率的差异比较中呈现出对较高剂量的依赖性,但当前的实验无法确定桃红四物汤与治疗股骨头坏死病情的有效血药浓度范围,需进一步扩大样本量及进行药理实验。Masson染色显示的骨组织切片中胶原纤维比例变化有差异性,可以提示桃红四物汤可能影响了胶原纤维对损伤后的骨组织的填充情况,但未呈现明确量效关系,仍需进一步实验证明。
综上所述,桃红四物汤可以改善创伤性股骨头坏死模型大鼠股骨头的病理表现,可能与通过活化BMP2/Smads/Runx2通路,提高股骨头损伤局部骨组织的成骨化表达有关。

