边界病病毒RT-PCR检测方法的建立和应用
毛 立,张纹纹,李文良,杨蕾蕾,孙 敏,程子龙,李基棕,郝 飞,刘茂军
(江苏省农业科学院 兽医研究所 农业农村部兽用生物制品工程技术重点实验室,江苏 南京 210014)
边界病(border disease)又称羔羊被毛颤抖病,是由边界病病毒(border disease virus,BDV)感染引起,主要感染山羊、绵羊、牛和部分野生反刍动物。1959年,BDV在英格兰和威尔士边界地区的妊娠母羊中首次发现,由于该病发现于边界地区,因此命名为边界病。该病在全球均有分布,包括英国、美国、日本、瑞典、新西兰、澳大利亚、加拿大、西班牙等许多养羊业发达国家均有BDV流行的报道[1],2012年,我国也从安徽、江苏两省的腹泻山羊中检测到BDV[2-3]。
BDV属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),与牛病毒性腹泻病毒1型(bovine viral diarrhea/mucosal disease virus type 1,BVDV-1)、牛病毒性腹泻病毒2型(bovine viral diarrhea/mucosal disease virus type 2,BVDV-2)及猪瘟病毒(classical swine fever virus,CSFV)同属。目前根据BDV基因组,将BDV分为8个基因亚型,分别为BDV-1~BDV-8[4]。从基因组、抗原和血清学研究水平表明,BDV与CSFV的关系更加密切,抗原性更加接近,进化关系上亲缘关系也更近。但是,BDV感染动物后产生的症状与BVDV极为相似,主要以羔羊生长不良、神经异常、腹泻、流产、胎儿发育不良和畸形等为特征[1,5],感染后可导致较高的阳性率,混合感染可明显加剧临床症状,部分感染动物出现水样腹泻并死亡,母羊则出现流产、死胎等症状。妊娠母羊感染该病毒后,还可导致胎儿持续感染成为病毒携带者和传染源,经垂直传播或水平传播给健康羊群。而且边界病感染后可导致动物机体出现免疫抑制现象,感染猪可影响猪瘟疫苗的免疫效果[6]。
BDV是羊的重要传染病,很多地区的基层兽医及养殖户不了解该疾病,而且该病无特效药治疗及有效的疫苗预防,防治困难,对养羊业健康发展造成威胁。鉴于BDV与BVDV都可感染山羊和绵羊,感染后症状相似,而且同属于黄病毒科瘟病毒属,因此建立可鉴别诊断BDV的检测方法,快速、准确地检测病原,可及时采取有效的防控措施,隔离感染及发病动物,清除传染源,降低本病发病率,减少畜牧业经济损失,促进养羊业健康发展。
1 材料与方法
1.1 病毒株与样品BDV JSYZ14株、BDV JSLS12-01株、BVDV-2毒株由本实验室保存,BVDV-1 C24V毒株购自中国兽医药品监察所。BDV病料来自2016年江苏省仪征市某羊场JSYZ14株持续感染山羊和2020年JSYZ14株人工感染山羊,采集心脏、肝脏、脾脏、肺脏、肾脏、淋巴、卵巢、脑等组织样品,经磨碎冻融后提取总RNA进行检测。
1.2 主要试剂病毒RNA提取试剂盒、DNA胶回收试剂盒购自Axygen公司,一步法RT-PCR试剂盒、pMD18-T、DNA Marker购自宝生物(大连)股份有限公司,DH5α感受态细胞购自擎科生物公司。
1.3 引物设计及标准品质粒构建根据GenBank收录的BDV1-8、BVDV-1、BVDV-2、CSFV基因序列,利用Primer Primier 5.0软件,设计针对BDV的特异引物,该引物在BDV各毒株中高度保守,但是与BVDV-1、BVDV-2及CSFV毒株序列具有较大差异或存在核酸缺失,以保证引物在检测中特异扩增。
提取BDV JSYZ14株RNA,利用引物对BD12F/BD12R对目的基因进行RT-PCR扩增,将纯化的目的片段克隆入pMD18-T载体,挑取菌落经PCR鉴定后,将含有目的片段的阳性质粒送生工生物工程(上海)股份有限公司测序,测序正确的重组质粒作为BDV质粒标准品,利用超微量分光光度计检测重组质粒标准品浓度并换算成拷贝数,标准品质粒于-20℃保存备用。
1.4 反应体系及条件的优化采用20 μL RT-PCR 反应体系,使用Transgen公司EasyScriptTMOne Step RT-PCR Kit配制反应体系:2×R-Mix 10 μL,上、下游引物各0.5 μL,E-Mix 0.4 μL,提取的核酸 4 μL,RNase Free dH2O 4.6 μL。反应程序:45℃反转录30 min;94℃预变性5 min;94℃变性30 s,分别设定48,51,54,57,60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。优化其最佳反应退火温度。
1.5 特异性试验利用本实验室保存的BDV、BVDV-1、BVDV-2、CSFV,提取RNA作为模板,利用所建立的RT-PCR方法分别进行扩增,评价该方法的特异性。
1.6 敏感性试验将BDV标准品质粒10倍倍比稀释后作为模板(10-1~107拷贝/μL),并以去离子水为阴性对照,利用建立的RT-PCR方法进行扩增,根据扩增的目的条带评价该方法的敏感性。
1.7 临床样品的检测采集BDV JSYZ14株持续感染和人工感染山羊的心脏、肝脏、脾脏、肺脏、肾脏、淋巴、卵巢、脑等器官,研磨后提取各组织中RNA,用建立的RT-PCR方法分别检测上述样品RNA,评价该方法是否可用于临床检测及BDV在各脏器内的分布情况。
2 结果
2.1 BDV序列比对及引物设计根据GenBank收录的BDV1-8全基因组序列、BVDV-1、BVDV-2、BVDV-3、CSFV、Pronghorn pestivirus、Bungowannah virus及非典型猪瘟病毒1型全基因序列进行进化分析,同时比对各毒株全基因组序列。选择BDV保守序列,根据Primer Primier 5.0软件,设计针对BDV的特异引物,该引物在BDV各亚型毒株中高度保守,但是与BVDV-1、BVDV-2及CSFV等毒株序列具有较大差异或存在核酸缺失,以保证引物在检测时可特异扩增目的片段。以BDV JSLS12-01(GenBank:KC963426)作为参考毒株序列,引物序列为:BD12F:5′-TACAAGACCTRAA-GAGGACAGG-3′(11 605~11 626);BD12R:5′-T-TYCAGGTAAAGTGCTGTAGTT-3′(12 156~12 177)。
2.2 BDV标准品质粒的构建与鉴定以BDV JSLS12-01株 RNA为模板,利用设计的引物进行RT-PCR扩增,经琼脂糖凝胶电泳检测,获得568 bp大小的片段,与预期片段大小一致。PCR产物经回收后连接到pMD18-T载体,转化DH5α感受态细胞后,挑取阳性菌落进行PCR鉴定和双酶切鉴定,阳性质粒经测序鉴定其与BDV JSLS12-01株基因片段同源性为100%。结果表明,pMD18-T-BDV重组质粒构建正确,经超微量分光光度计检测质粒浓度,计算其拷贝数为3.78×108拷贝/μL。
2.3 RT-PCR反应条件优化采用20 μL的RT-PCR 反应体系,反应程序为:45℃反转录30 min;94℃预变性5 min;94℃变性30 s,分别设定48,51,54,57,60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。经优化其最佳反应退火温度发现,该引物在48~60℃退火温度区间均可使用,扩增效率无明显差异且无非特异扩增,最终确定最佳退火温度在48~60℃之间均可使用(图1)。
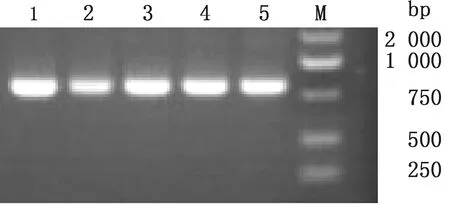
M.DL2000 DNA Marker;1~5.48,51,54,57,60℃
2.4 敏感性以10倍倍比稀释的BDV重组质粒标准品(10-1~107拷贝/μL)为模板,同时设置ddH2O为阴性对照,用建立的方法进行RT-PCR扩增。结果显示,该方法对BDV重组质粒标准品的检测下限为101拷贝/μL,说明建立的方法灵敏度极高(图2)。
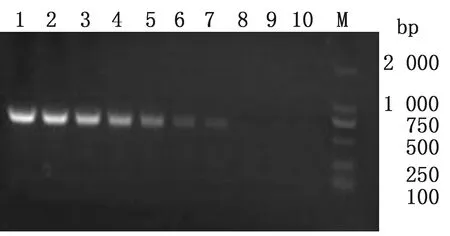
1~9.107~10-1 拷贝/μL质粒标准品;10.阴性对照;M.DL2000 DNA Marker
2.5 特异性用建立的检测方法分别检测BDV JSLS12-01株、BDV JSYZ14株、BVDV-1、BVDV-2、CSFV的RNA,2株BDV毒株均扩增出570 bp左右的条带,而检测瘟病毒属的其他3种病毒均无条带,说明该方法具有良好的特异性(图3)。
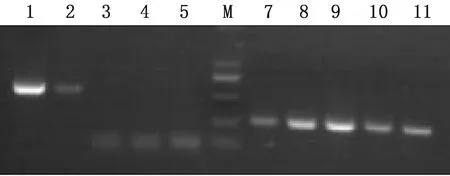
M.DL2000 DNA Marker;1~5.BD12F/R引物检测;7~11.瘟病毒通用引物检测;1,2,7,8.BDV;3,9.BVDV-1;4,10.BVDV-2;5,11.CSFV
2.6 样品检测用建立的RT-PCR检测方法分别检测BDV JSYZ14株持续感染山羊,取心脏、肝脏、脾脏、肺脏、肾脏、淋巴结、卵巢、脑等器官,研磨后提取各组织中RNA,在各脏器中均检测到570 bp左右特异性条带,说明该方法具有良好的应用前景,可用于各脏器检测BDV,同时也说明BDV感染后病毒在各脏器中均有分布,其中淋巴和脑中分布丰度较高(图4)。但同时也发现,用BDV JSYZ14株人工感染山羊后,仅在感染后3~7 d从其血清、外周血淋巴细胞、肠系膜淋巴结、颌下淋巴结处检测到BDV,而心脏、肝脏、脾脏、肺脏、肾脏、肠、脑等器官中均未检测到BDV,说明BDV持续感染后全身各脏器都含有大量病毒,并可能通过各种途径向外排毒,而人工感染均为一过性感染,未出现明显症状,仅在血液、淋巴结等组织中检测到病毒,而且持续时间较短,与临床一过性感染症状相似。
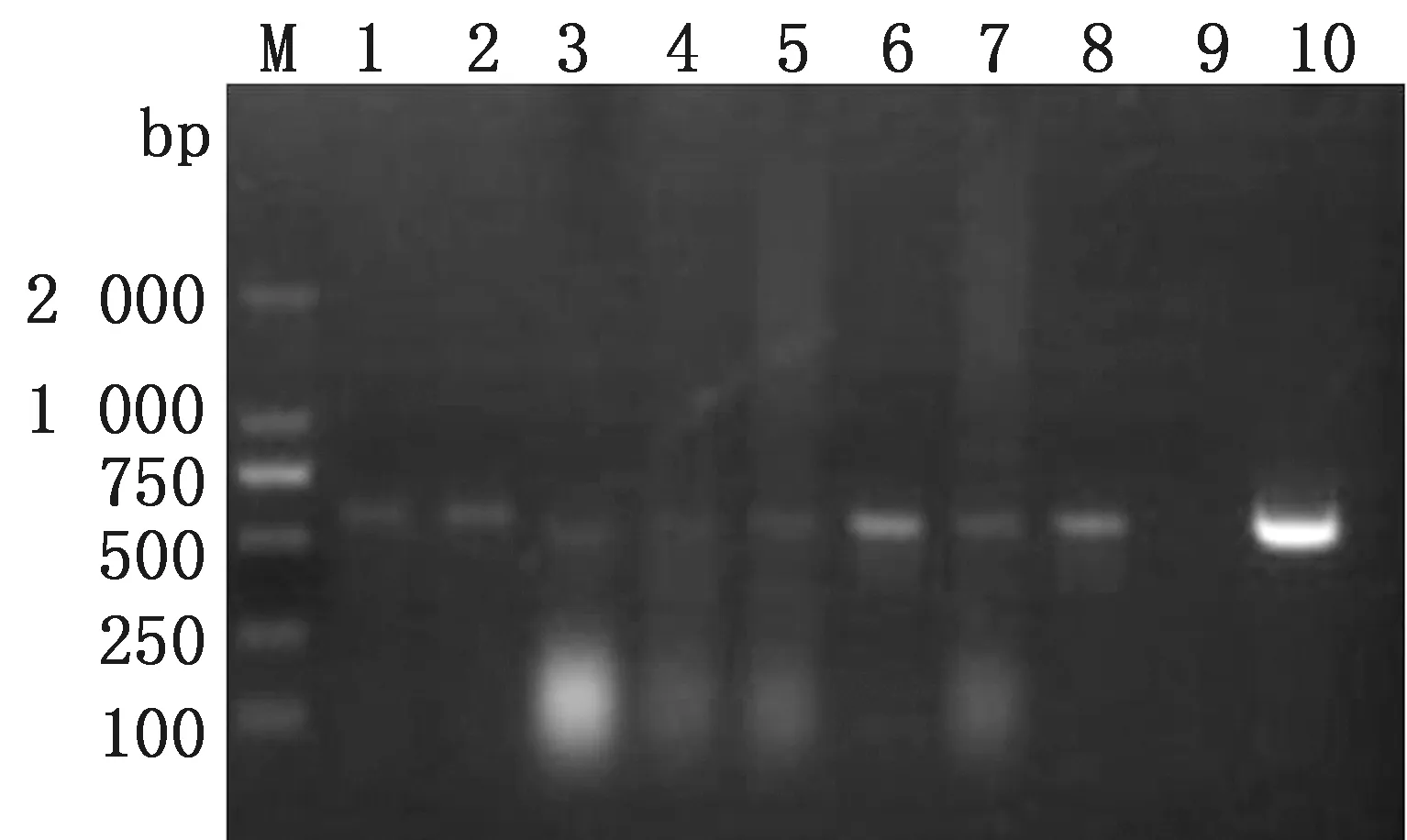
M.DL2000 DNA Marker;1~8.检测各组织中BDV分布,分别为心脏、肝脏、脾脏、肺脏、肾脏、淋巴、卵巢、脑组织;9.阴性对照;10.阳性对照
3 讨论
BDV的主要易感动物是山羊和绵羊,但是报道牛、猪和其他野生小反刍动物也可感染,没有严格的宿主特异性。目前报道BDV的国家主要分布在美国和欧洲部分国家[1]。2012年,我国首次在安徽和江苏省发生腹泻的山羊中检测并分离到BDV-3[2-4],随后该病毒相继在山东和新疆等地发现[7-8]。BDV导致的危害主要是母羊不孕、流产和产弱羔等繁殖性疾病,但长期感染BDV的羊可能因为持续腹泻而导致肠道疾病。目前在国内BDV感染症状主要包括腹泻、流产、持续感染和生长迟缓。其中BDV持续感染造成更加严重的危害,这种感染主要发生在目前怀孕早期,胎儿获得免疫能力之前,由此产下的羔羊一般为持续感染山羊。新生羔羊对BDV产生免疫耐受,并持续向外排毒。而且进一步试验还证实,BDV感染动物可导致免疫抑制,如BDV感染猪后,可明显干扰猪瘟疫苗的免疫效果,导致猪瘟疫苗免疫抗体产生被抑制[6]。由此可见,BDV感染后可导致比较严重的危害。由于BDV亚型众多,有BDV-1~BDV-8共8个亚型,各亚型之间具有差异,导致BDV检测困难。在临床中,BDV和BVDV-1、BVDV-2感染都可导致腹泻、流产、死胎、免疫抑制和持续感染,而BDV与BVDV-1、BVDV-2同属于黄病毒科瘟病毒属,在基因水平上有一定的同源性,因此设计特异的引物检测BDV非常必要,这要求引物可以检测BDV-1~BDV-8各种亚型,同时可以鉴别检测BVDV-1、BVDV-2和CSFV,但是目前尚无可以鉴别检测BDV、BVDV-1、BVDV-2和CSFV的RT-PCR方法。
本试验建立的BDV RT-PCR方法针对该病毒的3′-UTR区域,BDV-1~BDV-8各亚型在引物序列区域均具有较好的保守性,而且与BVDV-1、BVDV-2、BVDV-3、CSFV、Bungowannah病毒等差异都较大,且上述5种病毒在下游引物序列区域均有核苷酸缺失,在PCR方法中可以利用该缺失特异地检测BDV。本试验检测结果也表明,BDV 12F/12R引物可特异扩增BDV毒株提取RNA,但检测BVDV-1、BVDV-2、CSFV病毒提取的RNA均无目的条带,说明该引物对具有良好的特异性。此外,敏感性试验显示该方法的检测下限为101拷贝/μL,表明该方法极敏感,而退火温度优化显示该方法所适应的退火温度较宽,可在48~60℃特异地扩增BDV目的片段。
用该方法检测临床样品结果显示,BDV持续感染山羊的心脏、肝脏、脾脏、肺脏、肾脏、淋巴结、卵巢、脑等器官中均可检测到BDV存在,而BDV人工感染山羊仅能在血液和淋巴结中检测到病毒。以上结果说明BDV持续感染和一过性感染动物后病毒在体内的分布明显不同,持续感染动物在各个脏器甚至脑组织中均可检测到病毒,但一过性感染时,病毒只出现在血液和淋巴结。同时也可推测,2种感染方式中BDV排毒途径也会有差异。BDV持续感染可能与BVDV持续感染类似,可通过呼吸道、消化道、生殖道等各种途径向外排毒,而且由于持续感染动物病毒载量较大,可能向外界持续排出大量病毒,而BDV一过性感染则排毒时间较短而且病毒量较低。这也提示了BDV持续感染的危害,由于BDV感染后也可以造成动物机体免疫抑制,因此,采用特异的RT-PCR方法检测BDV,淘汰BDV感染动物,净化动物群,对养羊业的健康发展具有重要意义,同时由于BDV没有严格的宿主特异性,因此该RT-PCR方法也可用于其他动物感染BDV的检测与净化。
——一道江苏高考题的奥秘解读和拓展

