蚯蚓源贝莱斯芽孢杆菌的分离鉴定及安全性评价
郭艺伟,刘依山,吕 兰,包永占*,潘兴亮,王玉田,郑瑞峰
(1.河北农业大学 动物医学院,河北 保定 071000;2.北京市畜牧总站,北京 100107)
益生菌作为替抗物质的研究热点之一,被定义为“对饲养动物肠道菌群平衡有益的促进物或微生物,适当补充有利于宿主身体健康”[1]。国际益生菌与益生元科学协会强调了益生菌安全性评价的重要性,其有益作用必须有充足的证据,而益生作用与菌株特异性和剂量有关[2]。益生菌主要包括乳酸菌、芽孢杆菌和酵母菌等[3-4]。芽孢杆菌凭借其良好的抗逆性和热稳定性强等优势经常被应用于饲料中,其主要功能是提高饲料消化利用率、调节肠道微生态环境、提高机体免疫力和促进生产性能[5]。HOOGE等[6]研究发现在雏鸡饲粮中添加芽孢杆菌能提高其饲料转化率和生长性能。但是益生菌安全性问题不容忽视,有一些益生菌菌株可产生毒素和携带耐药基因,对公共卫生安全存在潜在的威胁。
贝莱斯芽孢杆菌作为一类新型生防细菌,有增殖快、抗逆性强、抗菌谱广、生物安全性高、在恶劣环境中产生孢子、能分泌丰富的酶类及产生抗菌活性很强的代谢产物等优势[7],能促进动物生长、调节肠道微生态平衡、抗菌、提高机体抵抗力。目前,贝莱斯芽孢杆菌在植物虫害方面取得了一定的成果,但是以动物模型探索其益生作用和安全性的研究鲜有报道,其同源菌株枯草芽孢杆菌在养殖业已经被广泛应用[8]。FEEDAP等[9]报道,贝莱斯芽孢杆菌符合添加剂授权条件。本试验从蚯蚓体内分离1株菌命名为Y1,对其进行菌种鉴定,探究Y1菌的理化特性,并用Y1的菌悬液饲喂小鼠,动物试验的周期为30 d,研究该菌对小鼠肠道菌群的影响,评价其安全性,为其作为饲料添加剂应用于畜禽养殖提供理论依据。
1 材料与方法
1.1 主要试剂VETEC琼脂粉购自美国赛默飞世尔科技(中国)有限公司;干酪素69006227购自国药集团化学试剂有限公司;细菌DNA提取试剂盒购自天根生化科技(北京)有限公司;16S rRNA通用引物购自生工生物工程(上海)股份有限公司;药敏试纸片购自美国赛默飞世尔科技(中国)有限公司;大肠杆菌(ATCC 25922)、金黄色葡萄球菌(ATCC 25923)由本实验室保存。
1.2 实验动物蚯蚓采自北京市奥林匹克公园;SPF 级昆明小鼠购自斯贝福(北京)生物技术有限公司。
1.3 菌株分离蚯蚓体表消毒后,切开蚓体分离肠道,蘸取肠道内容物在LB固体培养基上划线培养,挑取单菌落,纯化2~3次,进行革兰染色,观察镜检结果;进行生化鉴定、16S rRNA 基因的PCR扩增以及测序,序列结果在NCBI进行比对,并构建系统发育树。
1.4 溶血试验蘸取该菌菌悬液接种于绵羊血平板,观察有无溶血圈,金黄色葡萄球菌作为阳性对照。
1.5 药敏试验将Y1菌液均匀涂布于LB固体培养基上,合理放置药敏片(直径为6 mm),各做3个重复,测量抑菌圈,取平均值。
1.6 蛋白酶试验滤纸片法以酪蛋白为底物检测菌株是否产蛋白酶。制备2瓶试验粗酶液,将直径6 mm的灭菌滤纸圆片置于粗酶液中浸泡5 min,每瓶浸泡9个滤纸片,将滤纸片均匀置于酪蛋白培养基上培养24 h,观察滤纸片周围是否出现透明圈,记录水解圈直径,做3个重复。
1.7 抑菌试验具体方法参照牛津杯法[10],37℃培养12 h,观察并测量抑菌圈直径。
1.8 动物安全性试验参考GB15193.22-2014《28天经口毒性试验》进行研究。随机将预备饲养的KM小鼠分为3组,即空白对照组(K组)、培养基对照组(LB组)和试验组(Y组),空白对照组给予正常自来水,培养基对照组给予LB空白液体培养基,试验组给予浓度不低于1×108CFU/mL 的Y1菌液,每组10只小鼠,自由采食基础饲料。饲养环境保持卫生,温、湿度正常,饲养30 d,全程给予空白培养基和菌液。第29天晚上小鼠禁食,第30天处死解剖,然后观测以下指标:观察小鼠于试验前后的皮肤黏膜、被毛状态、食欲、精神状况及运动状态,并是否有小鼠死亡现象。结束后测体质量处死小鼠,进行解剖检查,计算心脏、肝脏、脾脏、肺脏、肾脏的脏器指数,脏器指数(%)=脏器质量(g)/小鼠体质量(g)×100%。
1.9 肠道微生物多样性分析每组随机抽取3只小鼠取肠道内容物进行高通量测序。对样本进行质量评估和拼接,得到高质量的序列,进行OTU分析和物种注释分析。根据已知OTU聚类,针对菌群的丰富度和均匀度进行Alpha和Beta多样性分析。
1.10 细菌移位试验取小鼠心脏、肝脏、脾脏、肺脏、肾脏组织各1 g研磨并稀释,无菌棒涂布于培养基上,37℃倒置培养,观察是否出现特征菌落。
1.11 数据处理使用SPSS 19.0软件对试验数据进行统计和差异显著性分析。利用Graph Pad Prism 5.0软件对肠道高通量测序结果进行制图。
2 结果
2.1 分离鉴定结果显示,Y1菌在 LB 培养基上呈黄色,圆形,表面湿润,在液体培养基上形成薄菌膜;镜检菌体为短杆状,可产生芽孢(图1)。梅里埃微生物鉴定仪分析结果见表 1,Y1菌为芽孢杆菌属。鉴定候选菌株的16S rRNA基因序列鉴定及系统发育树目的条带如图 2 所示,基因片段约为1 500 bp,将序列在NCBI核酸数据库进行比对发现Y1与贝莱斯芽孢杆菌(Bacillusvelezensis)的相似率达到99.93%,利用MEGA 7.0软件构建其系统进化树(图 3)。
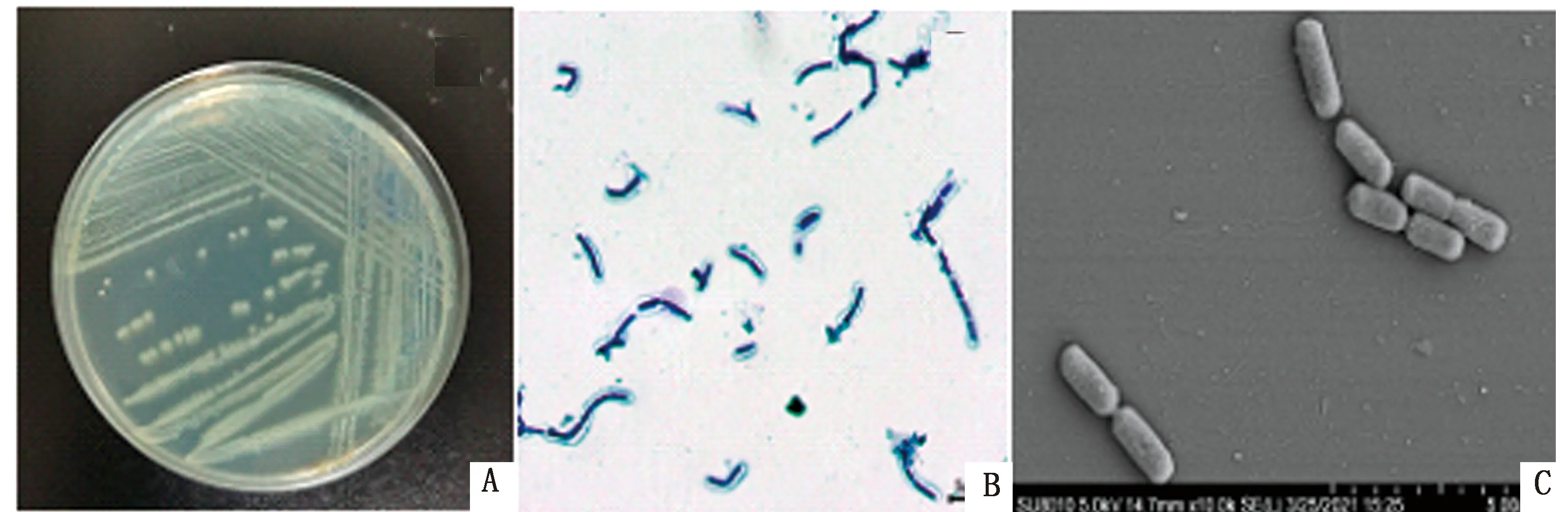
A.菌落形态特征;B.革兰染色镜检结果;C.电子显微镜镜检结果

表1 Y1菌生化鉴定结果
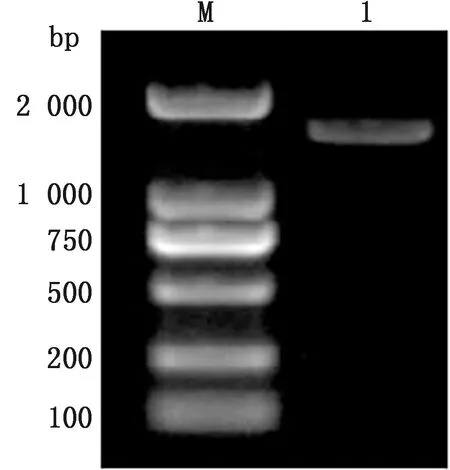
M.DL2000 DNA Marker;1.Y1的16S rRNA基因片段

图3 Y1菌16S rDNA序列系统发育树
2.2 溶血试验金黄色葡萄球菌在绵羊血平板上出现明显β-溶血环(图4A),Y1菌则无溶血圈(图4B),说明Y1菌无溶血作用。

A.金黄色葡萄球菌;B.贝莱斯芽孢杆菌Y1
2.3 药敏试验分析由表2可知,Y1对环丙沙星、头孢羟氨苄、氟苯尼考、替米考星、庆大霉素、红霉素、复方新诺明高度敏感,尤其对头孢羟氨苄抑菌直径可达到41 mm,对氨苄西林、羟氨苄青霉素及青霉素耐药。
表2 Y1菌药敏试验结果
2.4 蛋白酶试验将酪蛋白固体培养基是否存在透明圈作为贝莱斯芽孢杆菌能否产蛋白酶的依据。由表3可知,滤纸片周围都有透明圈,表明该菌可以产生蛋白酶。
表3 蛋白酶测定结果 mm
2.5 抑菌试验由表4可见,Y1菌株对大肠杆菌和金黄色葡萄球菌均有显著抑制效果,对大肠杆菌的抑菌圈直径达到(21.67 ±1.55)mm(P<0.05),对金黄色葡萄球菌可达(14.67 ±1.43)mm(P<0.05)。
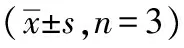
表4 抑菌试验结果 mm
2.6 动物安全性试验在菌浓度1×108CFU/mL饮水饲喂情况下,小鼠未出现死亡情况,体态、毛色并无显著性差异,仍健康活泼,KM小鼠未出现死亡现象以及病理毒性反应。30 d剖杀,小鼠的心脏、肝脏、脾脏、肺脏、肾脏等组织无肉眼可见病变;对各组小鼠的脏器指数进行分析,由表5可见,与对照组相比,试验组小鼠脏器指数无显著性差异(P>0.05)。
2.7 肠道微生物多样性分析
2.7.1宏基因组测序 使用Illumina Novaseq平台测序,7个样本获得387 858 bp原始碱基数,经质量评估和OTU聚类,试验组与对照组的序列统计见表6。

表6 样品测序统计结果

%

组别心脏肝脏 脾脏 肺脏肾脏K0.73±0.20a6.15±0.70a0.47±0.07a0.69±0.03a1.57±0.37aLB0.53±0.06ab5.25±0.67b0.45±0.16a0.68±0.09a1.53±0.28aY0.63±0.09b6.26±0.16a0.40±0.08a0.63±0.13a1.63±0.30a
2.7.2物种分析 为分析样本内菌群多样性,对各组样品进行微生物多样性分析获得Alpha多样性指数(表7)。Chao1指数和ACE指数是度量物种丰富度的参数,Simpson指数是用来估算微生物多样性的参数之一。试验组Y组的Chao1指数、ACE指数、Simpson指数、Shannon 指数均高于对照组LB、K组。经过分析,在门水平上(图5A),与对照组相比,试验组优势菌群拟杆菌门(Bacteroidetes,48.07%,53.73%,37.67%)和厚壁菌门(Firmicutes,22.40%,24.69%,17.04%)显著升高(P<0.05)占主导地位;变形菌门(Proteobacteria,4.94%,7.08%,11.64%)次之,疣微菌门(Verrucomicrobia,4.85%,14.17%,0.93%)放线菌门(Actinobacteria,1.13%,0.13%,0.38%)、脱铁杆菌门(Deferribacteres,0.07%,3.25%,1.17%)占比最小,且变形菌门的丰度显著降低。在属水平上(图5B),试验组小鼠肠道中的特异性菌群显著增多(P<0.05),包括:木薯科未分类的属(uncultured bacterium fMuribaculaceae,40.25%,46.45%,21.77%)、阿克曼菌属(Akkermansia,32.66%,40.37%,14.17%),此外还有未分类的毛螺菌科(unculturedLachnospiraceae)、乳杆菌(Lactobacillus)、普雷沃菌(PrevotellaceaeUCG-001);螺杆菌属(Helicobacter)丰度降低。
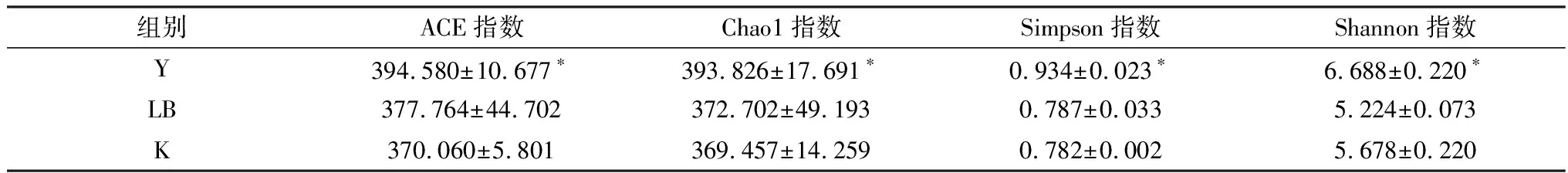
表7 Alpha多样性指数
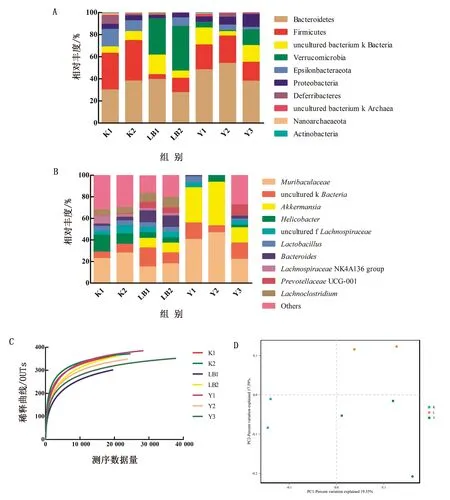
A.门水平相对丰度;B.属水平相对丰度;C.稀释曲线;D.PCoA分析
2.7.3稀释性曲线 由图5C可知,与对照组K、LB相比,稀释曲线较长趋于平缓,微生物多样性丰富度较大。
2.7.4PCoA分析 基于Beta多样性分析得到的4种距离矩阵,数据采用非加权法方式处理,使用R语言工具分别绘制的PCoA分析结果如图5D:坐标图上距离越近的样品,相似性越大,试验组与对照组组内距离相对靠近,各组菌种相似度均较高,组间距离差距较远,组间相似性不高。
2.8 细菌移位试验观察内脏组织研磨涂板的培养基,未长出特征的Y1菌落,说明饲喂菌液没有细菌移位情况。
3 讨论
菌株的安全性是益生菌关注的焦点,是菌株能否作为益生菌应用于饲料添加的关键因素。细菌溶血素是细菌的重要毒力因子[11],菌株是否有溶血性是筛选益生菌的先决条件,Y1菌在绵羊血平板上未长出溶血环,即不溶血,为γ-溶血,而对照组金黄色葡萄球菌周围长出明显的β-溶血环,说明Y1菌无溶血作用,小鼠未出现中毒或死亡现象,且小鼠的采食、活动、排泄均无异常,说明Y1菌可以进入机体;Y1菌还可以产生蛋白酶类,加速饲料的分解,将饲料中大分子蛋白质分解为易于吸收的小分子,促进营养物质的吸收,提高饲料利用率。
抗生素是造成细菌耐药性的主要原因之一,尤其是抗生素联合使用时更加速促进耐药菌株产生,一旦细菌形成耐药菌株,通过耐药性转移产生更多的耐药性细菌,极有可能导致该群落整个致病菌群体对抗生素产生耐药基因。有研究报道,40%的菌株有4种及以上抗生素耐药性,比如常见的大肠杆菌、沙门菌病过去比较容易控制,现在却成为养殖业主要防治的传染病。益生菌是一种优质饲料添加剂,益生菌与抗生素若要联合使用必须考虑两者有无拮抗作用。本试验结果表明,贝莱斯芽孢杆菌Y1对环丙沙星、头孢羟氨苄、氟苯尼考、替米考星、庆大霉素、红霉素、复方新诺明高度敏感,对阿莫西林、青霉素G、氨苄西林不敏感,此结果同张小波等[12]分离的鸭源贝莱斯芽孢杆菌GZZY2019药敏结果一致;唐萍等[13]从石斛中分离的贝莱斯芽孢杆菌DJB5同样对环丙沙星、庆大霉素、复方新诺明等高度敏感。许光胜[14]研究表明地衣芽孢杆菌对多种抗生素敏感可避免动物体内微生物之间抗生素抗性的转移;在实际应用中低耐药益生菌能够避免动物机体内微生物之间抗生素抗性转移,减少部分微生物耐药性的产生;使用益生菌时,不应与其敏感的抗生素一起使用,这是保证益生菌起作用的关键,贝莱斯芽孢杆菌Y1是否携带对β-内酰胺类抗生素的耐受基因有待进一步研究。
动物体内存在多种微生物,这些微生物与宿主的消化、免疫及生理调控息息相关,帮助机体完成各种生理功能。本试验Y1菌株对大肠杆菌和金黄色葡萄球菌均有显著抑制效果,此结果与刘韶娜等[15]报道的贝莱斯芽孢杆菌B13对大肠杆菌和金黄色葡萄球菌有抑制作用的结果一致,B13不仅能抑制这2种菌,还对鼠伤寒沙门菌有抑制效果;徐淑琴等[16]从藏羚羊体内分离的贝莱斯芽孢杆菌对大肠杆菌、金黄色葡萄球菌及产气荚膜梭菌有较强的抑制能力;有研究表明芽孢杆菌可以通过自身分泌的活性物质和代谢产物调节肠道微生态平衡[17]。
Alpha指数与Beta指数多样性分析表明,试验Y组小鼠肠道微生物群落的丰度较高,菌群多样性较高,门水平反应试验组提高了肠道优势菌群如拟杆菌门、厚壁菌门的丰度;拟杆菌门参与机体肠道重要的代谢活动,包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化[18],能有效地分解代谢多糖,提高宿主的免疫力,加快肠道黏膜的形成,促进肠道发育,还能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。Y1菌能提高拟杆菌门菌的丰度,改善肠道健康,进而促进小鼠消化及营养物质吸收;厚壁菌门可以水解碳水化合物和蛋白质,该门菌种的增多也促进了小鼠对饲料的消化吸收。此结果同孙长超等[19]研究结果一致,短期灌胃贝莱斯芽孢杆菌M2提高大鼠肠道拟杆菌门和厚壁菌门的丰度,调节肠道菌群。变形菌门的丰度显著降低,该门包括很多病原菌,如大肠杆菌、幽门螺旋菌、沙门菌等条件致病菌,潜在降低了条件致病菌引起腹泻病的发病率。MANEEWAN等[20]研究发现枯草芽孢杆菌可以减少仔猪粪便中大肠杆菌和沙门菌的数量。从属水平来看,特异性肠道群落Muribaculaceae、阿克曼菌属(Akkermansia,Akk)显著提高,螺杆菌属显著降低。螺杆菌属是常引起机体胃肠道炎症的需氧菌,阿克曼菌属是定植于肠道黏液层中可特异性降解黏蛋白的革兰阴性厌氧菌[21]。Akk菌膜上的一种耐高温的细菌蛋白,可以促进肠道的屏障功能,并且Akk对肠道上皮细胞良好的黏附作用以及自聚集能力[22],有利于在肠道菌群中形成优势占位,贝莱斯芽孢杆菌Y1在肠道内增殖耗氧,为Akk提供厌氧环境从而促进它的增殖,加强肠道屏障功能,降低需氧致病菌丰度,维持肠道健康。枯草芽孢杆菌C-3102能消耗肠道内氧,促进有益菌在肠道黏膜定植,进而抑制有害菌增殖[23];刘韶娜等[24]研究表明,贝莱斯芽孢杆菌B13能提高猪肠道内乳杆菌属等益生菌的相对丰度,显著降低链球菌属等条件致病菌的相对丰度。稀释曲线是用来评价测序量是否覆盖所有类群,并间接反映样品中的丰富程度。当曲线趋于平坦,说明测序量达到基本覆盖所有物种,测序数据合理;反之,反映样品中检测到的物种较多,生物多样性较高。本试验结果显示Y组稀释曲线较长,微生物多样性丰度较高;PCoA分析结果显示试验组与对照组组内距离相对靠近,说明各组菌种相似度均较高,而组间距离差距较远,说明对照组与试验组小鼠的肠道菌群相似性较低,说明试验组通过饲喂菌液改变了小鼠的肠道菌群。
本试验表明小鼠饲喂贝莱斯芽孢杆菌Y1菌液具有一定的安全性,可以抑制条件致病菌,提高部分优势菌群的丰度,降低条件致病菌的丰度,平衡微生态环境,改善肠道健康,有被作为益生菌应用于畜禽生产从而促进无抗养殖发展的潜质。

