番鸭小鹅瘟病毒感染诱导细胞自噬
王 劭,肖世峰,程晓霞,江丹丹,林锋强,朱小丽,陈少莺,陈仕龙*
(1.福建省农业科学院 畜牧兽医研究所,福建 福州 350013;2.福建省畜禽疫病防治工程技术研究中心,福建 福州 350013)
小鹅瘟是由鹅细小病毒(goose parvovirus,GPV)引起的雏鹅和雏番鸭的一种传播快、病死率高的高度接触性传染病,该病最早于1956年在我国江苏等养鹅地区发生,并很快蔓延到全国各养鹅地区,但极少见到番鸭发病[1]。自1997年以来该病在福建莆田、福清等地的番鸭养殖区暴发流行,发病幼番鸭以腹泻、肠黏膜脱落形成栓塞为主要特征,发病率为50%~70%,病死率为40%~65%,给番鸭养殖业造成较大的经济损失[2]。有报道从临床剖检为小肠纤维素性栓塞的患病幼番鸭肝脾匀浆中分离到包括PT株在内的地方流行番鸭小鹅瘟病毒(Muscovy duck origin goose parvovirus,MDGPV),并证实国内流行的番鸭小鹅瘟病原为番鸭源鹅细小重组病毒[3-4]。
细胞自噬是一种在真核细胞中高度受调控的、溶酶体依赖性的重要细胞代谢调控过程,通过降解非功能性蛋白聚集体和衰老或损伤的细胞器,重新合成大分子物质或产生三磷酸腺苷[5],通过细胞自噬不仅可以为细胞提供养分来应对营养缺乏、低氧和炎症等应激状态,也可以消除潜在的感染因子而使细胞得以继续生存,但自噬的过度激活或自噬功能的障碍也参与了一些疾病的致病过程[6-7],因此细胞自噬在维持生物体的细胞动态平衡、发育、衰老、退化及免疫防御等方面都扮演着重要的角色[8]。自噬不仅是固有免疫系统的重要组分,而且也可以通过内源性抗原提呈调节适应性免疫应答,协调宿主抵抗或清除包括病毒在内的不同病原微生物[9]。随着自噬相关信号转导通路分子机制的深入研究,自噬被认为是免疫系统中一个完整的部分,既可以感知病毒感染,又具有抗病毒效应[10]。因此,自噬与病毒之间相互调控作用机制的阐释,对于深入研究病毒感染的侵入机制以及发展预防和治疗病毒感染的新方法都具有非常重要的作用。
自噬代表了一种重要的细胞内在防御机制,可以抵御包括病毒在内的细胞内病原体的入侵,可以通过特异性识别被泛素修饰的病毒成分,将其运送到溶酶体选择性降解与病毒颗粒相关的免疫抗原,还可以促进病毒成分与专门激活先天免疫途径的受体之间相互作用,或促进抗病毒适应性免疫的激活[11]。为了应对这种压力,病毒进化出各种复杂的策略来避免抗病毒自噬反应或操纵自噬机制以促进自身复制。ZHANG等[12]研究表明,猪细小病毒(porcine parvovirus,PPV)感染猪睾丸细胞(swine testis cells,ST)后不仅可以诱导细胞自噬,还能借助细胞过程促进PPV的复制。ZHANG等[13]的研究进一步表明PPV感染猪胎盘滋养层细胞(porcine placenta trophoblast cells,PTC)早期,雷帕霉素(Rapamycin,RAPA)诱导的完全自噬通量或RAPA+巴佛洛霉素A1(bafilomycin A1,Baf A1)共同诱导的不完全自噬促进了PPV的复制,而3-甲基腺嘌呤(3-Methyladenine,3-MA)、自噬相关蛋白5(autophagy related protein 5,ATG5)基因敲除可以抑制自噬体的形成并降低了PPV在PTC中的复制水平。人细小病毒 B19(human parvovirus B19,B19)感染UT7/Epo-S1细胞中Ⅱ型微管相关蛋白1轻链3(microtubule-associated protein1 light chain 3,LC3),即LC3-Ⅱ蛋白表达量在感染细胞中显著增加,表明B19 感染可诱导细胞内自噬体的增加。此外,3-MA 对自噬的抑制作用显著促进 B19 感染介导的细胞死亡,这些结果揭示了 B19 感染的细胞可通过自噬稳定细胞内环境,维持细胞存活的新机制[14]。鳞翅目浓核病毒(lepidopteran ambidensovirus)非结构蛋白的表达导致雷帕霉素靶蛋白(mammalian target of Rapamycin,mTOR)通路失活,抑制负调控自噬的mTORC1信号通路,从而激活昆虫细胞自噬并控制细胞信号传导机制,有利于病毒mRNAs的翻译,从而促进病毒蛋白的高水平表达[15]。
目前尚未见MDGPV复制与细胞自噬之间关系的报道,本试验利用MDGPV分别感染番鸭胚成纤维细胞(primary Muscovy duck embryo fibroblasts,MDEFs)与鸭胚胎肝间充质干细胞(duck embryo liver mesenchymal stem cells,DuLMSCs),通过检测自噬信号通路中相关蛋白的表达情况,明确细胞自噬与MDGPV复制之间的关系,以期进一步明晰MDGPV分子致病机理及其与宿主细胞间的关系具有重要意义。
1 材料与方法
1.1 病毒和细胞MDGPV-PT株细胞适应毒由本实验室保存;MDEFs按常规方法制备;DuLMSCs为本实验室保存。
1.2 主要试剂DMEM培养基、胎牛血清购自赛默飞世尔科技(中国)有限公司;Anti-LC3B antibody(L7543)、Anti-phospho TFEB(Ser142)(ABE1971-I)购自Sigma-Aldrich公司;Anti-TFEB rabbit polyclonal antibody(D123310)购自生工生物工程(上海)股份有限公司;Anti-phospho-mTOR(Ser2448)antibody(BM4840)、Anti-mTOR antibody(BM4182)、Anti-β-actin antibody(BM0627)、HRP Conjugated AffiniPure Goat Anti-mouse IgG(H+L)(BA1051)、HRP Conjugated AffiniPure Goat Anti-rabbit IgG(H+L)(BA1055)、FITC Conjugated AffiniPure Goat Anti-rabbit IgG(H+L)(BA1105)购自博士德生物工程有限公司;RAPA(HY-10219)、氯喹(Chloroquine,CQ)(HY-17589A)、3-MA(HY-19312)购自MedChem Express公司。
1.3 激光共聚焦显微镜观察将MDEFs(DuLMSCs)细胞接种于预先放入了盖玻片的6孔细胞培养板中,待细胞长到覆盖率为80%左右时,利用感染复数(MOI)为1的MDGPV-PT感染细胞24 h(并设阴性对照组细胞),预冷PBS洗涤3次、每次5 min,弃上清;4% 多聚甲醛固定细胞爬片10 min,预冷PBS洗涤3次、每次5 min,弃上清;2% Triton X-100通透细胞10 min,PBS洗涤3次、每次5 min,弃上清;5% BSA封闭2 h,预冷PBS洗涤3次、每次5 min,弃上清;加入兔抗 LC3-Ⅱ抗体(1∶500)4℃孵育过夜,预冷PBS洗涤3次、每次 5min;加入羊抗兔 IgG-FITC(1∶100)37℃ 孵育1 h 后,预冷PBS洗涤3次、每次 5 min;最后用 DAPI 染色并封片,室温孵育5 min,预冷PBS洗涤3次、每次5 min;置于激光共聚焦荧光显微镜下观察拍照。
1.4 病毒感染与药物分组处理将处于对数生长期的MDEFs(DuLMSCs)细胞接种于6孔板,培养至细胞汇合度为80%,共9组细胞,分别命名为:MDGPV-PT感染组、MDGPV-PT灭活组、正常细胞对照组、RAPA组、3-MA组、CQ组、RAPA+PT组、3-MA+PT组、CQ+PT组。MDGPV-PT感染组使用1MOI MDGPV-PT株吸附单层细胞2 h,再用无菌PBS洗去未黏附病毒,加入含2%血清的细胞维持液;MDGPV-PT灭活组用甲醛灭活的PT病毒株吸附2 h;正常细胞对照组不做处理。RAPA组、3-MA组和CQ组分别使用100 nmol/L,5 mmol/L,50 μmol/L预处理30 min;RAPA+PT组、3-MA+PT组、CQ+PT组分别先使用100 nmol/L RAPA、5 mmol/L 3-MA、50 μmol/L CQ预处理30 min,再用1 MOI PT病毒株吸附2 h。药物处理组细胞均换成含有上述等同浓度药物的新鲜细胞维持培养液继续培养。以上9组细胞均置于37℃、5% CO2细胞培养箱中继续培养6,12,18,24,30,36 h。
1.5 Western blot检测自噬相关因子蛋白的表达分别收集感染组与药物处理组不同时间点MDEFs(DuLMSCs)细胞,用预冷PBS洗涤细胞2次,并加入裂解液,冰浴裂解30 min。13 000×g离心10 min后取上清,加入SDS-PAGE 上样缓冲液,煮沸 10 min后,12 000×g离心10 min。将处理好的样品进行 SDS-PAGE 电泳,用半干法(15 V,20 min)将蛋白转移至NC膜,用 50 g/L 脱脂牛奶室温封闭 1 h;一抗4℃ 孵育过夜,然后 TBST 洗膜 3 次、每次 5 min;室温孵育对应的抗兔或抗小鼠的IgG-HRP二抗 1 h,TBST 洗膜 3 次、每次 5 min;加 ECL 发光液,自显影仪曝光照相。
2 结果
2.1 MDGPV感染细胞后诱导细胞内自噬体的形成在自噬过程中,细胞溶质形式的LC3(LC3-Ⅰ)与磷脂酰乙醇胺(PE)结合形成LC3-PE结合物(LC3-Ⅱ),随即被招募到自噬体膜上。LC3-Ⅱ作为自噬体标记物,广泛用于监测自噬。本研究利用激光共聚焦显微镜观察LC3标记自噬荧光颗粒的形成,结果发现病毒感染MDEFs(DuLMSCs)细胞24 h 后,与正常对照组细胞相比,自噬荧光蛋白聚集点明显增加(图1,2)。结果表明,MDGPV-PT细胞适应毒感染MDEFs和DuLMSCs细胞后能够诱导细胞自噬。

A~C.MDGPV感染的MDEFs细胞;D~F.正常对照组MDEFs细胞
2.2 MDGPV-PT细胞适应毒感染、自噬激活剂和抑制剂对MDEFs细胞的影响Western blot检测MDGPV-PT感染、自噬激活剂和抑制剂处理的MDEFs细胞自噬标志蛋白LC3-Ⅱ水平变化,结果如图3所示:MDGPV-PT感染组、RAPA组和RAPA+PT组中LC3-Ⅱ表达量均呈现先增加后逐步减少的趋势,且LC3-Ⅱ表达量分别在处理24,30,18 h后达到最大,表明RAPA处理与PT感染均可诱导MDEFs细胞自噬,其中RAPA+PT组中LC3-Ⅱ表达量最大值时间提前,表明RAPA做为一种mTOR变构抑制剂,可直接抑制mTOR的活性,可以促进MDGPV-PT诱导的MDEFs细胞自噬[16];CQ和CQ+PT组LC3-Ⅱ的表达量发生了累积,表明CQ通过阻止自噬体与溶酶体的融合,作用于MDEFs细胞自噬的后期阶段,从而阻断了完整自噬流的产生[17];3-MA与3-MA+PT组中LC3-Ⅱ表达量明显减少,表明3-MA能特异性抑制Ⅲ型磷酸肌醇3磷酸激酶(Class Ⅲ PI3K),进而抑制自噬体的形成,可以阻断MDGPV-PT诱导的MDEFs细胞自噬[18-19]。正常对照细胞组与PT灭活组一样,均未见LC3-Ⅱ蛋白明显表达,表明这两组细胞自噬活性比较低或自噬相关信号转导通路未激活。为了揭示MDGPV复制是否是诱导自噬所必需的,使用甲醛灭活的MDGPV感染MDEFs细胞,与正常细胞对照组一样,甲醛灭活的MDGPV感染的MDEFs细胞中的LC3蛋白没有从LC3-Ⅰ转化为LC3-Ⅱ,结果表明MDGPV诱导细胞自噬需要病毒的有效复制。

A~C.MDGPV感染的DuLMSCs细胞;D~F.正常对照组DuLMSCs细胞
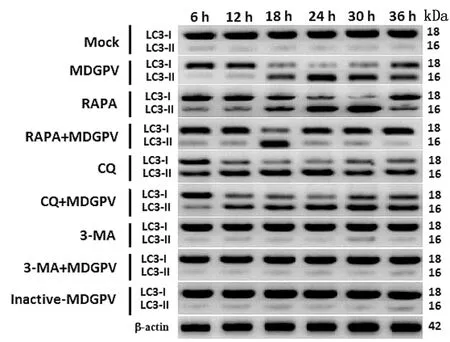
图3 不同处理组MDEFs细胞LC3-Ⅱ表达的Western blot检测结果
2.3 MDGPV-PT细胞适应毒感染对MDEFs细胞p-mTOR水平的影响为进一步确定MDGPV引发MDEFs细胞自噬的途径,对感染细胞内磷酸化mTOR(p-mTOR)以及总mTOR水平进行Western blot分析,结果如图4所示:正常细胞对照组p-mTOR 和mTOR的表达量变化幅度很小;PT组p-mTOR蛋白表达量逐渐下降,而mTOR表达量基本不变,因此自噬调控信号通路蛋白p-mTOR表达量在各时间点的动态变化表明MDGPV-PT可以诱导MDEF细胞自噬。

图4 不同处理组MDEFs细胞p-mTOR表达的Western blot检测结果
2.4 MDGPV-PT细胞适应毒感染对MDEFs细胞p-TFEB水平的影响为了进一步确定MDGPV引发MDEFs细胞自噬是否与mTOR/TFEB信号通路有关,对感染细胞内TFEB(TFEB)以及磷酸化TFEB(p-TFEB)水平进行Western blot分析,结果如图5所示:正常细胞对照组TFEB以及p-TFEB的表达量变化幅度很小;PT组细胞质中p-TFEB表达量逐渐下降,而细胞中TFEB总蛋白表达量基本不变。结果表明,MDGPV-PT感染可以通过mTOR/TFEB信号途径,降低TFEB磷酸化水平,促进MDGPV感染MDEFs细胞中溶酶体生物合成以及自噬相关基因的表达。

图5 不同处理组MDEFs细胞p-TFEB表达的Western blot检测结果
2.5 MDGPV-PT细胞适应毒感染、自噬激活剂和抑制剂对DuLMSCs细胞的影响应用Western blot检测MDGPV-PT感染、自噬激活剂和抑制剂处理DuLMSCs细胞后6,12,18,24,30,36 h监测LC3-Ⅰ向LC3-Ⅱ的转化,结果如图6所示:在β-actin表达量一致的基础上,可以发现,与正常对照细胞组与PT灭活组相比,MDGPV-PT感染组、RAPA组和RAPA+PT组,LC3-Ⅰ向LC3-Ⅱ的转化均呈现先增加后逐步减少的趋势,且LC3-Ⅱ表达量分别在处理24,30,18 h后达到最大,其中RAPA+PT组24 h时DuLMSCs细胞中LC3-Ⅱ表达量的明显升高表明RAPA可以促进病毒诱导的自噬发生;CQ和CQ+PT组LC3-Ⅱ的表达量发生了累积,表明CQ作为经典的自噬抑制剂,通过改变溶酶体的酸性环境阻断自噬体与溶酶体的结合,使得大量的待降解蛋白在细胞中堆积,从而阻断了药物处理与病毒感染DuLMSCs细胞中完整自噬流的产生;3-MA与3-MA+PT组中LC3-Ⅱ表达不明显,表明3-MA可以作用于自噬诱导阶段,通过靶向VPS34激酶在自噬体形成的早期阶段,干扰或抑制MDGPV-PT诱导的DuLMSCs细胞自噬[20-21]。正常对照细胞组与PT灭活组一样,均未见LC3-Ⅱ蛋白明显表达,表明这两组细胞中尚无激活的自噬流产生。为了解灭活的MDGPV是否能够诱导细胞自噬的发生,使用甲醛灭活的MDGPV感染MDEFs细胞,与正常的MDGPV感染组相比,甲醛灭活MDGPV感染MDEFs细胞后,Western blot未检测到活病毒诱导的明显LC3-Ⅰ向LC3-Ⅱ转化的现象,却类似于正常细胞对照组的检测结果,表明甲醛灭活的MDGPV感染细胞后不能诱导有效的自噬应答。
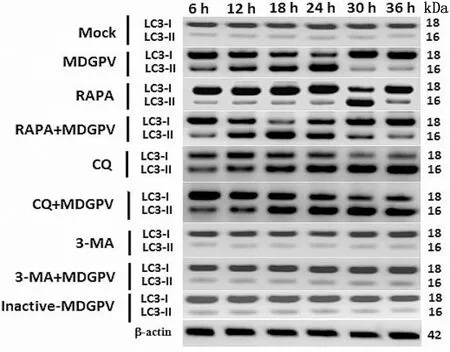
图6 不同处理组DuLMSCs细胞LC3-Ⅱ表达的Western blot检测
2.6 MDGPV-PT细胞适应毒感染对DuLMSCs细胞p-mTOR水平的影响对感染DuLMSCs细胞内磷酸化mTOR(p-mTOR)以及总mTOR水平进行Western blot分析,在内参基因β-actin恒定表达的基础上,结果显示,正常细胞对照组p-mTOR和mTOR以及PT组mTOR蛋白表达无明显差异,而在PT感染DuLMSCs细胞后p-mTOR表达量逐步减少,其变化趋势与MDEFs细胞病毒感染组基本一致,表明MDGPV-PT感染可以诱导DuLMSCs细胞发生自噬(图7)。

图7 不同处理组DuLMSCs细胞p-mTOR表达的Western blot检测结果
2.7 MDGPV-PT细胞适应毒感染对DuLMSCs细胞p-TFEB水平的影响为了解MDGPV感染引发的DuLMSCs细胞自噬与mTORC1下游调控因子TFEB表达是否具有相关性,对感染DuLMSCs细胞内p-TFEB以及总TFEB水平进行Western blot分析,结果显示,正常细胞对照组p-TFEB和TFEB以及PT感染组TFEB蛋白表达无明显差异,而在PT感染DuLMSCs细胞后p-TFEB表达量逐步减少,表明MDGPV-PT感染可以通过 mTOR信号通路使TFEB去磷酸化,提高MDGPV感染DuLMSCs细胞的溶酶体自噬水平(图8)。

图8 不同处理组DuLMSCs细胞p-TFEB表达的Western blot检测结果
3 讨论
LC3蛋白是自噬体的重要组成部分,属于微管相关蛋白家族(microtubule associated protein,MAP)成员,包括2种可相互转化的形式即LC3-Ⅰ和LC3-Ⅱ,参与了自噬体膜的形成。自噬开始后细胞质中LC3的C端被自噬相关蛋白(autophagy-related protein,Atg)Atg4蛋白酶酶切后生成胞浆可溶型LC3-Ⅰ,而LC3-Ⅰ被Atg7活化并与细胞器膜中的PE以泛素样反应的方式共轭形成脂质化膜结合型LC3-Ⅱ[22]。因此,LC3蛋白在细胞自噬发生过程中被选择性地招募到自噬小泡中,这可以被认为是自噬降解途径中,从弥漫性胞质定位到特征性点状自噬小体双层膜定位模式的再分配。LC3-Ⅱ是自噬体膜(autophagic membrance)延伸和闭合所必需的,在吞噬小体的内膜和外膜上都有分布,已成为研究自噬水平高低的标志性蛋白[23]。本试验MDGPV-PT细胞适应毒感染MDEFs和DuLMSCs细胞后,LC3-Ⅱ表达量均呈现出先增加后减少的趋势,在MDEFs细胞组中的表达水平更高,说明MDGPV-PT感染可以诱发MDEFs 和DuLMSCs细胞的自噬活性,并且细胞自噬效应随着病毒感染时间的不同而产生变化。本研究中,正常对照细胞MDEFs 和DuLMSCs对照组中LC3-Ⅱ表达量很低,表明试验选取的细胞在通常情况下保持着极低的自噬水平,细胞内环境稳态性好。
mTOR是一种进化上相对保守的丝氨酸/苏氨酸蛋白激酶,作为自噬启动阶段的关键调节因子,可受生长因子、营养物质、能量状态与氧化应激等多种因素的影响,可抑制细胞自噬的发生,是自噬的负调控分子[24]。mTOR包含mTORC1和mTORC2两种复合物,其中mTORC1是自噬过程的主要调节因子,在营养和能量充足的条件下,处于活化状态的mTORC1通过磷酸化ATG13,阻止其与Atg1、Atg17、Atg101形成unc-51样激酶1(unc-51-like kinase 1,ULK1)复合物,进而阻断细胞质膜上ULK1复合物参与自噬小体的形成,同时促进核糖体和内质网黏附,阻碍内质网脱落形成自噬体膜,从而抑制自噬。当细胞处于营养和能量不足等应激状况下时,mTORC1磷酸化程度降低,对ULK1与Atg13的磷酸化抑制作用减弱,促使ULK1自磷酸化并磷酸化Atg1、Atg13、Atg101和其他Atg蛋白。激活的ULK1 复合物随后转移到内质网的隔离膜上,启动膜泡成核反应并介导自噬体的形成[25]。因此,mTOR 磷酸化(p-mTOR)激活程度也是研究自噬的一个重要观察指标[26]。本研究Western blot检测结果表明,MDGPV-PT细胞适应毒感染的细胞中mTOR信号通路调控正常,p-mTOR蛋白表达水平出现逐渐减少的趋势,说明MDGPV-PT感染MDEFs 和DuLMSCs诱发细胞自噬时,细胞内mTOR磷酸化水平被抑制。相比之下,MDEFs 和DuLMSCs正常对照细胞中的mTOR及其磷酸化水平均保持相对稳定,说明阴性对照细胞自噬水平极低。
转录因子EB(transcription factor EB,TFEB)是碱性螺旋-环-螺旋-亮氨酸拉链bHLH-LZ(basic-helix-loop-helix leucine zipper)类转录因子中MiTF/TFE(microphthalmia-transcription factor E)家族的成员之一,能够通过识别回文E盒基序(GTCACGTGAC),活化下游基因并促其转录,参与多种细胞调控,其被确定为调节溶酶体功能及自噬的关键因子,在调节协同溶酶体表达和调控(coordinated lysosomal expression and regulation,CLEAR)网络中发挥关键作用,TFEB的活化可以增加溶酶体相关蛋白的合成,加快自噬过程,正向调节自噬体形成[27]。有研究表明,TFEB丝氨酸(Serine,Ser)位点磷酸化是mTORC1靶蛋白感应与通路调控的一个组成部分,TFEB 的Ser142位点磷酸化则抑制 TFEB 活化,可以下调细胞自噬水平,而去磷酸化的TFEB 可以进入细胞核与核内CLEAR序列结合,促进下游溶酶体相关基因的表达,增强溶酶体的生物合成及生理功能,细胞自噬水平也随着TFEB表达的增加而提高[28]。因此,TFEB是细胞自噬的重要调控因子。本研究应用Western blot检测MDGPV-PT细胞适应毒感染细胞和正常对照细胞中TFEB与p-TFEB的表达情况,病毒感染MDEFs和DuLMSCs细胞后,p-TFEB表达水平呈下降趋势,参与溶酶体自噬生物发生。相比之下,MDEFs 和DuLMSCs正常对照细胞中的TFEB及其磷酸化水平均保持相对稳定,说明阴性对照细胞自噬水平低,胞质内环境稳态生理正常。
本研究还发现经甲醛灭活的MDGPV-PT感染的MDEFs 和DuLMSCs细胞中LC3蛋白没有从LC3-Ⅰ转化为LC3-Ⅱ,说明MDGPV-PT感染细胞能够诱导自噬,并且这种诱导需要病毒的复制,细胞自噬在MDGPV的生活周期中可能发挥着重要的功能。MDGPV如何诱导自噬体以及利用自噬体的形成来实现病毒复制增殖的机理,还有待于进一步的深入研究。综上所述,本研究首次证实MDGPV-PT细胞适应毒感染MDEFs 和DuLMSCs细胞能够诱导细胞自噬,且与细胞内mTOR信号通路中p-mTOR与p-TFEB水平降低有关。

