沼泽型水牛FST基因克隆分析与组织表达模式
汪浩鑫,陈维丽,张 俊,许建春,自永宏,杨小芬,石德顺*,陆凤花*
(1.广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁530005;2.西北农林科技大学 农业部动物生物技术重点实验室,陕西 杨凌712100)
哺乳动物卵母细胞体外成熟(invitromaturation,IVM)是产生能支持着床前胚胎发育及全面发育至完整个体的卵母细胞的一项重要生殖技术,是克隆和生产转基因动物的关键技术之一[1]。在家畜上,通过获取动物卵巢中未成熟的卵母细胞进行IVM来生产胚胎是常用的方法。但相对于体内自然成熟排出的卵母细胞,IVM生产的卵母细胞仍存在许多问题,故而发掘与卵母细胞成熟有关基因是本研究的核心内容,卵泡抑素(follistatin,FST)属于转化生长因子β(transforming growth factor-β,TGF-β)超家族中的一员,是一种富含半胱氨酸的糖基化单链多肽。1987年,UENO等[2]和ROBERTSON等[3]分别从猪和牛的卵泡液中获取了FST。有研究发现,FST对促卵泡素(follicle-stimulating hormone,FSH)的功能有抑制作用,但随着对FST的深入研究,其在生殖中的生物学功能也被逐渐发现。FST可以提高恒河猴[4]、牛[5]和猪的早期胚胎体外发育效率和囊胚形成率,FST可以通过旁分泌的方式作用于卵巢,调节颗粒细胞的增殖与凋亡[6]。敲除小鼠卵丘细胞中的FST,可导致小鼠新生儿死亡[7]。PATEL等[8]研究发现,高质量卵母细胞中FST基因表达量远高于低质量卵母细胞中FST基因表达量。这预示了FST可能通过多种方式调控卵母细胞的成熟发育,然而,有关FST在卵母细胞成熟方面的作用报道较少。FST对早期胚胎发育的促进作用已经得到一致的研究结果,但FST对卵母细胞成熟的影响目前还存在较大争议,不同物种中的研究结果不尽相同,但FST作为TGF-β超家族中重要的一员,在卵泡的生长发育中起到关键作用,为了明确FST在卵母细胞成熟中的作用及机制,本研究通过克隆水牛FST基因,并运用生物信息学方法分析该基因序列,探讨其组织表达规律,为进一步研究FST在水牛胚胎发育中的功能奠定了基础,为完善水牛卵母细胞体外成熟体系提供理论支撑。
1 材料与方法
1.1 样品采集从南宁市屠宰场获取10~20 cm的水牛胎儿,用含37℃生理盐水的保温瓶送至实验室,采集胎牛胃、肌肉、卵巢、睾丸、心脏、肝脏、肺脏和脾脏组织,将各脏器组织剪成小块分类保存于液氮中。
1.2 主要试剂逆转录试剂(南京诺微赞公司);RT-qPCR试剂(南京诺微赞公司);普通琼脂糖(BIOWEST AGAROSE);LB营养琼脂(北京奥博星公司);Q5 High-Fidelity 2×Master Mix(New England Biolabs公司);RNA保护剂(北京奥博星公司);胶回收试剂盒(OMEGA公司)。
1.3 引物设计与合成在NCBI上查找水牛FST mRNA序列(NM_001290906.1),利用Oligo7设计克隆FST的PCR引物,利用Primer 7.0设计qRT-PCR引物,内参基因为UXT,引物序列如表1所示,由生工生物工程(上海)股份有限公司合成。

表1 FST和UXT基因引物
1.4 RNA提取和cDNA第一链的合成采用TRIzol法提取水牛胎儿不同组织的RNA,筛选质量合格的RNA用于cDNA合成。反转录步骤参照说明书:第1步,去除基因组DNA:4×gDNA wiper Mix 4 μL,模板RNA 0.001~1.000 μg,RNase-Free ddH2O补至16 μL,42℃ 2 min;第2步,逆转录反应:在第1步去除基因组体系中加入5×HiScript Ⅱ Qrt superMix Ⅱ 4 μL,反应程序:55℃ 15 min;85℃ 5 s。cDNA于-20℃保存备用。
1.5 水牛FST基因克隆主要分为PCR扩增、PCR产物连接及测序验证3个步骤;首先以水牛卵巢cDNA为模板进行PCR扩增,用Q5 High-Fidelity 2×Master Mix聚合酶,反应体系20 μL:Q5酶10 μL,cDNA 1 μL,上、下游引物各0.5 μL,去离子水补充至20 μL。PCR反应程序:98℃预变性30 s,98℃变性10 s,58℃退火30 s,72℃延伸1 min,30个循环;72℃延伸5 min,4℃终止反应。琼脂糖凝胶电泳检测产物片段大小,用DNA胶回收试剂盒进行胶回收。回收的目的片段与克隆载体Peasy-T3连接,连接产物转化感受态大肠杆菌,并将菌液接种在含有氨苄(Amp+)的LB固体培养基上,37℃培养箱中培养过夜,待菌落长出后,寻找单克隆进行挑取,并将其放在含有Amp+的LB液体培养基中过夜培养。经过菌液PCR鉴定,选择阳性克隆的重组质粒,送至生工生物工程(上海)股份有限公司测序。
1.6 水牛FST基因生物信息学分析利用MEGA 7.0软件将测序结果与其他物种在GenBank上公布的核苷酸序列构建进化树和进行同源性对比;利用ProtParam程序对水牛FST蛋白的基本理化性质进行分析;利用Signal P4.1 Server和MHMM Server预测水牛FST蛋白的信号肽和跨膜性;利用NPS@在线蛋白分析系统预测水牛FST蛋白的二、三级结构;利用Conserved Domains在线分析水牛FST蛋白的功能结构域。
1.7 实时荧光定量PCR RT-qPCR检测FST基因在水牛不同组织中的表达情况,反应体系参考ChamQTM Universal SYBR@qPCR Master Mix试剂说明书。进行3次重复,内参为UXT基因,反应条件:50℃预温2 min,95℃预变性3 min;95℃变性10 s,60℃退火30 s,共40个循环。目的基因的相对表达量计算方法用2-ΔΔCt进行。
2 结果
2.1 水牛FST基因的克隆及鉴定提取水牛卵巢的总RNA,为了检测其完整度与纯度,进行凝胶电泳后可得到3条清晰的条带(图1A),其中28S条带的亮度明显高于18S条带,5S条带亮度最弱,以此RNA进行反转录得到水牛卵巢cDNA,凝胶电泳检测扩增后的目的片段长度,结果显示,获得1 035 bp的特异性条带,和预期结果符合(图1B)。
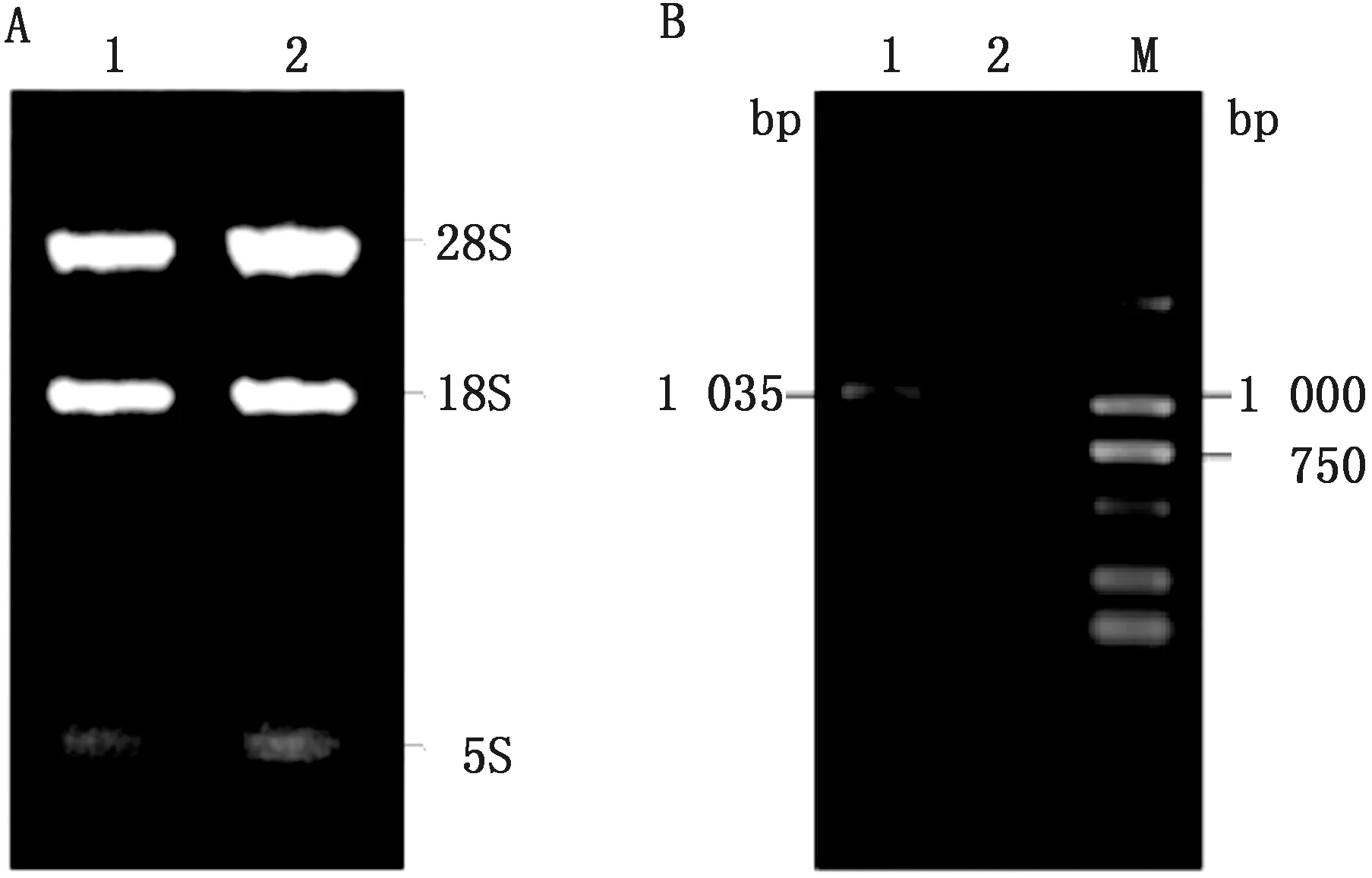
M.DL2000 DNA Marker;1.样品;2.阴性对照
2.2 同源性分析和生物进化树的构建用MEGA 7.0对目的片段与黄牛(XM_601350)、鸡(NM_20520)、绵羊(XM_102181549.2)、人(NM_020396.3)、黑猩猩(XM_003310709.5)、褐家鼠(NM_013479.2)、野猪(XM_001924261.5)和山羊(NM_001285764.1)的核苷酸序列进行同源性比对,结果显示,水牛FST基因氨基酸序列与黄牛、鸡、绵羊、人、黑猩猩、褐家鼠、野猪和山羊的同源性分别为99.1%,81.4%,98.4%,91.9%,91.4%,89.3%,93.4%和81.4%(图2A)。用MEGA 7.0将FST序列与上述物种基因序列构建进化树,结果显示,水牛与黄牛的遗传距离最近,与鸡的遗传距离最远,表明FST基因在物种中的进化具有保守性(图2B)。

图2 水牛FST氨基酸序列同源性分析(A)和不同物种间FST的进化树(B)
2.3 水牛FST的基本理化性质
2.3.1水牛FST蛋白氨基酸组成 利用NCBI BLAST和ExPASy-ProtParam程序对FST的氨基酸序列进行搜索及分析,结果显示,水牛FST蛋白由344个氨基酸构成,分子式为C1601H2553N461O521S43(图3)。对FST蛋白的氨基酸数量进行统计,结果如表3所示,Cys、Glu和Leu的占比较大,分别为11.0%,8.1%和8.1%。水牛FST蛋白的不稳定系数为47.19,是不稳定蛋白。负电荷(Glu+Asp)和正电荷(Lys+Arg)氨基酸分别为43和46个。
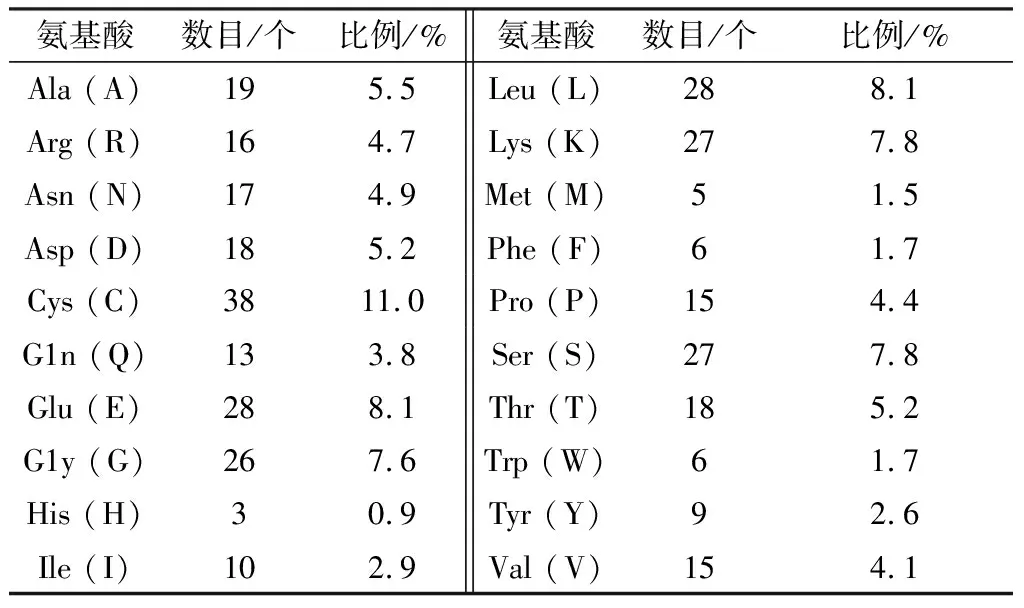
表3 FST蛋白氨基酸组成

图3 水牛FST的氨基酸序列
2.3.2水牛FST蛋白信号肽和跨膜区分析 利用Signal P4.1Server 在线程序预测信号肽,结果如(图4A)所示,预测水牛FST蛋白剪切位点在25~26处,1~25处为预测信号肽区,为分泌蛋白。利用TMHMM2.0程序分析水牛FST蛋白的跨膜性,结果显示,水牛FST蛋白无跨膜结构,预测水牛FST蛋白为经典分泌蛋白(图4B)。
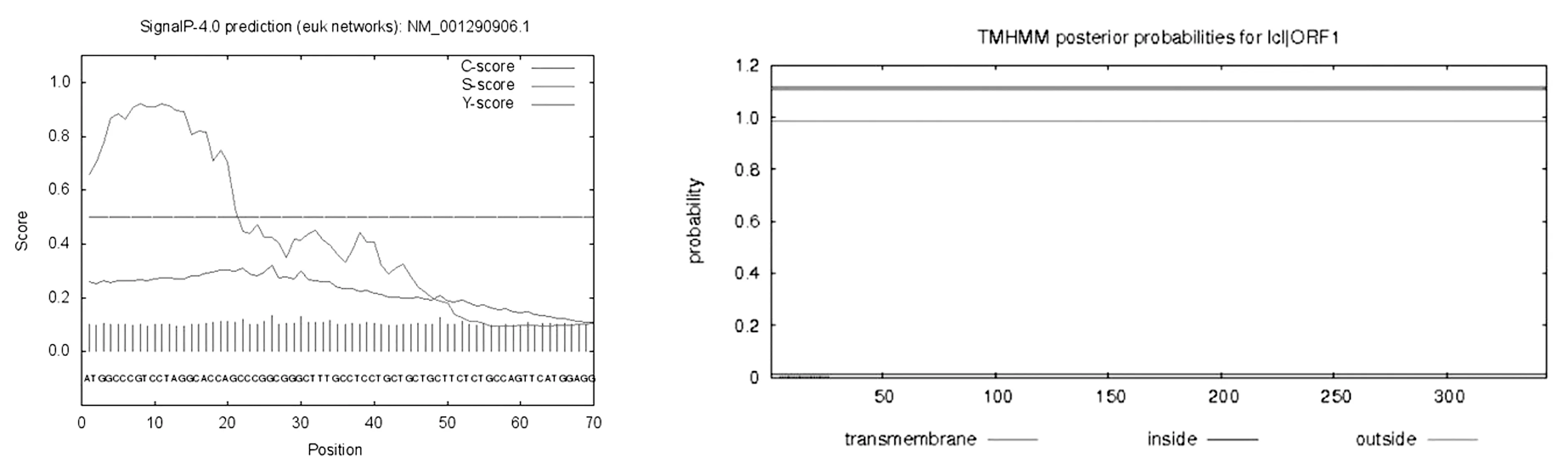
图4 水牛FST蛋白的信号肽图(A)和水牛FST蛋白的跨膜性(B)
2.3.3FST蛋白的二级结构及功能结构域分析 利用NPS@(MLRC方法)在线程序预测水牛FST蛋白的二级结构,结果如图5所示,水牛FST蛋白包括40个α-螺旋、63个延伸链及241个无规则卷曲,分别占11.6%(40个),18.3%(63个)和70.0%(241个)。同时,利用NCBI上Conserved Domains在线预测FST蛋白的保守结构域,结果如图6所示,该蛋白包含2种超家族结构域,分别为KRZAL-FS超家族结构域(95~166/270~316/192~239位氨基酸)和FOLN超家族结构域(167~190位氨基酸)。

h.a-螺旋;e.延伸链;c.无规则卷曲

图6 水牛FST蛋白保守结构域预测
2.3.4预测水牛FST蛋白三级结构 利用SWISS-MODEL软件预测水牛FST蛋白的三级结构,结果如图7所示,水牛FST蛋白含有多个α螺旋及β折叠结构,与二级结构相符。
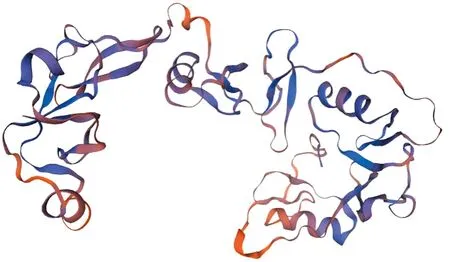
图7 水牛FST蛋白三级结构预测图
2.4 FST在水牛各组织中的表达情况收集水牛胎儿的胃、肌肉、卵巢、睾丸、心脏、肝脏、肺脏和脾脏组织,分别提取各组织的总RNA,然后反转录得到水牛胎儿各组织的cDNA。利用RT-qPCR技术对FST mRNA在水牛胎儿各组织的表达情况进行检测。由图8所示,FST基因在水牛各组织中的表达存在显著性差异(P<0.05),其中在肺脏和卵巢中表达最高,睾丸中表达最低。
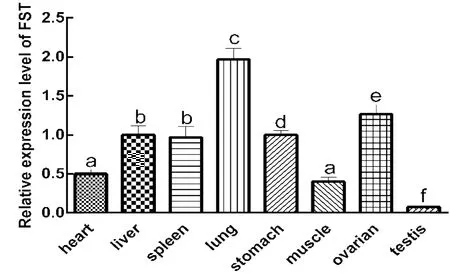
图8 FST基因在水牛胎儿各组织中的表达
3 讨论
水牛是中国南方特有的家畜,其肉质鲜嫩,奶汁具有极高的营养价值,但目前水牛繁殖力与产奶量偏低制约着水牛产业的发展。虽然研究人员已经在水牛卵母细胞IVM、SCNT和胚胎移植等方面取得了较大的成果,但各方面效率仍有待提高,对水牛胚胎发育相关基因的研究较少[9],利用生物技术阐明胚胎发育相关基因的功能,可为进一步提高胚胎发育提供理论依据。FST作为TGF-β超家族中的一员,越来越多的研究证明FST在哺乳生殖方面发挥重要作用。本研究通过克隆水牛FST基因,探究其结构特征,明确FST在卵巢等组织中的表达模式,为进一步研究FST对卵母细胞的作用和完善水牛卵母细胞体外成熟体系提供理论支撑。
有研究表明,TGF-β超家族成员在哺乳动物生殖过程中起重要的作用,主要包括TGF-β、FST、BMP和GDF等,这些因子通过2种带有丝氨酸-苏氨酸激酶活性的结构域发挥作用。在生殖方面,TGF-β超家族成员不仅可以调节卵泡和早期胚胎发育中细胞的生长与分化,还参与组织的旁分泌作用[10]。孙亚蒙[11]以民猪基因组DNA为模板,扩增得到FST基因的CDS区,全长为1 035 bp。本试验以水牛卵巢cDNA为模板克隆得到目的片段序列为1 035 bp,编码344个氨基酸,结果与孙亚蒙[11]报道的民猪FST基因编码区序列长度一致。根据克隆所得片段与褐家鼠、野猪、黄牛、鸡、绵羊、人、黑猩猩和山羊对比同源性,发现其与黄牛的核苷酸序列同源性最高,与山羊和鸡的核苷酸序列同源性最低,且均为81.4%,表明水牛FST在物种中的进化具有保守性。使用MAGE 7.0构建FST的生物进化树,水牛FST与鸡的遗传距离最远,与黄牛的遗传距离最近。
有研究表明,TGF-β超家族成员在N-端都有一段信号肽序列,可借以跨过内质网并且在生物活性区附近有4个氨基酸(RSRR)组成的蛋白酶加工位点,靠二硫键形成二聚体[12-13]。对水牛FST蛋白的理化性质和高级结构进行分析发现,水牛FST分子式为C1601H2553N461O521S43,蛋白不稳定系数为47.19,属于不稳定蛋白;二级结构具有40个α-螺旋、63个延伸链及241个无规则卷曲;预测结构域主要包含2种超家族结构域,分别为KRZAL-FS超家族结构域(95~166/270~316/192~239位氨基酸)和FOLN超家族结构域(167~190位氨基酸),卵泡他汀类结构域与类卵黄素n端结构域在细胞间信息的传递和蛋白质相互识别过程中发挥重要作用,与TGF-β超家族成员功能相符,进一步说明水牛FST蛋白参与调控细胞的生长发育过程。
TGF-β家族成员一般在组织中广泛表达,但对于猪FST的研究显示,FST mRNA在猪卵巢中高表达,但在子宫中不表达[14]。本研究利用RT-qPCR技术检测FST mRNA在水牛组织中的表达水平,发现FST基因在睾丸中表达最低,在肺和卵巢中表达最高,本试验结果与前人的研究结论相符,即FST在卵巢组织中高表达。另外,FST基因在水牛卵巢中高表达,推测FST可能对卵巢的发育等起重要作用,但其具体的机制还有待进一步探究。

