诊断和预测狼疮肾炎生物标志物的研究进展
吴 钰,张慧杰,刘利婷 综述,董海荣 审校
1.内蒙古医科大学,内蒙古呼和浩特 010050;2.呼和浩特市第一医院检验科,内蒙古呼和浩特 010031
系统性红斑狼疮(SLE)是由于机体的免疫功能过强而对自身的正常组织产生免疫应答,生成自身抗体,形成免疫复合物,激活补体,使得组织内发生炎症反应和损伤的一种多系统损伤的自身免疫性疾病[1],其发病率和患病率与性别、年龄及种族密切相关。根据疾病的流行病学调查,SLE好发于育龄期女性[2]。狼疮肾炎(LN)是SLE比较严重的并发症,也是主要的死亡原因之一。SLE患者中约有60%的成人及80%的儿童会发展为LN,高达30%的LN患者会向慢性肾炎发展,最终进展为终末期肾病[3]。多项研究发现,男性SLE患者更易出现肾脏损伤,男性SLE患者LN的患病率(27%~75%)高于女性患者(16%~52%)[1-2]。LN更好发于青少年SLE患者,且SLE患者LN的患病率因种族和民族而异,LN在亚裔SLE患者中的患病率(33%~82%)更高[4-6]。目前,LN的主要治疗手段为高剂量皮质类固醇非特异性减少炎症反应及细胞毒性药物减少自身抗体的产生[7]。肾脏组织活检被认为是LN诊断及分类的金标准,但具有创伤性,且价格昂贵,不能连续监测疾病进展的缺点。生物标志物是一类具有生物活性及化学特征的指标,它们可以反映机体的生理、病理过程及药物治疗过程,可被客观地测量和评估,且标本易采集、对患者创伤性小。自身抗体、蛋白尿、尿蛋白/肌酐比值等常规生物标志物在LN中得到了广泛研究及应用,但是它们不足以预测LN的预后,以及监测对治疗的反应,或确定疾病活动和慢性损伤的程度[8]。本研究论述了LN的传统血液生物标志物及尿液生物标志物,以期为使用生物标志物早期诊断LN及评估疾病预后提供思路。
1 LN发病机制
LN的发病机制非常复杂,主要与环境、遗传及异常的免疫反应导致机体产生大量自身抗体进而激活补体等因素有关。SLE及LN有较明显的遗传倾向,较常见的遗传危险因素之一是人类白细胞抗原(HLA)位点的变异,尤其是HLA-DR3和HLA-DR15等位基因的改变与LN的患病风险明显相关。外泌体及凋亡来源的核物质进入到免疫系统中,通过B细胞受体(BCR)和FcγRⅡ激活B细胞,从而产生Ⅰ型干扰素(IFN-Ⅰ)及促炎细胞因子[9]。由于基因遗传的多态性,B细胞被持续激活,并且产生大量自身抗体,自身抗体与抗原形成的免疫复合物会沉积于肾小球,也可以激活补体,并且补体与白细胞Fc受体结合,启动肾内炎症及损伤[10]。核物质也可通过FcγRⅡ激活未成熟的树突状细胞成为成熟的树突状细胞(DCs),进一步激活自身反应的T细胞。T细胞也参与了SLE及LN的发病机制,其中滤泡辅助性T细胞可以激活生发中心的B细胞产生自身抗体,辅助性T细胞17(TH17)可以产生白细胞介素(IL)-17,从而引起肾脏损伤[5]。见图1。补体也参与了LN的发病过程,当循环系统中的补体水平下降,肾内的补体沉积增加也会引起LN。
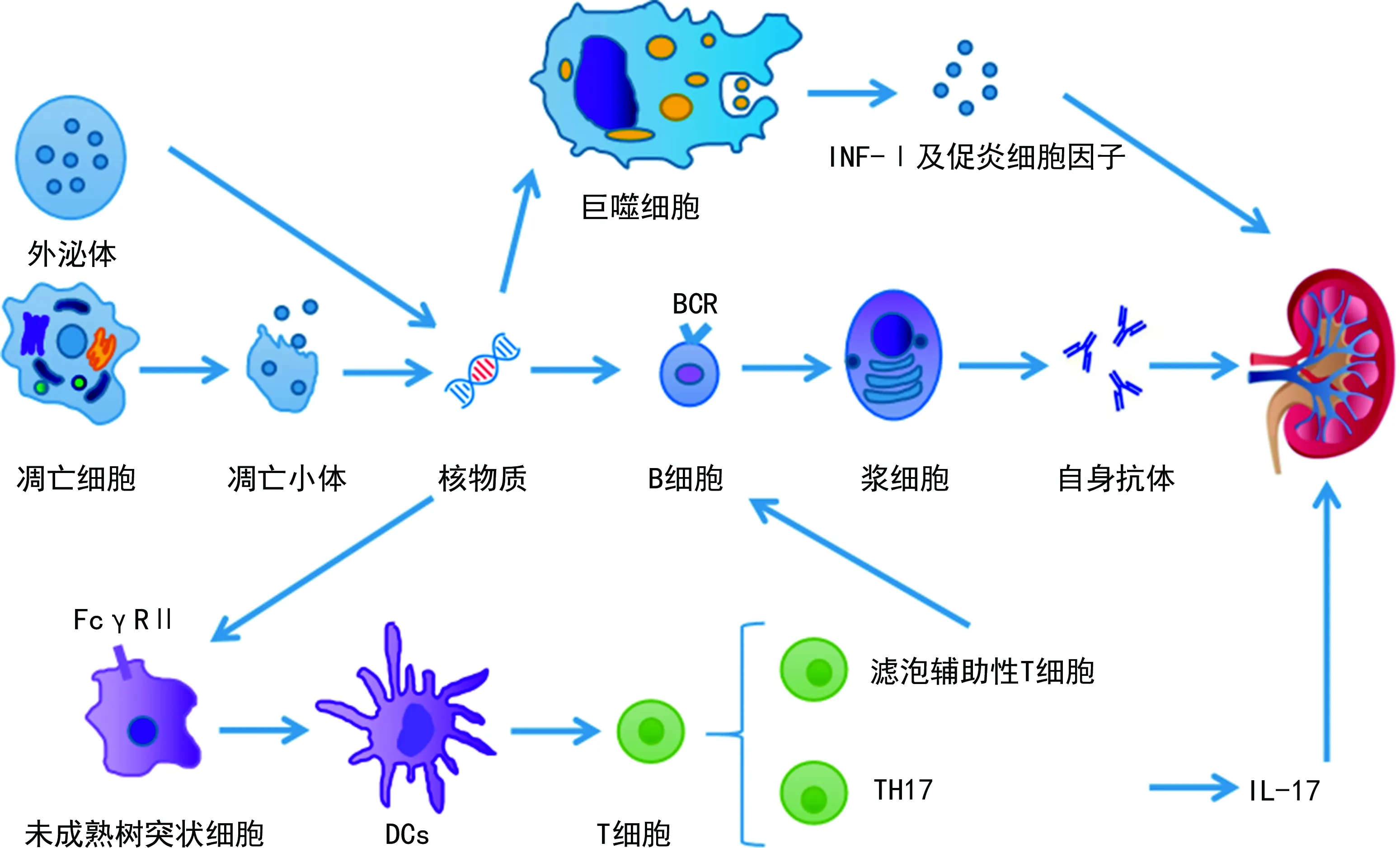
图1 LN的发病机制
2 LN传统血液生物标志物
2.1抗双链DNA(ds-DNA)抗体 ds-DNA抗体是机体针对双链DNA产生的一种自身抗体,参与了SLE的发病机制,是SLE的血清学标志物,也可以为SLE特定治疗的反应提供指导,其诊断SLE的特异度为95%,灵敏度为70%[11-12]。有研究发现抗ds-DNA抗体阳性的SLE患者肾脏受累更加明显[13]。也有研究表明,抗ds-DNA抗体在诊断活动性LN和区分轻、中、重度SLE疾病活动方面表现良好,且ds-DNA抗体在治疗后下降,其水平与系统性红斑狼疮疾病活动度评分(SLEDAI)的变化呈正相关(P<0.05)[14]。
2.2抗核小体抗体 核小体是由146 bp的DNA和组蛋白八聚体形成的复合体,位于细胞核内。来源于凋亡细胞的核小体在SLE患者体内被大量释放,进而在SLE的早期发病机制中发挥作用。SLE患者的机体针对核小体会产生一种自身抗体,称为抗核小体抗体。因此,抗核小体抗体可以很好地反映SLE的活动性[15]。多项研究发现多种自身抗体的联合检测能够更加准确地诊断SLE,尤其是抗ds-DNA抗体与抗核小体抗体联合检测[12,16]。有研究发现,抗核小体抗体的检测可以用于监测LN复发的高风险患者病情[17]。
2.3抗C1q抗体 补体C1q是补体激活途径中重要的起始分子,它在LN的发病机制中发挥重要作用。抗C1q抗体是SLE患者的机体在清除异常凋亡的细胞时产生的,抗C1q抗体与补体C1q相互结合形成的免疫复合物会抑制凋亡细胞的清除,从而诱导免疫反应。在一项病例对照研究中发现,如SLE患者在初始研究时抗C1q抗体阳性,则在未来18个月更易发展为LN,因此认为抗C1q抗体可以作为LN肾脏受累的随访指标[18]。PICARD等[19]在一项儿童队列研究中发现,活动性LN期间抗C1q抗体呈强阳性,活动性抗C1q抗体诊断LN的灵敏度和阴性预测值较高,抗C1q抗体与SLEDAI具有较强的相关性(P<0.05)。
2.4其他自身抗体 除了上述3种常见的自身抗体外,有研究显示,抗ds-DNA抗体、抗核抗体、抗组蛋白抗体是反映LN严重程度的生物标志物,三者同时阳性表明LN病情严重[20]。抗-SSA和抗-SSB常用于诊断干燥综合征,在SLE中也有一定临床价值。在一项研究中发现,抗-SSA、抗-SSB与皮肤、肌肉、骨骼受累的SLE有关,也与轻度LN的表现有关[21]。
虽然传统血液生物标志物已被使用,但仍然存在局限性,还不足以识别活动性LN患者,缺乏对疾病活动的纵向监测,也不能区分LN的病理分型。它们在反映LN疾病活动性和预测预后方面的效能仍然存在争议。
3 LN新型尿液生物标志物
随着各种组学技术的兴起,多种新型生物标志物被研究,如各种蛋白质、细胞因子及血清中的microRNA等。相较于其他类型标志物(血液或组织),采集尿液标本是无创的,且标本更易收集。原尿会在肾脏中进行重吸收和浓缩,因此,尿液是反映LN病变部位活动度的一个较好标本[8]。
3.1肿瘤坏死因子相关凋亡的弱诱导剂(TWEAK) TWEAK是肿瘤坏死因子超家族中的一员。Fn14也属于该家族成员,是TWEAK的受体,二者相互结合通过上调一些趋化因子、细胞因子,进而诱导巨噬细胞、成纤维细胞等产生强烈的促炎反应。有研究发现,TWEAK在LN的发病机制中起到关键作用,TWEAK有助于急性肾损伤后的组织修复和再生,但在慢性肾损伤中其失调会导致疾病发生[22]。因此,TWEAK是LN的潜在生物标志物。
MA等[23]利用Meta分析评估了TWEAK作为诊断LN生物标志物的价值,其纳入了符合标准的9项研究,发现TWEAK诊断活动性LN的灵敏度为0.69,特异度为0.77,受试者工作特征(ROC)曲线下的面积(AUC)为0.827 6,这些结果表明TWEAK具有诊断LN的价值,且有较高的诊断准确性。MOLOI等[24]发现活动性LN患者的尿液TWEAK升高与诱导治疗结束时的治疗反应有关,因此可用于监测疾病活动和治疗反应。另一项研究证实了LN患者的尿液TWEAK作为治疗反应的早期预测因子的作用,在使用免疫抑制剂治疗的第3个月,低水平的尿液TWEAK可以预测第6个月时的治疗反应[25]。
尿液TWEAK是一种较好的诊断及预测LN的潜在生物标志物,但是目前已经发表的文章主要为横断面研究,纵向队列研究的数据较少,且研究中样本量较小。下一步应扩大样本量,并且应多开展纵向队列研究。此外,TWEAK不能区分LN的组织学类型,因此其不能完全替代肾脏组织活检。
3.2嗜中性粒细胞明胶酶相关脂质运载蛋白(NGAL) NGAL是一种相对分子质量为25×103的蛋白,属于脂蛋白超家族成员,表达于许多组织和器官中,包括上皮组织、内皮和骨髓。NGAL是肾脏缺血或肾毒性损伤后表达最稳定的蛋白之一。有研究发现,NGAL可以促进炎症反应和细胞凋亡,从而参与肾脏疾病的发病[26]。研究表明NGAL参与了急性肾损伤的早期发病,可作为肾脏损伤的早期生物标志物,在各种肾脏疾病中其水平升高[27]。
有研究发现,伴有LN的SLE患者尿液NGAL水平明显高于不伴有LN的SLE患者[28]。LI等[29]的研究发现,尿液NGAL可以预测SLE患者慢性肾脏病(CKD)的发展,多因素Cox回归分析表明尿液NGAL水平升高是CKD发生的独立危险因素。该研究还表明尿液NGAL预测LN的能力(AUC:0.69,P<0.005)优于肾小球滤过率(GFR)及血清肌酐。SATIRAPOJ等[30]发现尿液NGAL在预测活动性LN治疗反应方面优于传统血液生物标志物。EL-MOHSEN等[31]的研究与上述观点相同,且发现在肾脏经过诱导治疗后,完全反应组的尿液NGAL水平明显低于部分反应组和无反应组,其AUC为0.943,尿液NGAL能够预测治疗反应,因此尿液NGAL预测肾脏治疗反应的可靠性较高。TORRES-SALIDO等[27]发现尿液NGAL是唯一与肾脏组织活检活性评分相关的参数,也是LN患者肾脏耀斑的良好预测生物标志物。
FANG等[32]利用Meta分析总结了尿液NGAL在诊断活动性LN方面的价值,结果表明尿液NGAL是一项有潜力的生物标志物(AUC>0.70)。GAO等[33]共纳入了19项符合标准的文章进行Meta分析,结果显示尿液NGAL在诊断LN、识别活动性LN及预测肾脏耀斑时的灵敏度为0.72~0.87,特异度为0.67~0.91;NGAL诊断LN、活动性LN和肾脏耀斑的AUC值均大于0.70,其中NGAL在诊断LN时AUC为0.92,表明尿液NGAL是一种非常具有潜力的诊断LN的生物标志物。
虽然目前已有研究均表明尿液NGAL是较好的诊断LN的生物标志物,且能够预测活动性LN对治疗的反应,但目前尚不清楚尿液NGAL能否区分肾炎的组织学类型。并且单中心研究较多,而多中心研究较少。
3.3单核细胞趋化蛋白-1(MCP-1) MCP-1是一种趋化因子,由巨噬细胞、内皮细胞、成纤维细胞、肾小管细胞和单核细胞在一些细胞因子及病毒的刺激下产生[34],通过与趋化因子受体2(CCR2)结合,调节单核细胞趋化和淋巴细胞分化,上调黏附分子及细胞因子,从而引起炎症性疾病的发生[35]。研究发现LN患者体内MCP-1与蛋白尿呈正相关,与GFR呈负相关,与SLEDAI呈正相关,尿液MCP-1诊断LN的特异度较高,灵敏度较低[36]。一项纵向队列研究发现,在区分活动性LN及非活动性LN时,尿液MCP-1优于血清MCP-1,该研究还表明尿液MCP-1随着治疗而下降,具有预测不良反应和复发的价值[37]。近期的一项研究发现,尿液MCP-1与肾脏组织活检中LN的活性指数及慢性指数相关,在慢性肾脏损伤患者中MCP-1的水平更高,尤其常见于肾小管萎缩和间质纤维化的患者[38]。DONG等[39]研究了尿液MCP-1与尿液TWEAK联合检测诊断LN的价值,结果显示该组合诊断LN的灵敏度为86.67%,特异度为80.00%;区分活动性LN的灵敏度为75.00%,特异度为81.82%;AUC均大于0.70。有Meta分析系统性地评价了尿液MCP-1在SLE合并活动性LN患者中的总体诊断价值,结果表明尿液MCP-1可作为一种生物标志物,对活动性LN具有较高的诊断准确性[40]。
目前,针对MCP-1用于诊断LN的相关研究较少,因此MCP-1的价值还有待进一步证实。
3.4CD163 CD163是一种在单核细胞和巨噬细胞上表达的糖基化膜蛋白。在某些炎症刺激下,CD163被金属蛋白酶从质膜上主动释放出来,并扩散到炎症组织或以其可溶性形式(sCD163)进入血液循环。血sCD163水平反映了系统性炎症疾病中巨噬细胞的活性。有研究表明,尿sCD163具有成为肾小球炎症的生物标志物的潜力,特别是与LN相关的肾血管炎[41-43]。ZHANG等[44]发现,与非增生性LN患者相比,增生性LN患者的尿sCD163明显升高(P<0.001),且尿sCD163与SLEDAI、肾脏SLEDAI(rSLEDAI)、活性指数密切相关。有研究发现,在活动性LN中,尿CD163与LN的临床严重程度和组织学活性相关[43],另外该研究还发现尿CD163与炎症性肾小球浸润程度相关,它可能具有区分LN组织学类别(Ⅲ/Ⅳ)和炎症类别(Ⅱ、Ⅴ)的潜能[45]。GUPTA等[46]的研究发现,随着治疗进行,sCD163下降,并且其在LN临床复发或者恶化前升高,因此它可能是一个潜在预测不良治疗反应的标志物。
4 展 望
LN是SLE较为严重的并发症,目前为止还没有较好的治疗方法减少肾脏损伤。只能通过早诊断、早治疗的方法来延缓进展为终末期肾病的速率。肾脏组织活检是LN诊断的金标准,但其具有创伤性,不能连续监测疾病进展。生物标志物具有无创、检测标本易获取等优点。因此,对诊断LN生物标志物的研究变得尤为重要。尿液中的生物标志物能够更加直接客观地反映肾脏损伤的程度,是更加优质的检测标本。新型尿液生物标志物不仅在LN中被研究,在其他疾病中也有被研究,尿液TWEAK-Fn14轴是心肾综合征的临床试验靶标,其是肾脏损伤和心血管结局的生物标志物[47]。有研究认为,NGAL是糖尿病患者的膜性肾病发展为CKD的独立而敏感的预测因子[27],与其他生物标志物相比,TWEAK及NGAL 的研究更多,更加充分,可能是率先被临床应用的尿液标志物。对于其他具有潜力的生物标志物还需要继续进行研究验证。
寻找与LN活动关系更为密切的新型临床生物标志物,或许能够更加准确地进行组织学分类,从而指导个性化治疗。未来需要解决的LN相关问题有很多,可以从以下方面考虑:从新的视角对LN进行病理分型;构建LN患者的预后评分方法;进一步明确免疫抑制剂治疗的时间;减少免疫抑制剂的不良反应。

