基于SIRT3/β-catenin/PPARγ信号通路探讨丹皮酚对急性心肌梗死模型大鼠的治疗作用
徐 明,侯 静,赵丽娜
急性心肌梗死(acute myocardial infarction,AMI)是高发病率和高致死率的心血管疾病,因心肌缺血引起多种活性氧物质生成增加,诱导体内氧化应激反应发生,并启动多种炎性因子、趋化因子大量表达,造成心肌细胞损伤及凋亡,临床表现为持久剧烈的胸骨后疼痛及心肌酶活性增高,并常伴有心律失常,威胁病人生命安全[1-3]。AMI进展过程中,沉默信息调节因子3(silent information regulator 3,SIRT3)/β-连环蛋白(β-catenin)/过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)信号通路在调节氧化应激和炎性因子水平、保护心肌细胞和血管内皮细胞方面具有重要的作用[4]。丹皮酚是中药牡丹皮中主要的酚酸类有效成分,具有改善血管内皮功能、保护心肌细胞及抗炎、抗心律失常等药理作用[5],但丹皮酚与SIRT3/β-catenin/PPARγ信号通路的关系尚未明确。本研究通过建立AMI大鼠模型,观察丹皮酚对大鼠AMI后的保护作用,基于SIRT3/β-catenin/PPARγ信号通路探讨其作用机制,以期为临床治疗AMI的用药提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 无特定病原体(SPF)级雄性SD大鼠60只,体质量200~220 g,购自北京维通利华实验动物技术有限公司。动物合格证号:202010208;动物许可证号:SCXK(京)2020-2-006;动物批号:202010108。
1.1.2 实验药品与试剂 丹皮酚注射液(批号:20190603)购自宁波天真制药有限公司;RIPA裂解液及二喹啉甲酸(BCA)试剂盒购于上海碧云天生物科技有限公司;卡托普利(批号:180102)购自江苏平光制药有限公司;白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)试剂盒购自武汉EIAAb公司;丙二醛(MDA)、超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSP-Px)试剂盒购自南京建成生物工程研究所;兔源β-actin抗体、兔抗SIRT3一抗、β-catenin抗体、兔抗PPARγ一抗及HRP标记山羊抗兔IgG二抗购自美国Abbiotec公司。
1.1.3 实验仪器 VisualSonics Vevo770 型动物心脏超声仪购自美国GE公司;AU2700 全自动生物化学分析仪购自日本奥林巴斯公司;SW1022-ProfiBlot 48型全自动蛋白印迹分析仪购自Bioneer公司;IX73倒置荧光显微镜购自日本奥林巴斯光学有限公司。
1.2 实验方法
1.2.1 AMI模型大鼠的建立 参照相关文献[6],采用左冠状动脉前降支结扎法建立AMI模型:50只SD大鼠适应性喂养1周后,10%水合氯醛腹腔麻醉,气管插管后连接呼吸机并监测心率,在左侧第3肋间、第4肋间横向切开皮肤1 cm左右,打开胸腔暴露心脏,采用4号缝合线在左冠状动脉前降支起源2~3 mm处结扎;另设10只SD大鼠作为假手术组,只穿线不结扎。若此时心电图提示胸导ST段弓背向上抬高、T波高耸及QRS波电压增高伴波幅增宽提示结扎建模成功,之后将心脏送回胸腔并缝合胸壁,待大鼠生命体征稳定后再撤掉呼吸机,建模大鼠连续3 d腹腔注射青霉素钠20×104U预防感染,每日1次。
1.2.2 实验分组及给药 将上述建模成功的SD大鼠采用随机数字表法分为模型组、卡托普利组、丹皮酚低剂量组、丹皮酚中剂量和丹皮酚高剂量组,每组10只;另设10只健康雄性SD大鼠为对照组。建模成功后开始进行丹皮酚及阳性药干预,连续2周,每日1次,依次给予4 mg/kg、8 mg/kg、16 mg/kg的丹皮酚和10 mg/kg的卡托普利灌胃;对照组和模型组给予等体积生理盐水灌胃。末次给药后次日,空腹12 h后进行相关指标测定。
1.2.3 心功能指标测定 末次给药后次日采用多普勒超声诊断仪测量大鼠左室功能。参照相关文献[7],10%水合氯醛腹腔注射麻醉,取仰卧位将大鼠固定在操作台上,使用超声心动仪及高频探头行超声心动图检查,指标包括左室射血分数(LVEF)、左室短轴缩短率(LVFS)和左室质量指数(LVMI)。
1.2.4 苏木精-伊红(HE)染色检测大鼠心脏组织病理学变化 各组大鼠心功能检测结束后,迅速分离冠状动脉及左心室组织,参照相关文献[8]进行HE染色:4%甲醛溶液固定24 h,二甲苯透明,石蜡包埋,苏木素及伊红染色,利用光学显微镜观察心肌组织病理学改变,并进行图像采集。
1.2.5 血清心肌损伤指标检测 各组大鼠超声心动图检测完成后,使用负压管心尖穿刺法取血,血样于4 ℃静置20 min后,以2 000 r/min离心20 min,之后抽取上清,分装后于-80 ℃保存待测。采用全自动生化分析仪检测血清肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)水平及心肌肌钙蛋白T(cardiac troponin T,cTnT)和心肌肌钙蛋白I(cardiac troponin I,cTnI)水平[9]。
1.2.6 血清炎性因子水平测定 根据酶联免疫吸附(ELISA)试剂盒说明书,检测各组大鼠血清IL-1β、IL-6、TNF-α含量[10]。每孔中加入10 μL样品及40 μL样本稀释液,采用酶标仪于450 nm处测量吸光度并按照标准曲线计算IL-1β、IL-6、TNF-α浓度。
1.2.7 心肌组织氧化损伤指标测定 分离上述各组大鼠左心室梗死边缘区心肌组织,参照相关文献[11]制备心肌匀浆:匀浆器中,按照心肌质量/体积为1∶9加入预冷的生理盐水,制备成10%心肌组织匀浆,以3 500 r/min 4 ℃离心20 min,之后取上清液,严格按照试剂盒说明书操作,采用ELISA检测心肌组织MDA、SOD、GSP-Px水平。
1.2.8 心肌组织SIRT3/β-catenin/PPARγ信号通路蛋白的测定 分离上述各组大鼠左心室心肌组织,参照相关文献[12]制备左心室心肌匀浆,RIPA裂解后提取心肌总蛋白,BCA试剂盒进行蛋白定量。之后常规上样、聚丙烯酰胺凝胶电泳,经转膜、封闭,随后依次加入兔源单克隆SIRT3(1∶500)、β-catenin(1∶500)、PPARγ(1∶500)、pAkt(1∶500)、GAPDH(1∶500)一抗及辣根过氧化物酶标志鼠抗兔二抗(1∶2 000),化学底物发光法显色,图像扫描分析,采用Image-QuaNT软件测量其光密度,以GAPDH为内参对照分析。
2 结 果
2.1 丹皮酚对AMI大鼠心功能的影响 与对照组比较,模型组、卡托普利组和丹皮酚各剂量组LVEF、LVFS降低(P<0.01),LVMI增加(P<0.05)。与模型组比较,卡托普利组及丹皮酚中剂量组、丹皮酚高剂量组LVEF、LVFS增加(P<0.05或P<0.01),LVMI降低(P<0.05),且随着丹皮酚剂量增加,大鼠LVEF、LVFS及LVMI改善明显。丹皮酚低剂量组LVEF、LVFS较模型组增加(P<0.05)。详见表1。
表1 丹皮酚对AMI大鼠心功能的影响(±s)
2.2 丹皮酚对AMI大鼠左室组织病理学的影响 对照组左室心肌组织心肌横纹清晰,细胞排列整齐规则,无纤维断裂及炎性细胞浸润。模型组大鼠心肌组织可见心肌纤维肿胀断裂,细胞排列紊乱,心肌间质可见大量炎性细胞浸润,并出现明显的心肌细胞坏死。与模型组比较,卡托普利组及丹皮酚高剂量组心肌细胞排列较整齐,心肌横纹无明显改变,心肌间质存在轻度炎性细胞浸润;丹皮酚中剂量组可见少量心肌纤维肿胀,心肌细胞有炎性细胞浸润,细胞呈轻度肿胀;丹皮酚低剂量组心肌细胞排列、心肌纤维肿胀及炎性细胞浸润均有一定改善。详见图1。
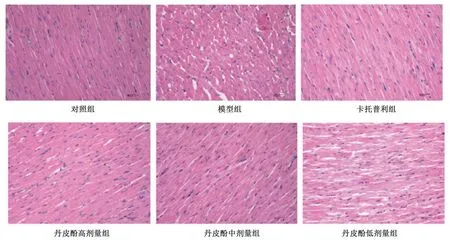
图1 各组大鼠左室组织病理学光镜图
2.3 丹皮酚对AMI大鼠血清心肌损伤指标的影响 与对照组比较,模型组、卡托普利组及丹皮酚各剂量组血清CK、CK-MB、LDH及cTnT、cTnI水平均增加(P<0.05或P<0.01)。与模型组比较,卡托普利组及丹皮酚各剂量组血清CK、CK-MB、LDH及cTnT、cTnI水平均降低(P<0.05或P<0.01),且随着丹皮酚剂量增加,大鼠体内CK、CK-MB、LDH及cTnT、cTnI水平逐渐降低。详见表2。
表2 丹皮酚对AMI大鼠血清心肌损伤指标的影响(±s)
2.4 丹皮酚对AMI大鼠血清炎性因子水平的影响 与对照组比较,模型组、卡托普利组及丹皮酚各剂量组血清IL-1β、IL-6及TNF-α水平均增加(P<0.01)。与模型组比较,卡托普利组及丹皮酚各剂量组血清IL-1β、IL-6及TNF-α水平均降低(P<0.05或P<0.01),且随着丹皮酚剂量增加,大鼠体内血清IL-1β、IL-6及TNF-α水平逐渐降低。详见表3。
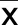
表3 丹皮酚对AMI大鼠血清炎性因子水平的影响(±s) 单位:ng/L
2.5 丹皮酚对AMI大鼠心肌组织氧化损伤指标的影响 与对照组比较,模型组、卡托普利组及丹皮酚各剂量组心肌SOD、GSP-Px水平均降低(P<0.05或P<0.01),MDA增加(P<0.05)。与模型组比较,卡托普利组及丹皮酚中剂量组、丹皮酚高剂量组心肌SOD、GSP-Px水平均增加(P<0.01),MDA降低(P<0.05),且随着丹皮酚剂量增加,大鼠SOD、GSP-Px及MDA水平明显改善。丹皮酚低剂量组GSP-Px水平较模型组增加(P<0.05)。详见表4。
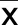
表4 丹皮酚对AMI大鼠心肌组织氧化损伤指标的影响(±s)
2.6 丹皮酚对AMI大鼠心肌组织SIRT3/β-catenin/PPARγ信号通路的影响 与对照组比较,模型组、卡托普利组及丹皮酚各剂量组心肌SIRT3、β-catenin及PPARγ相对表达量均增加(P<0.05或P<0.01)。与模型组比较,卡托普利组及丹皮酚中剂量组、丹皮酚高剂量组心肌SIRT3和β-catenin相对表达量均增加(P<0.05),PPARγ相对表达量均降低(P<0.05),且随着丹皮酚剂量变化,大鼠SIRT3、β-catenin及PPARγ表达量变化量越明显。详见表5。
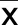
表5 丹皮酚对AMI大鼠心肌组织SIRT3/β-catenin/PPARγ信号通路蛋白的影响(±s)
3 讨 论
AMI多由动脉粥样硬化斑块脱落聚集形成血栓,冠状动脉血流中断所致,进而引起心肌缺血缺氧,心功能受损[13]。中药作为我国特有的医药宝库,从中寻找可有效抑制AMI后心肌组织损伤的药物意义重大。丹皮酚作为传统中药牡丹皮的主要活性成分,具有抗炎、抗氧化、改善心血管疾病等药理作用[14]。本研究结果显示,AMI模型大鼠经丹皮酚干预后LVEF、LVFS增加,LVMI降低,提示丹皮酚可改善左室收缩功能和心肌收缩力,提高心排血量,与相关报道[15]一致;组织形态学证实丹皮酚对心肌的保护作用,丹皮酚干预可减轻心肌细胞炎症浸润及水肿,抑制AMI模型大鼠心肌病理性改变。CK、CK-MB、LDH及cTnT、cTnI作为心肌损伤敏感的生物标志物,心肌发生缺血损伤时,血液中上述特异性心肌酶升高[16],经丹皮酚干预后,AMI模型大鼠CK、CK-MB、LDH及cTnT、cTnI水平均减低,提示丹皮酚具有心脏保护作用,可对抗AMI所致心脏损伤。
AMI后心肌损伤与氧化应激反应和炎症反应引起的心肌细胞凋亡密切相关。心肌梗死发生时,心肌线粒体氧自由基损伤产生大量脂质过氧化反应产物MDA,并不断消耗胞浆SOD、GSH-Px等抗氧化酶,伴随大量IL-1β、IL-6、TNF-α等炎性因子产生,因此,治疗AMI的关键环节是抑制氧化应激和炎症反应[17-18]。为揭示丹皮酚对AMI大鼠的保护作用机制,本研究检测了血清氧化应激指标、炎性因子变化情况,结果显示,AMI模型大鼠经丹皮酚干预后血清IL-1β、IL-6及TNF-α水平均减低,心肌SOD、GSP-Px水平均增加、MDA降低,证明丹皮酚通过提高SOD、GSH-PX及降低MDA水平,减轻AMI过程中氧化应激诱发的心肌损伤,同时降低炎性因子水平,缓解AMI进程。
SIRT3作为一种去乙酰化酶,与心肌肥厚和心肌梗死关系密切,SIRT3基因敲除后心血管平滑肌增殖加快,导致动脉粥样硬化及AMI发生[19]。SIRT3与β-catenin相互调控促进心肌成纤维细胞转化,并与PPARγ核受体结合参与糖脂代谢、炎症反应、脂肪细胞分化等多种生命活动,且抑制PPARγ,激活SIRT3/β-catenin表达,可能有益于改善动脉粥样硬化中的炎症反应[20]。有研究显示,调节SIRT3/β-catenin/PPARγ信号通路可改善AMI大鼠心室重构,降低炎症反应,发挥心肌保护作用[4]。本研究中,AMI模型大鼠经丹皮酚干预后心肌SIRT3及β-catenin相对表达量均增加,PPARγ相对表达量均降低,表明AMI大鼠给予丹皮酚干预后可下调PPARγ,激活SIRT3及β-catenin表达,减轻AMI大鼠体内炎症反应,从而保护心肌细胞。
综上所述,丹皮酚可改善AMI大鼠心功能,抑制氧化应激及炎症反应,其作用可能与调控心肌组织SIRT3/β-catenin/PPARγ通路活性有关。

