miR-375在乳腺癌增殖和临床预后相关性中的研究
于昌盛,方 芳,陈剑平,董斌兵,李 琴,杨二龙
(皖南医学院第一附属医院 弋矶山医院 甲乳外科,安徽 芜湖 241001)
在女性癌症相关死亡病因中,乳腺恶性肿瘤位居第二[1]。近年来,乳腺癌的病死率一直在降低,但是乳腺癌的有效治疗仍面临着巨大的挑战[2]。microRNA是一种典型的内源性非编码RNA,大量实验表明,microRNA在肿瘤的血管生成的调节中起着重要作用[3],miR-375引导自噬作用在多种恶性肿瘤的发生发展过程中起到不可忽视的调控作用[4-5]。本研究旨在探索miR-375在乳腺癌组织、癌旁组织中的表达差异与临床一些预后指标的相关性及对乳腺癌细胞增殖功能的影响,为乳腺癌患者的治疗提供有价值的参考,并探索更为有效的治疗靶点。
1 材料与方法
1.1 细胞系及细胞培养 所有细胞株均购自美国菌种保存中心,使用DMEM培养基(Gibco,美国)繁殖人乳腺癌细胞株MDA-MB-231、MDAMB-468,并且添加10%胎牛血清(Gibco,美国),使用DMEM培养基,其包含:氢化可的松(0.5 μg/mL)、马血清(5%)、表皮生长因子(20 ng/mL)、霍乱毒素(100 ng/mL)及胰岛素(10 μg/mL),繁殖人正常乳腺上皮细胞MCF10A,细胞生长过程均在37℃、5%CO2的细胞培养箱中进行。
1.2 组织标本 收集2018年6月1日~2019年6月1日 弋矶山医院甲乳外科经病理证实的乳腺癌患者45例,且均获取癌组织(实验组)及作为对照组的癌旁组织。前期存放于-196℃液氮罐中,标本存储于标本库,并妥善保管。患者实施手术之前均未进行新辅助治疗。术前与患者及家人充分沟通,签署知情同意书。该研究获医学伦理委员会审批。
1.3 液氮中取乳腺癌组织及癌旁组织 冷冻标本,恢复室温,组织研磨仪研磨后,通过Trizol试剂提取目标组织内的RNA,测定RNA浓度,通过RNA完成标准化的逆转录,进而获取符合要求的cDNA,以此为基础明确miR-375的表达情况,发现其下游引物:5′-ATCGAAGCTTACGCCTTGGAGCTTGTCC-3′,相应的上游引物:5′-ATCGCTCGAGACAGACCCTGCTAAGCGACTC-3′;相关条件为:95℃ 10 min;95℃ 2 s;60℃ 20 s;70℃ 10 s;95℃ 15 s;60℃ 60s;95℃ 1 s,总共涉及到40个 循环。U6下游引物:5′-AACGCTTCACGAATTTGCGT-3′,上游引物:5′-GTGCTCGCTTCGGCAGCACATAT-3′。在反应完成之后进行确认,以得到的数据为基础绘制变量曲线,3个独立实验后,以U6 为内参,获取的数据结合2-ΔΔCt展开计算和分析。miRNA逆转录试剂盒、引物、荧光定量PCR试剂盒(广州市锐博生物科技有限公司)。
1.4 细胞转染 人miR-375模拟物(miR-375 mimic)和阴性对照模拟物(NC mimic),riboFECTTMCP转染试剂均购于广州市锐博生物科技有限公司。提前24 h将MDA-MB-231和MDAMB-468细胞接种到6孔板中,根据说明书使用转染试剂进行瞬时转染。
1.5 细胞增殖实验 检测细胞增殖的具体表现,过程中使用CCK8试剂盒(上海翌圣生物科技,中国)。转染目标细胞24 h,消化后接种到96孔板中(2 000个/孔),细胞出现贴壁后,将10 μL的CCK8试剂加到每孔的细胞中,37℃细胞培养箱中避光生长2 h,在450 nm波长下使用酶标仪检测的吸光度(OD)。克隆形成检测细胞增殖水平。细胞转染24 h,消化后接种到6孔板中(1 000个/孔),培养10 d后去掉培养基,多聚甲醛固定20 min,结晶紫染色15 min,PBS吹洗3次后拍照保存。
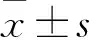
2 结果
2.1 miR-375在乳腺癌组织及癌旁组织、乳腺癌细胞中的表达 荧光定量PCR检测发现,乳腺癌组织(1.130±0.067)低于癌旁组织的miR-375表达(2.180±0.123)(t=7.470,P<0.001),见图1A。miR-375在乳腺癌细胞MDA-MB-231和MDAMB-468中的表达水平较低(P<0.001),见图1B。提示miR-375在乳腺癌中可能起到了抑制作用。

A.两类组织内(乳腺癌组织、癌旁组织)的miR-375表达差异(***P<0.001);B.MDA-MB-231、MDAMB-468和MCF10A中的miR-375表达差异(F=118.000,P=0.000;***P<0.001)。
2.2 miR-375的表达情况与该癌症临床病理之间的关联 miR-375的表达与患者的肿瘤直径、年龄、组织学分级、HR和Her-2状态无关联性(P>0.05),而与淋巴结转移存在关联性(P<0.05),见表1。

表1 不同临床病理参数与乳腺癌患者miR-375的表达
2.3 miR-375在癌组织的表达量与淋巴结转移数目的关系 miR-375在癌组织的表达量与淋巴结转移数目无关联性(P>0.05),见表2。

表2 淋巴结转移数目与miR-375的表达
2.4 miR-375抑制乳腺癌细胞增殖 NC和miR-375 mimic转染乳腺癌细胞株MDA-MB-231、MDA-MB-468进行比较,荧光定量PCR检测发现miR-375 mimic组与对照组相比其miR-375表达均分别增加(t=15.348,P<0.01;t=17.969,P<0.01),见图2A。CCK-8法显示,转染后的miR-375 mimic组乳腺癌细胞的增殖能力均弱于NC组(P<0.01),见图2B。克隆形成实验发现,转染miR-375 mimic组中的乳腺癌细胞克隆数目减少,差异有统计学意义(t=8.260,P<0.01;t=8.084,P<0.01),见图2C。

A.RT-qPCR检测miR-375在miR-375 mimic组与对照组乳腺癌细胞中的差异(**P<0.01);B.CCK-8法 miR-375 mimic组与对照组的细胞增殖能力的分析对比(***P<0.001) ;C.克隆形成实验对比miR-375 mimic组与对照组的细胞增殖能力(**P<0.01)。
3 讨论
研究证实,miR-375位于14号染色体上,是非常具有代表性的单链短序列小RNA,其总共涵盖19~25个核苷酸序列,不具有编码蛋白质的作用,大量涵盖于真核细胞内,在进化方面表现出较强的保守性,miRNA不能与之对应的靶mRNA的3′非编码区相互配对,进而导致靶mRNA出现一定的降解,在转录过程完成之后,与靶基因存在负调控的关系[6]。
miR-375与多种肿瘤的发生发展有关。Yang等研究发现miR-375通过阻断索拉非尼诱导的自噬作用,使肝癌细胞对索拉非尼敏感降低,ATG14是miR-375的直接自噬相关靶点[7]。有研究表明,对37例小肠神经内分泌肿瘤手术患者的42个肿瘤进行了miRNA谱分析,发现miR-375的下调可改变Wnt信号通路,促进肿瘤进展,生存分析显示miR-375的下调与总生存期缩短相关,可作为预后生物标志物[8]。一项临床标本的研究发现,在食道癌患者中,miR-375出现高表达,其生存率往往高于miR-375低表达的患者,通过下调的miR-375可明显促进食道癌细胞增殖及集落形成,促进食道癌的进展[9]。miR-375也在肾透明细胞癌进展中发挥肿瘤抑制作用,部分通过调节YWHAZ。本研究扩展了miR-375的抗肿瘤特性,并支持其作为治疗中潜在治疗靶点的作用[10]。
我们查阅相关数据库显示,miR-375可能与患者内分泌治疗耐药紧密联系,通过联合抑制EGFR和c-ABL可以抑制乳腺癌细胞的生长,miR-375在其过程调节细胞自噬作用[11]。有细胞学实验表明miR-375是乳腺中一个重要的癌基因,EZH2是其上游调节因子,而FOXO1是miR-375的下游靶mRNA,通过介导STAT3的甲基化和激活p53信号通路以抑制癌细胞的增殖[12]。Ali等对绝经前后的妇女血液样本进行检测,发现miRNA-182和miRNA-375可以作为潜在的无创性标记物用于乳腺癌患者的随访[13-14]。上述结果仍有争论,仅停留在细胞学实验,没有对组织学进行研究。本研究结果表明,miR-375在癌旁组织内的表达水平相对较高,而且其超过乳腺癌组织内的表达水平。这表明miR-375 也可能发挥抑制癌症发展的作用。
我们在荧光定量PCR检测乳腺癌和正常组织内miRNAs的表达程度之后,得到的结果表明该物质在乳腺癌组织内的表达水平为1.130±0.067,癌旁组织中为2.180±0.123,两者比较差异存在统计学意义(P<0.001)。提示乳腺癌发生与miR-375存在关联性,乳腺癌组织内miR-375表达显著低于癌旁组织,我们可以分析出在乳腺癌某靶基因演变进程中miR-375能够起到特定的生物学作用,然而其机理还尚待进一步探究。本研究中乳腺癌miR-375表达水平与患者病理特征关系存在一定联系,但与患者年龄、激素受体、肿瘤体积、病理级别无明显的关联性。不同的是Cheng等[15]的研究表明通过检测miR-375的表达与ER-Q阳性有相关性,且miR-375的表达可以区分患者有无局部复发转移。分别对其阳性、阴性及不同组之间进行miR-375表达水平的差异分析,发现其表达与腋窝淋巴结转移、人类表皮生长因子受体-2(HER2)存在着明显差异。通过数据分析miR-375在癌组织的表达量与淋巴结转移数目的关系(≤3,27例;>3,18例),P>0.05,相关性无统计学意义,可以认为miR-375在癌组织的表达量与淋巴结转移数目无相关性。可以假设miR-375不参与乳腺癌细胞的淋巴结转移。与此同时采用CCK-8及克隆形成实验发现过表达miR-375后,乳腺癌细胞的增殖能力明显减弱。这些结果表明miR-375可以抑制乳腺癌细胞的增殖。
然而,本研究也存在一些局限性:样本量较少,没有施行动物实验、蛋白印染实验等,进一步完善实验才能更好了解miR-375通过何种路径调控肿瘤的增殖,其结果将在后续实验中研究。综上所述,miR-375在乳腺癌患者预后分析与预测方面具有作为重要分子标志物的潜力。

