泛素结合酶E2T对卵巢癌细胞增殖、迁移及侵袭的影响
徐 童,周智丽,李铁臣,孙 青
(1.皖南医学院 基础医学院,安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 妇产科,安徽 芜湖 241001)
卵巢癌在女性恶性肿瘤中病死率最高[1],其恶性程度高、预后差,患者5年生存率低于50%[2-3],大多数卵巢癌患者化疗后复发,迫切需要新的治疗策略[4-5]。
泛素结合酶E2T(ubiquitin-conjugating enzyme E2T,UBE2T)属于泛素结合酶E2家族成员[6]。研究表明UBE2T与细胞的增殖、凋亡、肿瘤的发生发展等密切相关,在肺癌[8]、胃癌[9]、乳腺癌[10]、肝癌[11]、鼻咽癌[12]、结直肠癌[13]及前列腺癌[14]等组织中均表达上调。但UBE2T在卵巢癌中的表达情况尚不明确,需要进一步探究。本研究旨在探究沉默UBE2T对卵巢癌细胞增殖、迁移及侵袭的影响。
1 材料与方法
1.1 细胞培养与转染 人正常卵巢上皮细胞系IOSE80和人卵巢癌细胞系HO8910和A2780均购自湖南丰辉有限公司。IOSE80在DMEM培养基(Gibco,美国)中培养;HO8910和A2780在1640培养基(Gibco,美国)中培养,均添加10%的胎牛血清。在细胞培养箱(Thermo,美国)中5%CO2和37℃条件下培养。小干扰RNA(si-UBE2T)以及对应的转染试剂均购自广州锐博生物技术有限公司,其序列如下:ATCCGATTTCTCACTCCAA;按照转染试剂的说明书进行瞬时转染。
1.2 实时荧光定量PCR(qRT-RCR) 使用TRIzol试剂(Invitrogen,美国)抽提细胞总RNA,使用oligo dT(Thermo,美国)逆转录为cDNA,采用SYBR Green qPCR Mix试剂盒(biosharp,上海)进行实时荧光定量PCR。β-actin作为UBE2T内参,均由上海捷瑞生物工程有限公司设计。其序列如下,β-actin引物上游:5′-GTC-ATTCCAAATATGAGATGCGT-3′,下游:5′-GCTATCACCTCCCCTGTGTG-3′;UBE2T引物上游:5′-ATCCCTCAACATCGCAACTGT-3′,下游:5′-CAGCC-TCTGGTAGATTATCAAGC-3′。
1.3 免疫印迹法(Western blot) 用RIPA裂解液(Biosharp,中国上海)提取转染48 h的卵巢癌细胞的总蛋白。制备10%SDS-PAGE凝胶用于分离蛋白,然后转移到PVDF膜上。封闭后用一抗(1∶1 000)在4℃下孵育过夜,然后用二抗(1∶2 000)在室温下孵育2 h,然后进行曝光分析。以β-actin(Beyotime,中国上海)作为内参抗体,UBE2T购自美国Cell signaling Technologies公司。
1.4 Cell Counting Kit-8(CCK-8)实验 调整细胞密度为2×104细胞/mL,按100μL每孔接种于96孔板,每组均设置6个复孔,于37℃、5%CO2培养箱中培养。分别在培养24、48、72、96 h后加入CCK-8检测试剂(Keygenbio,中国南京),每孔10 μL,继续培养2 h,设置酶标仪于波长450 nm处检测各孔吸光度(OD)。
1.5 划痕愈合实验 将细胞接种于6孔板中培养至完全融合。随后,用10 μL移液枪枪头垂直划线,尽量保证每组划痕宽度一致。用PBS冲洗去除细胞碎片,用无血清培养基继续培养细胞,分别在0 h和24 h用显微镜观察并拍照(Olympus,日本)(×40)。用Image J软件测量划痕宽度,计算迁移率。
1.6 Transwell实验 Transwell迁移实验是应用8 μm滤膜Transwell小室(Corning corporation,美国),转染卵巢癌细胞24 h后,将200 μL用无血清培养基稀释的细胞接种于上室,600 μL含10%FBS的培养基加入下室。细胞在37℃、5%CO2条件下孵育48 h后,用4%多聚甲醛固定,用0.1%结晶紫染色,最后用棉签去除上腔室细胞。在荧光倒置显微镜下统计5个随机区域(×100)的迁移细胞数量。Transwell侵袭实验是在小室中铺上Matrigel基质凝胶(BD Biosciences,美国)将细胞接种于上室进行的。
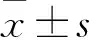
2 结果
2.1 UBE2T在卵巢细胞系中的表达 qRT-RCR实验检测结果显示,HO8910(4.827±0.152)和A2780(4.567±0.768)中UBE2TmRNA的表达量高于IOSE80(1.000±0.368)(n=3,F=55.020,P<0.001),故选取HO8910和A2780进行后续实验。
2.2 沉默UBE2T对卵巢癌细胞增殖的影响 Western blot检测结果显示,在HO8910和A2780中,与对照组相比,si-UBE2T组细胞的UBE2T蛋白表达降低(t=14.450、9.719,P<0.001),见图1A。CCK8实验检测结果显示,在HO8910和A2780细胞中,与对照组相比,si-UBE2T组细胞增殖能力降低(48 h:t=3.294、7.871,P<0.05;72 h:t=6.336、6.754,P<0.01;96 h:t=10.350、6.475,均P<0.01),见图1B。

A.Western blot检测转染si-UBE2T后卵巢癌细胞UBE2T蛋白的表达;B.CCK8比较对照组与si-UBE2T组卵巢癌细胞的增殖能力。*P<0.05,**P<0.01,***P<0.001。
2.3 沉默UBE2T对卵巢癌细胞迁移和侵袭的影响 划痕实验结果显示,划痕后培养24 h,在HO8910和A2780细胞中,si-UBE2T组的细胞迁移率低于对照组(t=12.430、8.829,P<0.001),见图2A。Transwell迁移实验结果显示,在HO8910和A2780细胞中,si-UBE2T组的细胞迁移数量低于对照组(t=12.560、9.958,P<0.001),见图2B。Transwell侵袭实验结果显示,在HO8910和A2780细胞中,si-UBE2T组的细胞侵袭数量低于对照组(t=7.788、5.065,P<0.01),见图2C。
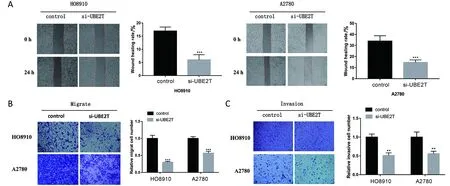
A.划痕愈合实验比较对照组和si-UBE2T组细胞迁移能力(×40);B.Transwell迁移实验比较对照组和si-UBE2T组细胞迁移能力(×100);C.Transwell侵袭实验比较对照组和si-UBE2T组细胞侵袭能力(×100)。**P<0.01,***P<0.001。
3 讨论
根据全球癌症统计数据显示,2020年全球新增31.39万卵巢癌病例,20.72万例死于卵巢癌[15]。临床上手术联合化疗仍为当前卵巢癌的主要治疗方式,但由于多数患者发展到晚期才被确诊,且多数伴随远端转移,这些治疗仍预后不佳。因此,找到新的治疗靶点对卵巢癌的治疗有重要意义。
UBE2T是泛素蛋白酶体系统的成员之一,参与真核细胞中大多数蛋白质的降解,并与细胞信号的转导以及细胞增殖凋亡有关[16]。研究表明UBE2T在多种癌症中呈高表达,且高表达水平与部分恶性肿瘤患者的肿瘤大小、转移等恶性特征及不良预后密切相关。Perez-Pea等发现,UBE2T在乳腺癌中高表达并与乳腺癌患者不良预后密切相关[10]。Hu等发现,UBE2T可以通过AKT/GSK-3β/β-catenin通路促进鼻咽癌细胞增殖、侵袭和转移[12]。Luo等发现,沉默UBE2T通过诱导细胞周期阻滞和凋亡抑制结直肠癌细胞的增殖[13]。Wen等发现,过表达UBE2T可通过作用于Vemintin介导前列腺癌细胞的增殖、EMT和转移[14]。Zhu等发现,UBE2T过度表达可能导致胆囊癌患者预后不佳[17]。而UBE2T在卵巢癌发生发展中的作用及机制还未被研究。本研究发现,UBE2T在人卵巢癌细胞系中呈高表达,下调UBE2T在HO8910和A2780细胞中的表达后,抑制了卵巢癌细胞的迁移、增殖和侵袭能力,这些数据均表明UBE2T与卵巢癌的发展可能密切相关。
综上所述,沉默UBE2T的表达能抑制卵巢癌细胞的增殖、迁移和侵袭,可能是卵巢癌的潜在治疗靶点。但本研究仅通过体外实验分析了UBE2T对卵巢癌细胞的生物学活性的影响,未深入探究其分子机制,这是本研究的不足之处,仍需进一步查阅文献,探讨UBE2T在卵巢癌发生发展中的可能机制。
——一种基于空域亮度模型与形态学特征的方法

