草乌甲素对乙醛诱导的LX-2细胞ECM分泌及相关蛋白表达的影响
袁亚平,孙启山,周小倩,姚 润,湛孝东,赵金红,姜玉新,唐小牛
(1.皖南医学院 医学寄生虫学教研室,安徽 芜湖 241002;2.嘉兴学院医学院 病原生物学与免疫学教研室,浙江 嘉兴 314001)
肝纤维化是世界范围内的一个重大疾病,发病率高,发病机制尚不完全明确,缺乏有效的治疗方法[1]。肝纤维化的特点是由慢性肝损伤引起细胞外基质(extracellular matrix secretion,ECM)的过度积累[2],而慢性肝损伤原因可能有病毒、饮酒及非酒精性脂肪等[3-4]。研究显示:肝星状细胞(hepatic stellate cells,HSCs)参与酒精诱导的肝纤维化过程[5-6],其激活后,分化为具有强大分泌能力的肌成纤维细胞,大量合成并分泌Ⅰ、Ⅲ型胶原蛋白(Col-Ⅰ、Col-Ⅲ)等[7],是形成肝纤维化的基础[8]。体外研究发现,TGF-β1和α-SMA在激活的LX-2细胞中高表达,表明LX-2细胞向肌成纤维细胞转化,提示这两种蛋白可作为LX-2细胞激活的重要标志物[9]。MMP-1作为一种锌依赖性的内肽酶,参与肝脏各种状态下ECM的重建[10-11],在慢性肝损伤及肝脏修复中发挥重要作用[12],但MMP-1的活性可以被TIMP-1抑制和调控[13],肝纤维化的发生和发展由MMP-1与TIMP-1之间含量的变化和活性的大小决定[14]。
草乌甲素(bulleyaconitine A,BLA)作为一种二萜生物碱[15],具有抗炎、抗风湿、镇痛等多种功能。本课题组前期研究表明,BLA能抑制LX-2细胞的增殖,促进其凋亡。本研究拟用乙醛在体外激活人LX-2细胞,诱导ECM的分泌,探讨BLA对乙醛诱导的LX-2细胞ECM及其相关蛋白的影响。
1 材料和方法
1.1 材料
1.1.1 试剂 LX-2细胞株购自南京科佰生物科技有限公司,胎牛血清(FBS)、DMEM培养基、CCK-8细胞毒性检测试剂盒购自美国Gibco公司,TGF-β1、MMP-1、TIMP-1及α-SMA购自美国CST公司,青霉素-链霉素购自美国Hyclone公司,Col-Ⅰ、Col-Ⅲ检测试剂盒、RIPA裂解液、乙醛、异丙醛购自生工生物工程上海股份有限公司,BCA蛋白定量检测试剂盒购自上海康朗生物科技有限公司,其他试剂均为国产分析纯。
1.1.2 仪器 超纯水仪(美国Millipore公司),超低温冰箱(美国莫赛飞世尔科技有限公司),二氧化碳细胞培养箱(日本SANYOMCO公司),XDS-100倒置显微镜(上海蔡康光学仪器有限公司),荧光显微镜(日本奥林巴斯),多功能酶标仪(瑞士Tecan集团公司)、超灵敏多功能成像仪(美国GE公司)。
1.2 方法
1.2.1 细胞培养 将LX-2细胞株置于含10%胎牛血清和1%青霉素-链霉素的培养基DMEM中,5% CO2环境中培养,每24 h用PBS清洗后更换培养液,观察细胞贴壁生长状况。当贴壁细胞生长达70%~90%时,胰酶消化收集细胞再进行传代培养。
1.2.2 CCK-8细胞毒性检测 取对数生长期的LX-2细胞,胰酶消化后收集细胞悬液并计数,将细胞浓度调至5×104mL,添加BLA至终浓度分别为0、1.17、2.34、4.69、9.38、18.75、37.50、75、150、300和600 μg/mL后,分别孵育24、48 h,在此两阶段分别经CCK-8细胞毒性试验(按试剂盒说明书进行),多功能酶标仪检测450 nm吸光度,计算两个时间段细胞半抑制浓度(IC50)。使用不同浓度乙醛(0、15、30、60、120、200、400、600、800 μmol/L)激活LX-2细胞24 h,探索乙醛最佳有效增值浓度,用于后续的实验研究。
1.2.3 LX-2细胞的形态学评价和DAPI染色 将对数生长期的LX-2细胞随机分为空白对照组和BLA组(浓度为18.75 μg/mL)。48 h后,在100倍显微镜下观察BLA处理后细胞的形态学变化。LX-2细胞在6孔板中培养,直到黏附至孔的底部。然后取出培养基,使用PBS洗涤细胞3次,接着用正常培养基或含有18.75 μg/mL BLA的培养基洗涤细胞48 h。然后,PBS细胞洗涤3次,在室温下用4%多聚甲醛固定15 min,再用PBS额外洗涤后,用100 μL预制备的10 μg/mL DAPI染色,平板被铝箔包裹在37℃下孵育20 min。PBS再次洗涤3次后,荧光显微镜观察拍摄图像。本实验凋亡细胞的认定是指细胞核呈致密浓染、荧光强烈的细胞。
1.2.4 ELISA实验 使用ELISA检测试剂盒检测各组Col-Ⅰ和Col-Ⅲ胶原的浓度。
1.2.5 Western blot实验 用RIPA缓冲液和添加了苯甲基磺酰和蛋白酶抑制剂的混合物将细胞在冰上裂解,收集裂解液,以BSA为标准,采用增强型BCA蛋白检测试剂盒测定蛋白浓度。SDS-PAGE电泳,然后在300 mA的恒定电流下转膜(PVDF膜)120min后,用5%脱脂牛奶在TBST中封闭PVDF膜。将封闭后的PVDF膜分别加α-SMA、TGF-β1、MMP-1、TIMP-1抗兔一抗孵育,4℃下过夜。TBST洗膜3次后加入辣根过氧化物酶(1∶1 000稀释)标记的二抗,室温下孵育1h,再用TBST洗涤3次,每次10 min。最后用多功能成像仪分析条带。使用Image J软件计算各条带灰度值的平均值,使用β-肌动蛋白作为加载对照来计算目的蛋白相对表达量。
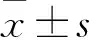
2 结果
2.1 BLA对LX-2细胞活力的影响 经不同浓度BLA处理的LX-2细胞在24、48 h的IC50值分别为20.89、19.20 μg/mL。随后实验使用BLA的相对安全浓度为18.75 μg/mL。见图1。
A.24 h;B.48 h。
2.2 BLA对LX-2细胞形态的影响 对照组LX-2细胞外形呈星形,细胞密度相对较高,贴壁生长较好。BLA组星形细胞较少,相对密度较低,贴壁生长较差(图2)。对照组细胞核大小相近、卵圆形或圆形,数量较多,荧光强度较弱;BLA组细胞核大小不等,形态多样,数量较少,荧光强度较强(图3)。
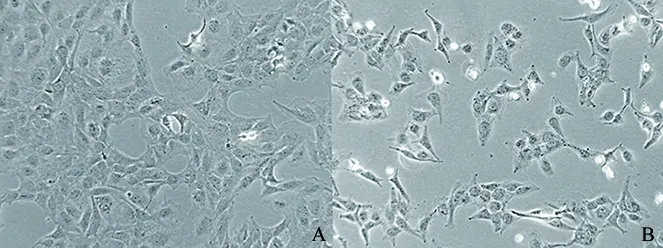
A.NC组;B.BLA组(18.75 μg/mL)。

A.NC组;B.BLA组(18.75 μg/mL)。
2.3 乙醛对LX-2细胞增殖的影响 不同乙醛浓度对细胞增殖均较对照组升高(P<0.05,见图4),对LX-2细胞增殖最有效的乙醛浓度是400 μmol/L。

与NC组比较,*P<0.05。
2.4 各组Col-Ⅰ、Col-Ⅲ检测比较 乙醛组Col-Ⅰ、Col-Ⅲ含量高于对照组(P<0.05),而BLA组Col-Ⅰ、Col-Ⅲ含量低于乙醛组(P<0.05),见图5。
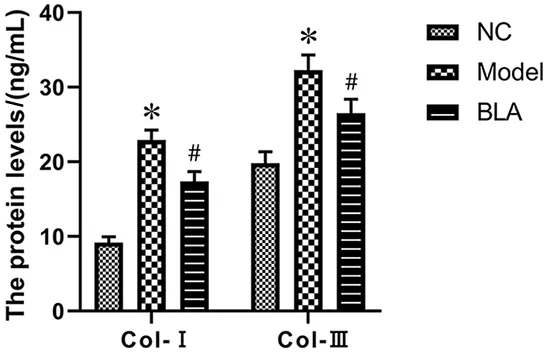
与NC组比较,*P<0.05;与乙醛组比较,#P<0.05。
2.5 各组α-SMA、TGF-β1、MMP-1、TIMP-1标志蛋白的检测比较 乙醛组TGF-β1、α-SMA和TIMP-1蛋白含量均高于对照组(P<0.05),MMP-1蛋白含量低于对照组(P<0.05);BLA组TGF-β1、α-SMA和TIMP-1蛋白含量均低于乙醛组(P<0.05),BLA组MMP-1蛋白含量高于乙醛组(P<0.05),见图6。
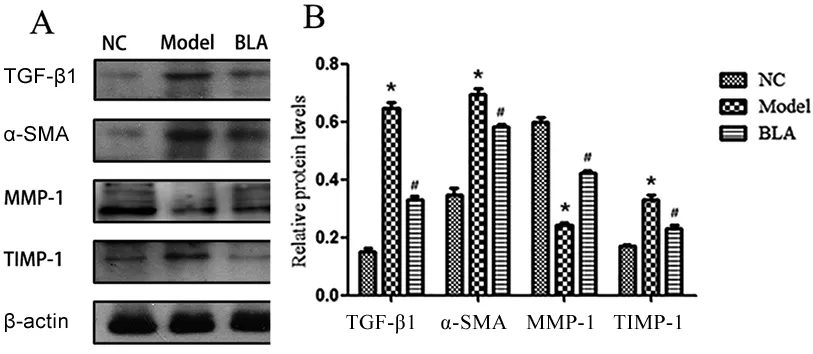
与NC组比较,*P<0.05;与乙醛组比较,#P<0.05。
3 讨论
肝纤维化是由多种原因在人体内通过某种途径诱导激活HSCs过度增殖、活化而引起大量分泌多种ECM而产生。研究发现,肝脏细胞外基质中主要包括胶原蛋白Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ型,另外还有如层黏连蛋白、纤维蛋白等,它们是肝内形成纤维支架及肝细胞生长、迁移、信号传导的基础[8]。然而,当不同原因诱发肝病变时,ECM的各成分含量将会发生很大变化尤其是各种胶原蛋白,其中主要是Col-Ⅰ、Col-Ⅲ大量分泌在肝脏内沉积导致肝脏的纤维化[16-17]。本研究使用乙醇的代谢物乙醛作为诱导剂在体外激活LX-2细胞,使其进一步活化,进而分泌大量的ECM,构建高表达ECM的细胞模型来探讨BLA对乙醛诱导的LX-2细胞ECM及其相关蛋白的影响。研究结果表明,安全浓度BLA处理的LX-2细胞,对细胞活力、细胞生长具有明显的抑制作用,且对细胞的形态结构产生明显的破坏作用;对不同浓度乙醛诱导LX-2细胞增殖结果显示,乙醛能明显促进LX-2细胞的增殖,其对LX-2细胞增殖最有效的乙醛浓度是400μmol/L。进一步研究显示,BLA能明显降低乙醛诱导的LX-2细胞模型Col-Ⅰ、Col-Ⅲ的分泌水平及α-SMA、TGF-β1及TIMP-1蛋白含量,提高了MMP-1含量,从而提高了MMP-1/TIMP-1的比例,说明BLA能明显降低肝纤维化形成的基础物质,进而抑制肝纤维化的形成。其可能机制是BLA通过干预TGF-β1信号通路而抑制人LX-2细胞活化和增殖,提高MMP-1/TIMP-1的比例,加强Col-Ⅰ和Col-Ⅲ的降解,从而降低ECM的沉积。

