miR-129-5p抑制糖尿病视网膜病变血管生成的实验研究
侯银芬,查晓娟,吴昌凡,张鹏飞,王 娟,季 霞,谢 平
(1.南京医科大学第一附属医院 眼科,江苏 南京 210029;2.皖南医学院第一附属医院 弋矶山医院 a.健康管理中心;b.眼科,安徽 芜湖 241001)
糖尿病视网膜病变(diabetic retinopathy,DR)被认为是糖尿病(diabetes mellitus,DM)最常见的微血管并发症,也是发达国家中可预防性失明的主要原因,影响全球约9 500万人。DM的患病率正在增加,预计到2035年将影响5.92亿人[1]。在疾病发展的早期,DR一般是无症状的。但如果治疗不及时,DR会对视力造成不可逆的损伤,并最终发展为失明[2]。由于人们生活水平的不断提高,糖尿病的发病率在不断上升,另外DR的潜在发病机制复杂且尚未明确,因此阻碍了特定、有效治疗方式的发展。因此,我们从分子学机制探究DR的发病,对于未来DR的诊断和治疗有着重要的意义。
糖尿病视网膜疾病包括视网膜血糖损伤的一系列后果,表现为导致新生血管形成和视网膜脱离的微血管DR、糖尿病性黄斑水肿(diabetic macular edema,DME)和加速的潜在神经细胞变性。MicroRNAs(miRNAs)是小的非编码RNA,与mRNA的3′非翻译区(un-translated regions,UTR)相互作用,直接调节mRNA的降解和翻译,并调节基因表达。已有报道miRNAs具有广泛的调控功能,包括细胞增殖、分化、凋亡、自噬等生理病理过程,可能间接影响机体的生理功能和病理过程[3]。miRNAs参与DR相关的微血管形成和能够逆转血脂异常和减缓DR进展,并且有可能成为DR治疗策略。已有大量文献报道miR-129-5p相关的机制:miR-129-5p通过抑制COL1A1抑制胃癌细胞侵袭和增殖[4],miR-129-5p通过TCF4抑制骨形成[5]。miR-129-5p已被报道为癌症和神经疾病的调节剂[6]。多种miRNA可以在视网膜内皮细胞中大量表达[8],因为miR-129-5p已被证明可以调节细胞增殖、分化、凋亡和血管生成[4,9-10]。这些研究表明,对miR-129-5p的功能和机制研究将有助于开发潜在的糖尿病视网膜病变治疗策略。
1 材料与方法
1.1 大鼠糖尿病模型 经过12 h禁食后,将链脲佐菌素等体积注射于所有麻醉后的大鼠腹腔中(STZ;Sigma-Aldrich Corp.,Louis,MO,USA)(65 mg/kg)。对照组大鼠腹腔注射相同体积的柠檬酸盐缓冲液。注射前及注射后7 d、1个月和3个月,用血糖仪测量大鼠清晨的空腹血糖。本研究使用血糖水平超过11.1 mmol/L的大鼠。
1.2 人视网膜微血管内皮细胞及细胞培养 人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRECs)购自中科院上海细胞所,置于含5%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素和1%内皮细胞生长补充剂的内皮细胞培养基(endothelial cell culture medium,ECM)中,培养在37℃、5% CO2湿润环境中。
1.3 miRNA的实时定量RT-PCR 使用TRIzol试剂(Invitrogen)从视网膜组织或细胞中提取总RNA。SYBR Green PCR试剂盒(广东锐博有限公司)用于进行qRT-PCR。U6用作miRNA定量的内部对照。通过2-ΔΔCt计算相对表达。
1.4 细胞转染 miR-129-5p(mimic)模拟物及其阴性对照(mimic-NC)由Genechem公司构建。将细胞置于6孔板中,根据说明书,使用lipofectamine 2000 TM进行转染,将miR-129-5p mimic及mimic-NC转染到细胞中,37℃、5% CO2下孵育48 h。然后,采用定量实时聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)评估转染效率。
1.5 细胞增殖 使用EdU和CCK-8试验检测细胞增殖(RiboBio,中国广州)。将处理过的细胞接种在96孔板中,并在37℃下与50 μmol/L EdU孵育2 h。4%多聚甲醛固定后,将细胞暴露于100 μL 1×Apollo®反应混合物中,细胞核染色采用5 μg/mL Hoechst 33342。使用荧光显微镜(日本东京奥林巴斯)拍摄图像。EdU阳性细胞的百分比定义为增殖率。对于CCK-8分析,将处理过的细胞接种在96孔板中,每孔接种2×103个细胞培养2~4 h后加入CCK-8培养基100 μL,继续孵育2 h;使用酶标仪测量420 nm波长处的吸光度,重复测量3次;第2天开始,连续5 d在相同时间按上述步骤换含10% CCK-8的培养基,孵育2 h后酶标仪测定吸光度。根据所测数据绘制细胞生长曲线。
1.6 视网膜内皮细胞Matrigel管形成实验 按照文献[7]方法检测HRECs的小管形成。将基质胶基质(Corning)置于24孔板的底部,在其上接种HRECs。倒置显微镜(Nikon)下观察毛细管状结构。每孔至少随机选择6个不同视野进行观察。使用Image J软件(MD,USA)分析毛细管状结构的网格、分支和分支长度。
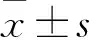
2 结果
2.1 miR-129-5p在细胞及组织中的表达 与基于qRT-PCR测定的对照相比,DM大鼠的视网膜miR-129-5p表达下调(t=5.989,P<0.01)(图1A)。为了进一步探索miR-129-5p在DM视网膜中的作用,在高浓度葡萄糖(HG)培养基(30 mmol/L)中培养RMECs以模拟体外糖尿病状况。qRT-PCR检测结果显示,HG处理24、48 h后均抑制了miR-129-5p的水平(P<0.01)(图1B)。

A.对照组和DM大鼠视网膜中通过qRT-PCR测定的miR-129-5p表达水平;B.在5 mmol/L葡萄糖(正常葡萄糖,NG)、5 mmol/L葡萄糖加25 mmol/L甘露醇(甘露醇)和30 mmol/L葡萄糖(HG)培养基中培养24、48 h的RMECs中miR-129-5p水平的变化(F24 h和48 h=51.659和117.374,P24 h和48 h<0.001;**P<0.01)。
2.2 miR-129-5p抑制HG诱导的HRECs增殖 本研究通过qRT-PCR验证转染效率,过表达组处理后miR-129-5p表达量增加(t=12.899,P<0.001)(图2A)。关于评估miR-129-5p在体外糖尿病条件下的作用,HG处理后相比于未处理组,细胞EdU增殖能力升高(P<0.01);与miR-NC处理相比,HG处理后细胞EdU增殖能力在miR-129-5p过表达下降低(P<0.01)。在CCK8实验中,HG处理1~4 d相比于未处理组,细胞增殖能力升高(P<0.01);与miR-NC处理相比,HG处理1~4 d miR-129-5p过表达组细胞增殖能力降低(P<0.01)(图2B、C)。

A.miR-129-5p模拟物处理的HRECs细胞中miR-129-5p的qRT-qPCR结果;B.转染miR-129-5p模拟物或对照模拟物的HRECs细胞增殖能力的EdU分析及转染HRECs细胞中EdU阳性细胞比率的统计分析;C.转染miR-129-5p模拟物或对照模拟物的HRECs细胞增殖能力的CCK-8分析(Fedu=110.438,Pedu<0.001;Fcck8/1~4 d=82.016、39.867、86.299、327.028,Pcck8/1~4 d<0.001;**P<0.01)。
2.3 miR-129-5p过表达减少视网膜新生血管形成 鉴于miR-129-5p在DM视网膜组织中表达下调,在HG诱导的HRECs中受到抑制。本课题组研究了miR-129-5p过表达对体内视网膜新生血管的影响。小管形成实验表明,HG暴露加速了HRECs的迁移和新生血管形成(P<0.01),其作用被miR-129-5p模拟物逆转(P<0.01)(图3)。

F=40.839,P<0.001;**P<0.01。
3 讨论
DR对患者的生活产生多种负面影响,这在很多国家已被认为是导致失明的主要原因[11]。miRNAs是包含22核苷酸碱基对的小型非编码RNA,能够调控基因表达,导致转录本降解或翻译抑制,在整个基因组中,约30%的基因受到miRNAs的调控[12],包括增殖、迁移和分化等。如miRNA-200b靶向VEGFA基因对DR发生发展的影响[13];miR-365通过抑制Timp3和增加氧化应激促进DR[14];miR-409-5p促进DR的视网膜新生血管形成[15]。因此,在目前的研究中,我们重点研究了HRECs视网膜内皮血管形成的机制,发现一种新的miRNA,miR-129-5p抑制了HRECs新生血管的形成。从而,miR-129-5p过表达降低了DR引起的视网膜损伤。根据我们的研究结果,我们提出miR-129-5p在DR进展过程中起到保护作用。尽管仍需要更多证据,但我们的研究结果为预防DR进展提供了一个新靶标。
首先本研究通过使用qRT-PCR测量了DM大鼠视网膜组织和HG诱导的HRECs中miR-129-5p的表达,这些样本中miR-129-5p的降低表明miR-129-5p作为DR进展的关键调节器。miR-129-5p在众多细胞器中都担任着重要的角色[16],有研究报告显示,miR-129-5p与DM及其并发症的发生和进展有关。miR-129-5p过表达减轻了DR引起的视网膜损伤。根据我们的研究结果,我们提出miR-129-5p在DR进展过程中起到保护作用。值得注意的是,研究表明,miRNA可以被另一种非编码RNA,即长链非编码RNA(long chain non-coding RNA,LncRNA)吸收,从而消除miRNA对下游靶标mRNA的抑制作用。miR-129-5p是否可以被其他LncRNA吸收以调节视网膜新生血管,值得进一步研究。
miR-129-5p是一种很少被研究的miRNA,尤其是在DR中。在目前的研究中揭示了miR-129-5p在抑制HRECs细胞增殖和血管形成方面的新功能。尽管如此,本研究中也存在一些限制,应予以考虑。例如,我们未对下游靶基因做进一步的研究。此外,我们只进行了转染miR-129-5p模拟物后相关功能方面研究,未进行敲低后验证其功能实验。后续我们会在这几个方面进一步探讨其相关机制。
总之,我们的研究表明miR-129-5p在DM大鼠的视网膜组织和HG诱导的HRECs中表达下调,糖尿病条件下miR-129-5p的上调抑制视网膜新生血管形成,miR-129-5p疗法可能代表未来DR的一种新治疗策略。

