谷氨酰胺酶1对卡介苗诱导的巨噬细胞自噬的调控作用*
严 娜, 张 旭, 于嘉霖, 安 琪, 吴晓玲, 邓光存
(西部特色生物资源保护与利用教育部重点实验室,宁夏大学生命科学学院,宁夏 银川 750021)
结核病(tuberculosis)是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染引起的一种人畜共患传染病,严重威胁人类健康和公共卫生安全[1]。巨噬细胞是Mtb的主要宿主细胞。被Mtb感染后,巨噬细胞响应病原体感染会发生凋亡和自噬为主的清除过程或巨噬细胞坏死的病原逃逸过程;其中,自噬作为细胞的一种“清洁”进程,不仅可以维持体内稳态,还能清除入侵的 Mtb 病原体[2]。自噬在 Mtb 感染中的作用机制复杂,至今还未完全明晰。
研究发现,细胞代谢在免疫反应的启动和调节中起着至关重要的作用,机体一旦被感染,免疫细胞会重新连接细胞代谢以适应感染,并产生足够的能量来执行宿主防御功能。谷氨酰胺作为巨噬细胞的主要代谢底物,能够为巨噬细胞的免疫应答提供能量支持,在宿主防御结核分枝杆菌感染中发挥重要作用[3-4]。此外,谷氨酰胺代谢还可以参与细胞自噬的调节[5]。谷氨酰胺酶1(glutaminase 1,GLS1)将谷氨酰胺转化为谷氨酸,在谷氨酰胺代谢中起关键作用。最近的研究发现,被腺病毒感染的人支气管上皮细胞中谷氨酰胺利用和GLS1 活性增加,而降低GLS1 的活性能够抑制病毒的复制[6]。另外,人肺肌成纤维细胞经历谷氨酰胺分解重编程是由GLS1 表达增加所介导的,GLS1抑制剂CB-839在治疗小鼠肺纤维化方面非常有效,GLS1 可能是肺纤维化治疗的潜在靶点[7]。然而,GLS1 在 Mtb 感染后巨噬细胞中的作用仍有待阐明。
因此,本研究通过卡介苗(Bacille Calmette-Guérin,BCG)感染小鼠巨噬细胞RAW264.7,诱导其发生自噬,通过小干扰RNA(small interfering RNA,siRNA)敲减GLS1的表达,并利用 Western blot 和免疫荧光等技术,检测自噬相关因子表达情况,从而初步探讨GLS1 对BCG 诱导的巨噬细胞RAW264.7 自噬的调控作用。上述研究将为结核病的发病及防治机制提供新的思路和见解。
材料和方法
1 RAW264.7细胞培养
RAW264.7 细胞购自中科学院上海细胞研究所。培养步骤:当细胞密度达到80%~90%,吸去培养皿中的培养液,沿壁加入2 mL 的磷酸盐缓冲液(phosphate-buffered saline,PBS)清洗三遍,胰酶消化2 min,900 r/min离心5 min。弃去上清,重悬细胞,根据细胞数量,将细胞悬液分配到培养皿中,放入37 ℃、5%CO2细胞培养箱中孵育。
2 BCG培养与感染
BCG 购自上海生物制品研究所。培养步骤:按照配方配制Middlebroook 7H9 肉汤培养基,并加600 μL Tween-80,高压灭菌,加入增菌剂混匀,挑取菌落,接种于培养瓶中,在培养箱中孵育,待BCG 培养至合适浓度(A600=1.5)后进行传代。
根据实验需要从BCG 培养瓶中吸取适量BCG,离心弃上清,用培养液重悬沉淀,计数。按细胞与BCG 个数1∶10 的比例感染,即感染复数(multiplicity of infection,MOI)=10。
3 主要试剂与仪器
无谷氨酰胺DMEM 培养液和高糖DMEM 培养液购自Gibco;小牛血清、胎牛血清和PBS 均购自Biological Industries;Middlebrook 7H9 肉汤培养基购自BD;OADC 增菌剂购自青岛海博生物技术有限公司;胰酶购自北京索莱宝科技有限公司;全蛋白酶提取试剂盒购自南京凯基生物科技发展公司;蛋白定量(BCA 法)试剂盒和蛋白marker 购自Thermo Fisher;兔抗鼠LC3B 和GLS1 抗体购自武汉爱博泰克生物科技有限公司;其他Ⅰ抗和Ⅱ抗均购自Proteintech;荧光Ⅱ抗购自Invitrogen;含DAPI防淬灭荧光封片剂购自中杉金桥公司。凝胶成像系统购自Bio-Rad;Odyssey Sa 双色红外激光成像系统购自LI-COR;Enspire荧光酶标仪购自PerkinElmer;荧光光学显微镜购自麦克奥迪(Motic)实业集团有限公司。
4 主要方法
4.1 siRNA 的构建及转染 根据GLS1 序列设计siRNA-GLS1 和siRNA-NC,由上海吉玛制药技术有限公司合成,具体序列见表1。取对数生长期的RAW264.7 细胞接种到 6 孔板中,每孔接入 1×106个细胞;贴壁后将转染试剂(ZETA LIFE)与siRNA按1∶1 混合(6 μL 转染试剂和6 μL siRNA),室温放置10~15 min后,入细胞培养板中,24 h后进行后续试验。

表1 siRNA序列Table 1. siRNA sequences
4.2 免疫荧光检测 爬片:提前将20 mm 细胞盖玻片置于12 孔板中,每孔接种5×104个细胞,贴壁后按照实验设计处理细胞。制片步骤:弃去培养液,4%多聚甲醛固定20 min,1×的PBS 洗三次。0.5% Triton X-100 通透30 min,3%牛血清白蛋白室温封闭1 h。37 ℃孵育Ⅰ抗(用3%牛血清白蛋白按照1∶200比例稀释LC3B 抗体)3 h,1×PBS 洗3 次,37 ℃避光孵育荧光Ⅱ抗(用PBS 按照1∶500 稀释)1 h,最后用含DAPI 的封片剂封片4 ℃保存,使用激光共聚焦显微镜观察LC3的荧光表达并拍照。
4.3 细胞内自噬流检测 爬片与免疫荧光操作一致。转染 siRNA 24 h 后,按 mRFP-GFP-LC3 串联荧光蛋白腺病毒与细胞比例为20∶1加入病毒,2 h后更换培养液,待荧光强度达到最好时,进行BCG 感染,固定,封片。通过荧光显微镜成像软件观察细胞红色荧光、绿色荧光及两者重合后的荧光图,拍照计数并分析自噬流水平(黄色斑点代表自噬体,红色斑点代表自噬溶酶体)。
4.4 Western blot 检测 将RAW264.7 细胞以每孔1×106个细胞接种于6 孔板中,贴壁后处理细胞。使用全蛋白提取试剂盒,按照说明书操作,提取蛋白并用BCA法检测蛋白浓度。根据需要测定的蛋白大小配制分离胶,将各组蛋白按25 μg 定量上样并进行SDS-PAGE,然后用湿转法将蛋白样品从胶转移到聚偏二氟乙烯膜(300 mA,2 h)。5%脱脂牛奶37 ℃封闭1 h,4 ℃过夜孵育蛋白Ⅰ抗(1∶1 000 比例稀释βactin、GLS1、LC3B、ATG5、ATG7 和 ATG12 抗体),TBST 洗涤 6 min×5 次,孵育Ⅱ抗 1 h(1∶5 000 稀释Ⅱ抗),TBST 洗涤。使用化学发光液(ECL 发光)检测蛋白条带并通过GE 化学发光检测仪进行曝光,结果用ImageJ软件分析。
4.5 谷氨酰胺/谷氨酸检测实验 测定谷氨酸/谷氨酰胺含量实验用ELISA 试剂盒。将处理好的细胞用PBS 洗 2 遍,加入 RIPA 裂解,10 000 r/min 离心 15 min,取上清按照剂盒说明书进行。为了消除细胞数量不同带来的结果误差,取裂解好的上清用BCA 定量其蛋白浓度,然后用谷氨酰胺/谷氨酸浓度除以蛋白浓度,得出最终数据。
4.6 流式细胞术检测自噬率 RAW264.7 细胞接种于6 孔板中,置于细胞培养箱中过夜培养,转染siRNA,24 h 后按照 MOI=10 的加入 BCG 感染 12 h。弃去完全培养液,PBS 洗 2 次。500 μL 胰酶消化 2 min,加 500 μL 完全培养液终止消化,800 r/min 离心5 min,弃上清。加入500 μL 带有染料的Assay buffer,轻轻重悬,置于细胞培养箱孵育30 min,800 r/min,离心5 min,弃上清。用1 mL PBS 重悬,上机检测,采用FlowJo 7.6.1软件分析细胞自噬数据。详细操作见CytoID检测试剂盒说明书。
5 统计学分析
所有数据均以3 个独立实验的均数±标准差(mean±SD)表示。使用 GraphPad Prism 9.0 软件中的One Way ANOVA 进行数据分析,并经过Bonferroni校正。以P<0.05为差异有统计学意义。
结 果
1 BCG 感染促进了巨噬细胞自噬标志蛋白LC3B的表达
为探究BCG 感染对RAW264.7 细胞自噬的影响,确定BCG诱导自噬发生的最佳感染条件,我们设置BCG 以不同MOI、不同感染时间感染RAW264.7细胞,利用Western blot 检测巨噬细胞内自噬标志蛋白LC3B表达情况。Western blot结果显示,与对照组相比,BCG 感染可促进 LC3B 表达,在 MOI=10、感染时间为12 h时LC3B 的表达量最高,且显著高于对照组(P<0.01),见图 1。因此,我们确定 BCG 诱导RAW264.7 细胞发生自噬的最佳感染条件为MOI=10且感染时间为12 h。
2 BCG感染促进了巨噬细胞内谷氨酰胺分解代谢
为了探究BCG 感染对RAW264.7细胞内谷氨酰胺分解代谢的影响,我们利用Western blot 检测了BCG 不同MOI、不同感染时间感染RAW264.7 细胞后细胞内谷氨酰胺分解代谢的关键酶GLS1 蛋白表达情况。Western blot 结果显示,BCG 感染可显著增加GLS1蛋白表达量(P<0.01),随着MOI和感染时间的增加,GLS1 的表达出现了先上升后下降的趋势,在MOI=10、感染时间为12 h 时GLS1 的蛋白表达量最高,见图2A、B。
我们还通过ELISA 检测了巨噬细胞内谷氨酰胺和谷氨酸的水平,发现BCG 感染后细胞内谷氨氨酰胺含量显著降低(P<0.01),而谷氨酸含量显著增加(P<0.01),在感染时间为12 h、MOI=10 时变化最大,见图2C~F。以上研究结果表明,BCG 感染促进了巨噬细胞内谷氨酰胺分解代谢。
3 敲减GLS1增加了巨噬细胞内谷氨酰胺水平
如图 3A 所示,与 NC 组相比,BCG 感染可上调RAW264.7 细 胞 GLS1 的 表 达 ;与 BCG 组 相 比 ,siRNA-GLS1+BCG 组中 GLS1 的表达显著降低(P<0.01)。如图3B 所示,敲减GLS1后胞内谷氨酰胺含量显著增加(P<0.05)。以上结果表明,敲减GLS1下调了BCG 感染后GLS1 的表达,可用于研究GLS1 在BCG诱导细胞自噬中的作用。
4 敲减GLS1抑制了BCG诱导的巨噬细胞自噬
为探究敲减GLS1对BCG 感染的RAW264.7 细胞自噬的影响,我们利用Western blot 和流式细胞术分别检测了自噬相关蛋白表达和自噬率。Western blot 结果表明,与 BCG 组相比,siRNA-GLS1+BCG 组LC3B(P<0.01)、beclin-1(P<0.01)和 ATG12(P<0.05)蛋白的表达量显著降低,见图4A。流式细胞术结果显示,与对照组相比,BCG 感染后巨噬细胞自噬率显著上升(P<0.01),而敲减GLS1使BCG感染后巨噬细胞自噬率显著下降(P<0.05),见图4B。以上研究结果表明,敲减GLS1对BCG 感染诱导的RAW264.7细胞自噬具有抑制作用。
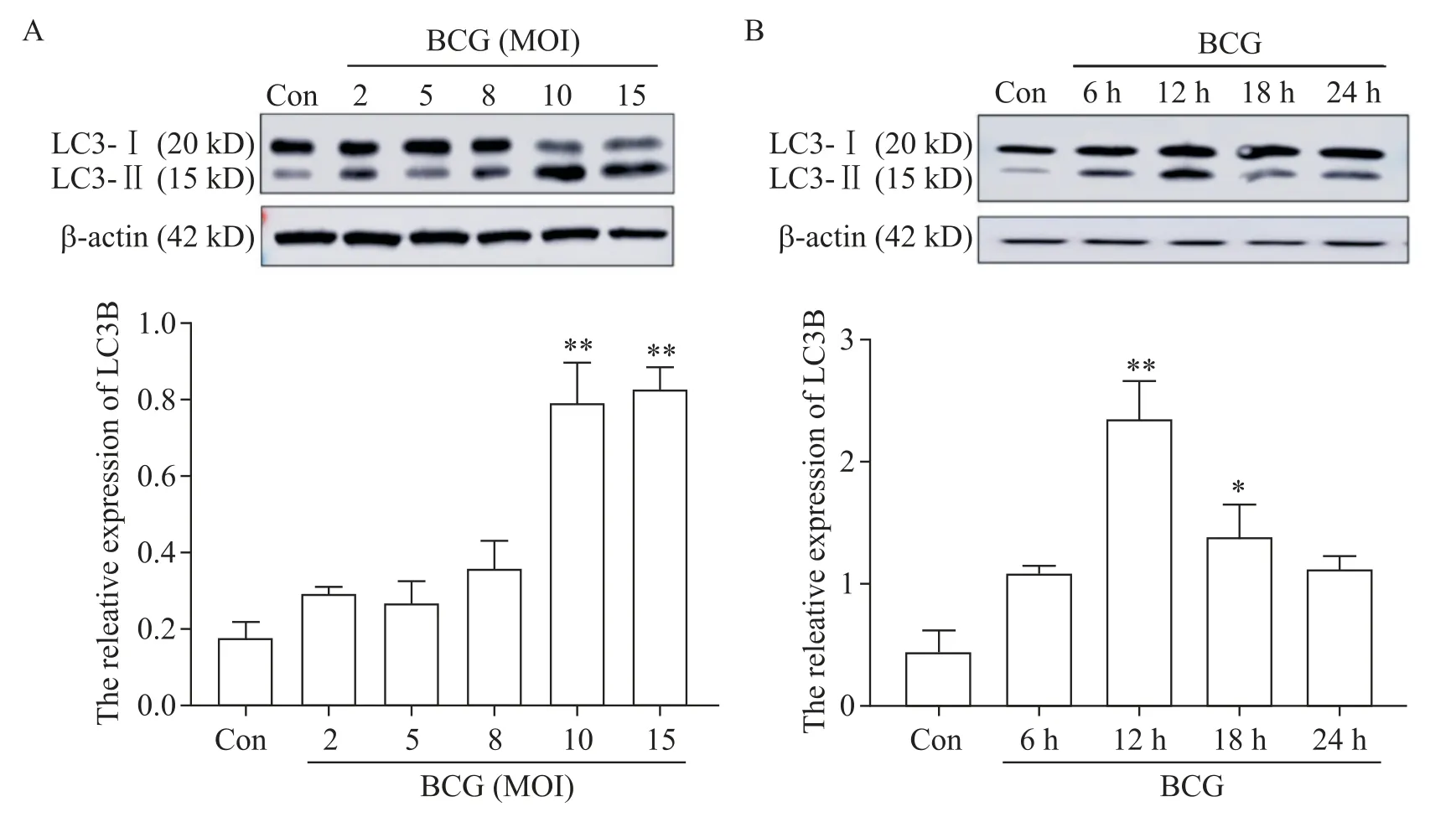
Figure 1. Effect of BCG infection on the expression of autophagy marker protein LC3B in macrophages. A:the LC3B protein expression in RAW264.7 cells with different multiplicities of infection(MOI)of BCG was detected by Western blot;B:the LC3B protein expression in RAW264.7 cells with BCG infection for different time was detected by Western blot. Mean±SD. n=3.*P<0.05,**P<0.01 vs control(Con)group.图1 BCG感染对巨噬细胞自噬标志蛋白LC3B表达的影响
5 剥夺谷氨酰胺对siRNA-GLS1 抑制的巨噬细胞内自噬相关因子的影响
上述研究结果显示,敲减GLS1显著增加巨噬细胞内谷氨酰胺的含量,并伴随自噬的减弱,提示敲减GLS1调控的细胞自噬与细胞内谷氨酰胺含量增加相关,为进一步验证,将培养液中的谷氨酰胺剥夺再处理细胞,利用Western blot 和免疫荧光检测了自噬标志蛋白LC3B 的表达。Western blot 和免疫荧光结果均显示,在正常培养的RAW264.7 细胞中干扰GLS1显著抑制了BCG 诱导的LC3B 表达(P<0.05);剥夺谷氨酰胺处理RAW264.7 细胞后,与BCG 组相比,siRNA-GLS1+BCG 组LC3B 的表达量无著变化,见图5A、B。
利用 Western blot 检测 ATG5 和 ATG12 蛋白的表达情况,结果显示,ATG5和ATG12蛋白表达与LC3B表达结果一致,见图5C。因此,敲减GLS1可能是通过改变细胞内谷氨酰胺的含量来调控细胞自噬。
6 剥夺谷氨酰胺对siRNA-GLS1 抑制的巨噬细胞内自噬流的影响
我们用mRFP-GFP-LC3 串联荧光蛋白腺病毒感染巨噬细胞,随后根据实验需要进行处理,荧光显微镜观察结果如图6所示,在正常培养的RAW264.7细胞内,干扰GLS1后黄色和红色LC3 阳性荧光斑点的数量显著减少(P<0.05);剥夺谷氨酰胺处理RAW264.7 细胞后,敲减GLS1并没有影响黄色和红色的LC3 阳性荧光斑点数量。结合前面的结果,本研究认为,在BCG 感染巨噬细胞RAW264.7过程中,敲减GLS1后可通过增加巨噬细胞内的谷氨酰胺含量抑制BCG诱导的细胞自噬。
讨 论
由于Mtb 感染持续时间较长,抗生素治疗存在不良影响,以及耐多药Mtb 的出现,目前可用于治疗结核病的方法疗效逐渐变差;同时由于新冠肺炎大流行的发生,医疗资源转移,结核病的预防诊断和治疗服务难度大幅增加[8-9]。因此,迫切需要发现新的靶点和开发新的策略和药物来治疗结核病。
巨噬细胞是宿主免疫防御的前哨,Mtb作为一种胞内寄生菌,感染巨噬细胞后会触发一系列信号事件,为了自身利益而劫持宿主的先天免疫途径,影响细胞凋亡、自噬和坏死等过程,其中自噬不仅可以维持细胞内稳态还可以清除入侵的病原菌[10-11]。本研究结果发现BCG 可以诱导巨噬细胞发生自噬,且存在时间依赖性。巨噬细胞免疫功能的执行并不是一个独立的进程,其发生会受到代谢通路的影响。有研究表明,谷氨酰胺代谢在抵抗病原体的免疫应答中起着至关重要的作用,并且最新的报道显示细胞谷氨酰胺代谢与针对结核分枝杆菌的有效宿主反应有关[4,10]。GLS1 是谷氨酰胺代谢的关键酶和限速酶。目前研究发现,Mtb 感染的骨髓巨噬细胞(bone marrow-derived macrophage,BMDM)和人巨噬细胞中GLS1 表达上调;另外,BCG 体外刺激人单核细胞后,参与谷氨酰胺代谢的氨酰胺酶和谷氨酸脱氢酶在单核细胞中也上调[12-13]。本研究发现,BCG感染巨噬细胞 RAW264.7 后,GLS1 表达也显著上调,在 BCG 的MOI=10、感染时间为12 h 时表达量最高,与已报道的研究结果一致。我们还发现BCG 感染巨噬细胞后,细胞内谷氨酰胺含量显著减少。有研究报道在Mtb感染BMDM 的早期(感染12 h),谷氨酰胺被迅速而广泛地消耗[14],与本研究结果一致。
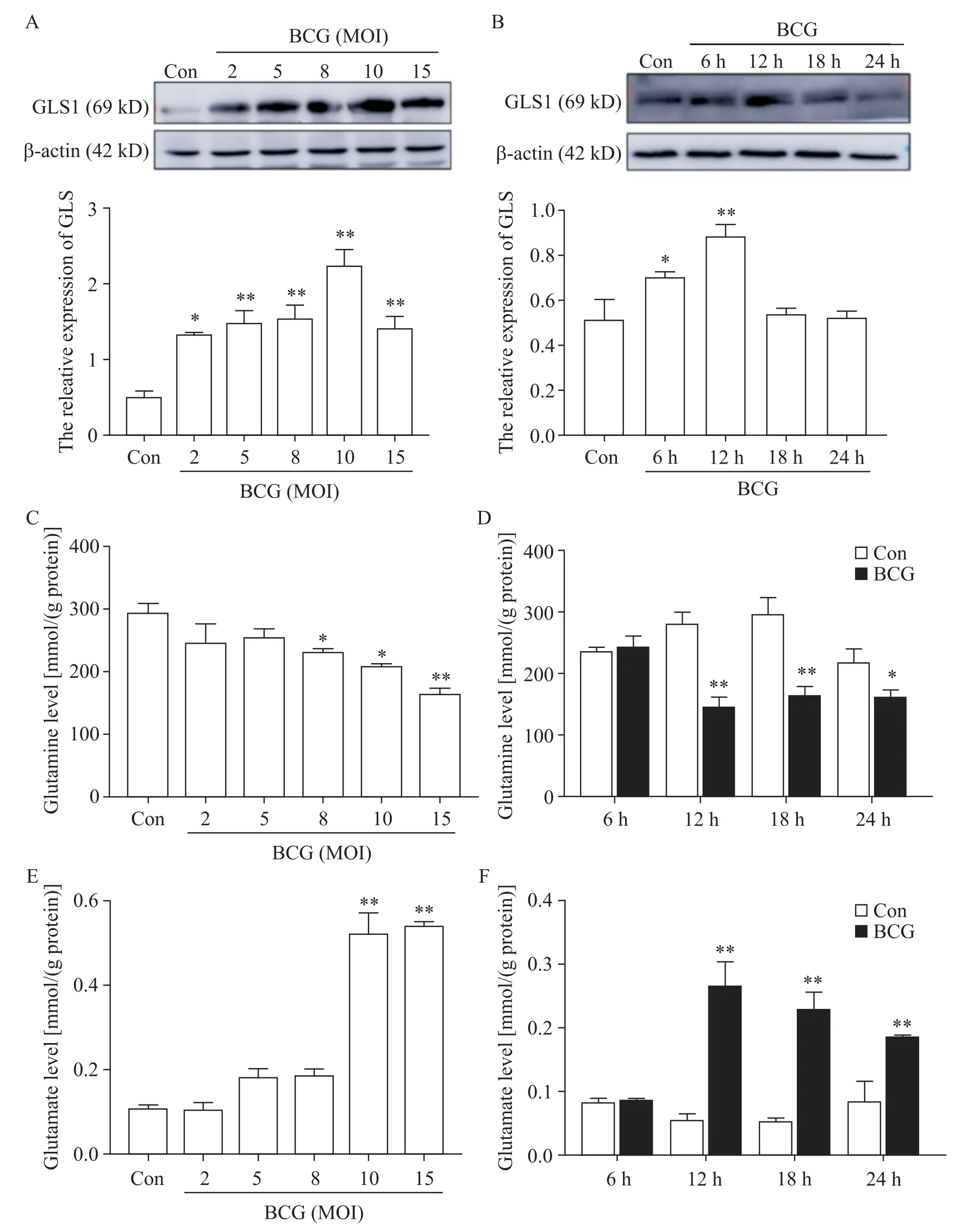
Figure 2. The effect of BCG infection on glutamine catabolism in macrophages. A:the protein expression of GLS1 in RAW264.7 cells with different multiplicities of infection(MOI)of BCG was detected by Western blot;B:the protein expression of GLS1 in RAW264.7 cells with BCG infection for different time was detected by Western blot;C and D:the effect of BCG at different MOI for different time on intracellular glutamine content in RAW264.7 cells was detected by ELISA;E and F:the effect of BCG at different MOI for different time on intracellular glutamate content in RAW264.7 cells was detected by ELISA. Mean±SD. n=3.*P<0.05,**P<0.01 vs control(Con)group.图2 BCG感染对巨噬细胞内谷氨酰胺分解代谢的影响
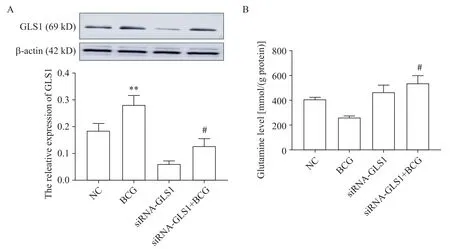
Figure 3. Effect of GLS1 knockdown on glutamine content in BCG-infected macrophages. A:establishment of GLS1 knockdown model;B:ELISA detection of glutamine content. Mean±SD. n=3.**P<0.01 vs NC group;#P<0.05 vs BCG group.图3 敲减GLS1对BCG感染的巨噬细胞内谷氨酰胺含量的影响

Figure 4. Effect of GLS1 knockdown on BCG-induced macrophage autophagy. A:Western blot detection of LC3B,beclin-1 and ATG12 protein expression;B:flow cytometry detection of RAW264.7 cell autophagy rate. Mean±SD. n=3.*P<0.05,**P<0.01 vs NC group;#P<0.05,##P<0.01 vs BCG group.图4 敲减GLS1对BCG诱导的巨噬细胞自噬的影响
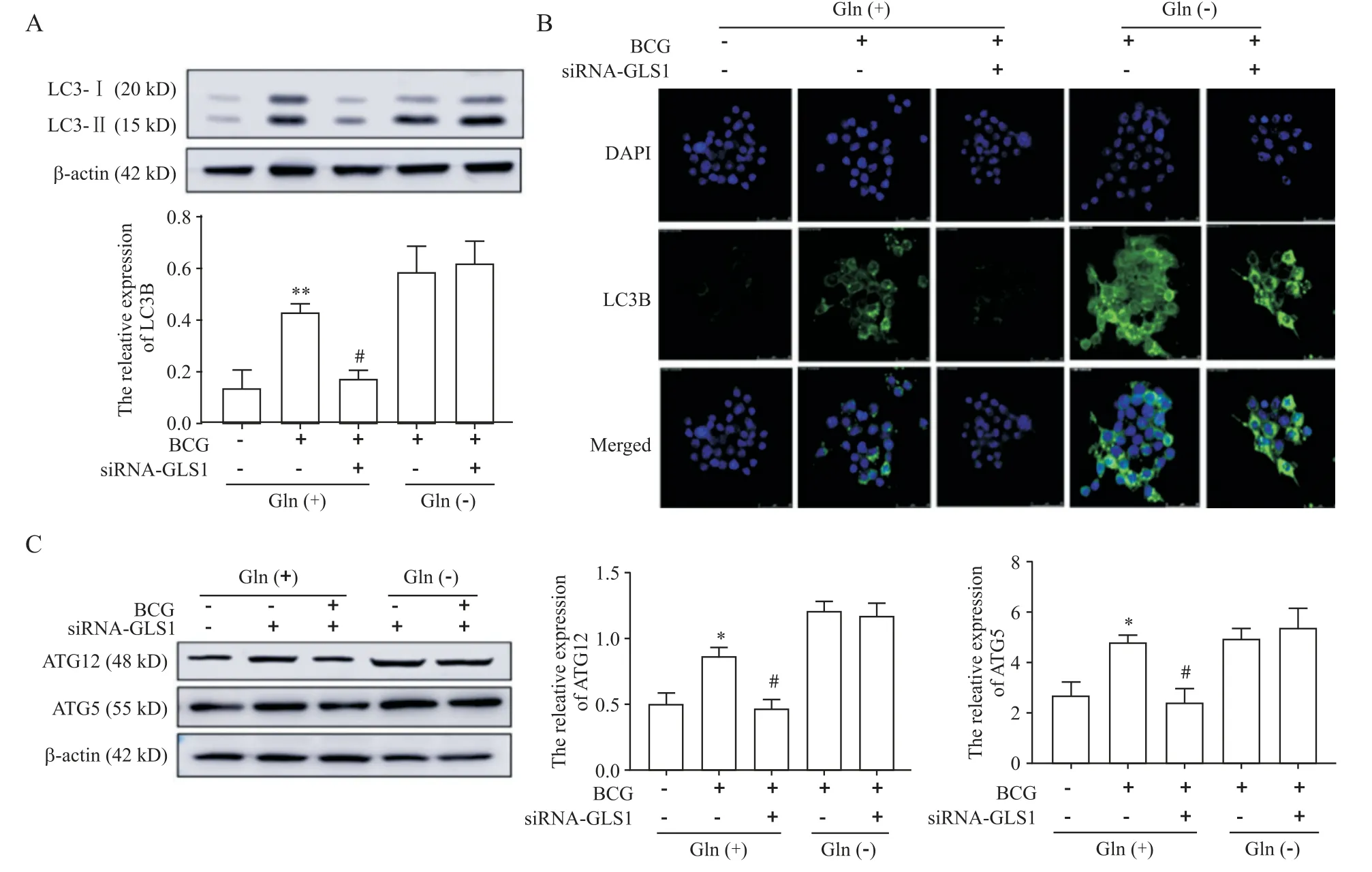
Figure 5. Effects of glutamine deprivation on expression of autophagy-related proteins in macrophages transfected with siRNA-GLS1.A:Western blot was used to detect the LC3B protein expression in RAW264.7 cells;B:rabbit anti-mouse LC3B antibody was used for immunofluorescence staining,and the nucleus was stained with DAPI(blue)for counterstaining(×400);C:Western blot was used to detect the ATG5 and ATG12 protein expression. Mean±SD. n=3.*P<0.05,**P<0.01 vs NC group;#P<0.05 vs BCG group.图5 剥夺谷氨酰胺对siRNA-GLS1转染的巨噬细胞内自噬相关蛋白表达的影响
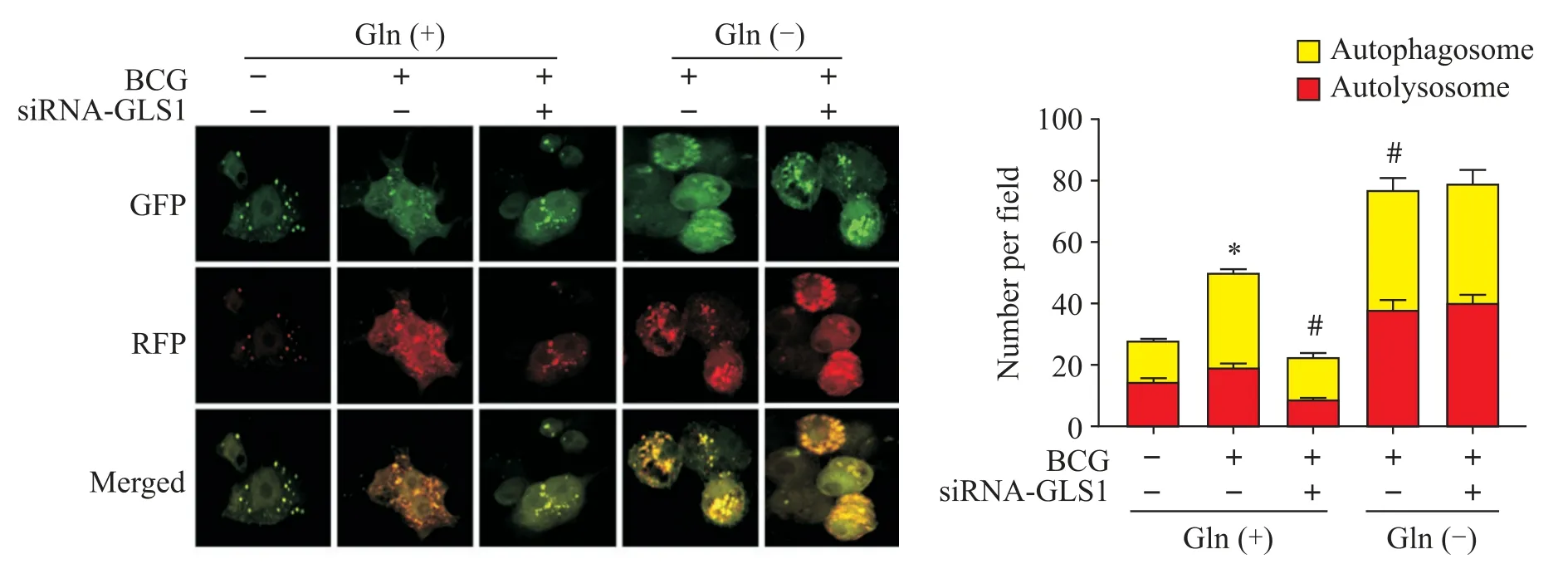
Figure 6. Immunofluorescence observation of the effect of glutamine deprivation on autophagic flux in macrophages inhibited by siRNA-GLS1(×800). Mean±SD. n=3.*P<0.05 vs NC group;#P<0.05 vs BCG group.图6 免疫荧光观测剥夺谷氨酰胺对siRNA-GLS1抑制的巨噬细胞内自噬流的影响
谷氨酰胺是最丰富的游离氨基酸之一,被认为是炎症和许多其他应激条件下的必需氨基酸,口粮中添加L-谷氨酰胺可激活小鼠肠道固有免疫,增强疫苗免疫小鼠的免疫应答,减轻氧化应激[15-16]。Mortimore 等[17]的研究表明,氨基酸可以调节细胞自噬;Zhu等[18]的研究表明,谷氨酰胺代谢参与调控细胞自噬。GLS1 作为谷氨酰胺代谢的关键酶和限速酶,增加其表达可实现谷氨酰胺的高分解率。因此,细胞内谷氨酰胺含量会受到GLS1 表达量和活性的影响。本研究发现,敲减巨噬细胞内GLS1的表达显著增加了细胞内谷氨酰胺的含量,并伴随自噬的减弱,因此我们推测GLS1 调控的细胞自噬与细胞内谷氨酰胺含量增加相关。进一步验证结果表明,在BCG 感染巨噬细胞RAW264.7 过程中,敲减GLS1的表达可通过增加巨噬细胞内谷氨酰胺含量而抑制细胞自噬。目前有研究发现,敲减GLS1后,细胞内谷氨酰胺分解代谢的确会受到影响,谷氨酰胺代谢物能够产生谷胱甘肽和NADPH 来拮抗ROS,而ROS 又可以直接激活自噬,进而抑制细胞自噬[19]。另外,谷氨酰胺缺乏后,mTOR 的激活会减少,可通过抑制mTOR 来增强自噬[20]。
综上所述,我们的研究初步探究了GLS1 在BCG感染的巨噬细胞自噬中的调控作用,但该过程的潜在分子机制仍需进一步深入研究。本研究为Mtb 致病机制的解读提供新的视角与实验依据。

