棕榈酸诱导人胰岛β细胞去特征化*
刘 娜, 刘腾丽, 王 乐, 梁 瑞△, 王树森
(1天津市第一中心医院卫生部危重病急救医学重点实验室,天津 300384;2天津市第一中心医院器官移植中心,天津 300190)
糖尿病是一个重大的全球健康问题,其中2 型糖尿病占总发病率的90%[1]。游离脂肪酸(free fatty acid,FFA)是参与大多数生物体能量代谢的营养物质,研究表明,空腹和餐后的FFA 浓度升高会增加患2 型糖尿病的风险[2]。血浆FFA 浓度的长期增加会导致脂质代谢调节紊乱,从而导致β 细胞功能和活力下降(脂毒性),并因此诱发2型糖尿病[3]。
胰岛功能受损是2 型糖尿病的主要特征之一,其中β 细胞功能下降或质量不足是胰岛功能受损的核心机制。新近的研究表明,β细胞去分化可能是导致2 型糖尿病β 细胞功能受损的主要原因[4-6]。我们已发表的研究中也证实,缺氧及炎症信号通路通过诱导人胰岛β 细胞发生去分化从而导致β 细胞功能障碍[7-8]。因此本研究将主要利用分离得到的中国人群非糖尿病胰岛细胞,探讨棕榈酸(palmitic acid,PA)对人胰岛功能的影响及其机制。
材料和方法
1 材料
人胰腺样本于 2018 年 11 月~2021 年 7 月由天津市第一中心医院器官移植中心提供,该研究经过了天津市第一中心医院伦理委员会的批准(批准号:2018N161KY),样本信息见表1。C57BL/6J小鼠购自北京华阜康生物科技股份有限公司。
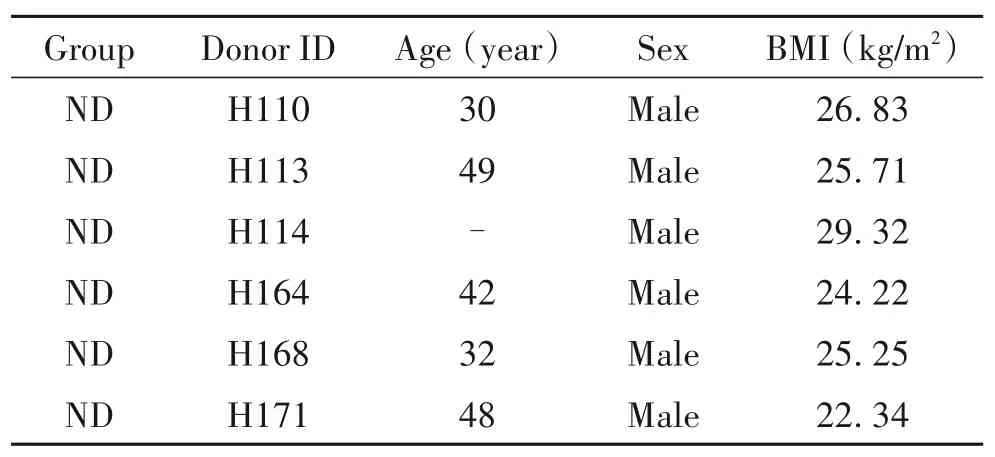
表1 人胰腺样本信息Table 1. Clinical characteristics of organ donor
2 主要试剂
胰岛消化胶原酶购自Serva;CMRL-1066 培养液购自 Corning;RPMI-1640 培养液、DMEM 培养液和DMEM/F12培养液及胎牛血清和双抗购自Gibco;RIPA蛋白裂解液购自索莱宝;PA购自Sigma;人胰岛素酶联免疫试剂盒和小鼠胰岛素酶联免疫试剂盒购自Mercodia;豚鼠抗胰岛素抗体(ab7842)购自Abcam;兔抗 NKX6.1 抗体(NBP1-49672)和兔抗 ALDH1A3抗体(NBP2-15339)购自 Novus;兔抗 FOXO1 抗体(LSB-5283)购自LSBio;兔抗MAFA 抗体(CST79737)和兔抗PDX1 抗体(CST5679)购自Cell signaling technology;RNA 逆 转 录 试 剂 盒 购 自 Qiagen;SYBR GREEN购自TaKaRa。
3 实验方法
3.1 PA 配制 利用0.1 mol/L NaOH 溶液配制40 mmol/LPA 溶液,于75 ℃水浴充分皂化约30 min,最终至无色透明澄清。将PBS 溶液预热至55 ℃,配制40%无脂肪酸-BSA 溶液。将40 mmol/LPA 溶液和40%无脂肪酸-BSA 溶液按1∶1 混合,得到20 mmol/LPA存储液。
3.2 人胰岛细胞的制备 人胰岛细胞的制备在天津市第一中心医院GMP 实验室内完成。经主胰管内灌注胶原酶后,应用Ricordi 消化系统将胰腺组织消化,保持37 ℃恒温,利用连续密度梯度离心法获得纯化的人胰岛细胞[9]。双硫腙染色法检测胰岛细胞纯度,FDA/PI染色鉴定胰岛细胞活性,选取纯度超过90%、活性超过90%的胰岛细胞进行本研究。将所提取的胰岛细胞培养于37 ℃、5%CO2的培养箱中。
3.3 小鼠胰岛细胞的制备 小鼠断颈处死后取仰卧位,于近肝门端胆总管逆行插入27G 静脉注射针,灌注(2~4)mL 冷胶原酶P 溶液,迅速将整个胰腺完整地分离放入50 mL 离心管中,于37 ℃水浴锅消化,用含10%胎牛血清的RPMI-1640 培养液终止消化,于4 ℃离心机中180×g离心2 min。弃上清后,用RPMI-1640培养液重悬,用40 μm筛网过滤悬液,于4 ℃离心机中180×g 离心2 min。弃上清后加入Histopaque-1077分离液重悬沉淀,之后沿试管壁缓慢加入 RPMI-1640 培养液,于20 ℃离心机中 1036.8×g离心20 min。吸取Histopaque-1077 分离液和RPMI-1640 培养液分界处的胰岛,用含10%胎牛血清的RPMI-1640培养液洗2遍后转移至细胞培养皿中,于显微镜下手挑纯化胰岛细胞[10]。将所提取的胰岛细胞培养于37 ℃、5%CO2的培养箱中。
3.4 细胞培养 人胰岛细胞培养于添加了10%胎牛血清和1%双抗的CMRL-1066 培养液中;小鼠胰岛细胞培养于添加了10%胎牛血清和1%双抗的RPMI-1640 培养液中;小鼠胰岛素瘤βTC-6 细胞系(ATCC CRL-11506TM)培养于添加了10%胎牛血清和1%双抗的DMEM 培养液中;小鼠胰岛素瘤NIT-1 细胞系(ATCC CRL-2055TM)培养于添加了10%胎牛血清和1%双抗的DMEM/DF12培养液中。
3.5 PA 处理 将人胰岛细胞和小鼠胰岛细胞培养于低黏附6 孔培养板中,每孔200 个胰岛细胞,分为对照组和PA0.6 mmol/L 组;βTC-6 细胞系按每孔106个传于12 孔培养板中,分为对照组和PA0.6 mmol/L组[11];NIT-1 细胞系按每孔5×105个传于 12 孔培养板中,分为对照组和PA0.2 mmol/L 组,均处理48 h 后,收集细胞,用于后续实验。
3.6 胰岛素分泌水平检测 收集各组胰岛细胞,按所需数量(每个生物学重复7~8 个胰岛细胞)挑选大小接近的胰岛细胞,置于含1.67 mmol/L 葡萄糖的KREB 缓冲液中预孵育1 h,分别依次在含1.67 mmol/L 和 16.7 mmol/L 葡萄糖的 KREB 缓冲液中,于37 ℃,5%CO2培养箱中孵育1 h,收集上清,利用胰岛素酶联免疫试剂盒检测胰岛素含量[12]。收集胰岛细胞用 RIPA 蛋白裂解液裂解(每孔100 μL),使用Bradford 法测定各孔细胞裂解液中蛋白含量,ELISA试剂盒检测胰岛细胞内胰岛素含量。
3.7 Western blot 收集各组细胞,提取总蛋白。将待测蛋白样品与5×上样缓冲液混合后,煮沸变性5 min,立即冰浴2 min 以上。根据蛋白分子量大小,配制12%的SDS-PAGE,将凝胶置于1× Tris-甘氨酸电泳缓冲液中,取合适量的蛋白样品上样,进行电泳。电泳停止后将凝胶取出,置于转膜专用的三明治夹中,于转移缓冲液中4 ℃、250 mA 恒流转膜。用5%脱脂牛奶封闭膜,并孵育Ⅰ抗。用1×TBST 洗涤后孵育Ⅱ抗,通过增强化学发光法观察免疫反应性条带,利用ImageJ软件进行蛋白定量。
3.8 RT-qPCR 收集各组细胞,提取RNA,依据逆转录试剂盒说明书逆转录为cDNA,逆转条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。RT-qPCR 总反应体系为20 μL,包括反转录样本1 μL,上、下游引物各1 μL,无菌水7 μL,Syber Green10 μL。反应条件为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min(40 个循环)。mRNA 的相对表达量以 36B4 作为内参照,通过 2-ΔΔCT计算。引物序列见表2、3。

表2 人RT-qPCR引物序列Table 2. The suquences of the human primers
3.9 免疫荧光染色 将收集的人胰岛细胞放入4%多聚甲醛中,4 ℃固定30 min,脱水后经石蜡包埋切片(3 μm)。切片脱蜡后,用EDTA 抗原修复液放在微波炉中进行抗原修复。经洗涤、透化、血清封闭后,孵育Ⅰ抗于4 ℃过夜,然后孵育对应的Ⅱ抗,放入37 ℃恒温箱中反应30 min,最后用 DAPI(Vector)进行细胞核染色。采用Pannoramic MIDI 和Pannoramic Viewer(3DHistech)荧光扫描仪器对染色切片进行扫描和图像采集。每个样本至少选择6 个胰岛,利用ImageJ 软件分析目的蛋白表达的荧光强度,并利用IPP 6.0软件分析目的蛋白表达区域面积。
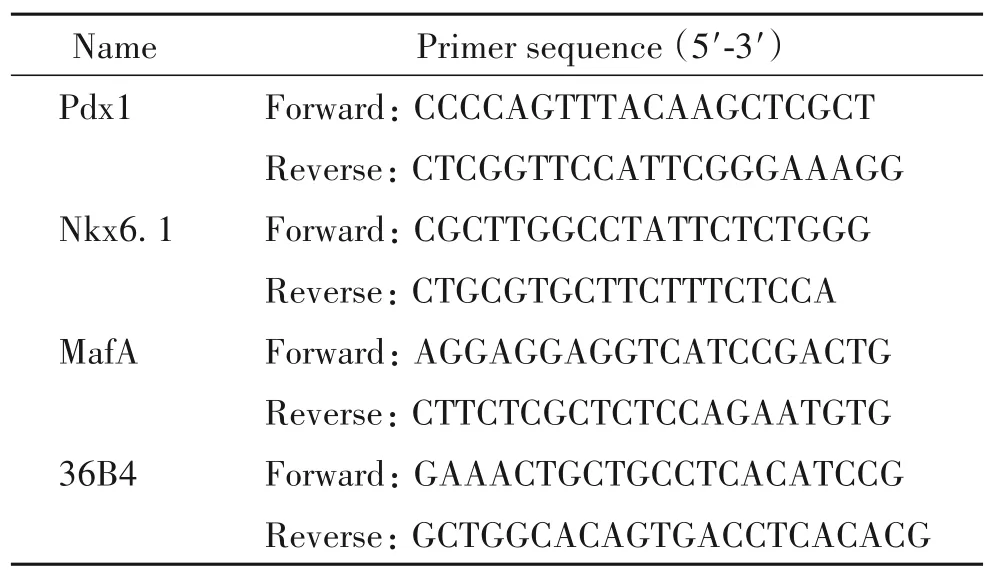
表3 小鼠RT-qPCR引物序列Table 3. The suquences of the mouse primers
4 统计学处理
全部数据采用GraphPad Prism 8.0 统计软件进行分析。组间比较采用非配对t检验,每组数据至少重复3 次,以均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结 果
1 PA 处理导致人和小鼠胰岛细胞的胰岛素分泌受损
为了研究PA 对β 细胞功能的影响,我们用PA处理人胰岛细胞后,通过葡萄糖刺激的胰岛素分泌实验进行检测。结果如图1 所示,高糖(16.7 mmol/L)刺激后,经ELISA 检测胰岛素分泌量,并通过总蛋白量校准后,显示PA 处理的人胰岛细胞组中胰岛素分泌水平降低87%,显著低于对照组(P<0.05),见图1A;在小鼠胰岛细胞中,我们也观察到相似的结果,PA 处理的小鼠胰岛细胞中,葡萄糖刺激胰岛素分泌降低了80%(P<0.01),见图1B。
2 PA抑制了β细胞关键转录因子的表达水平
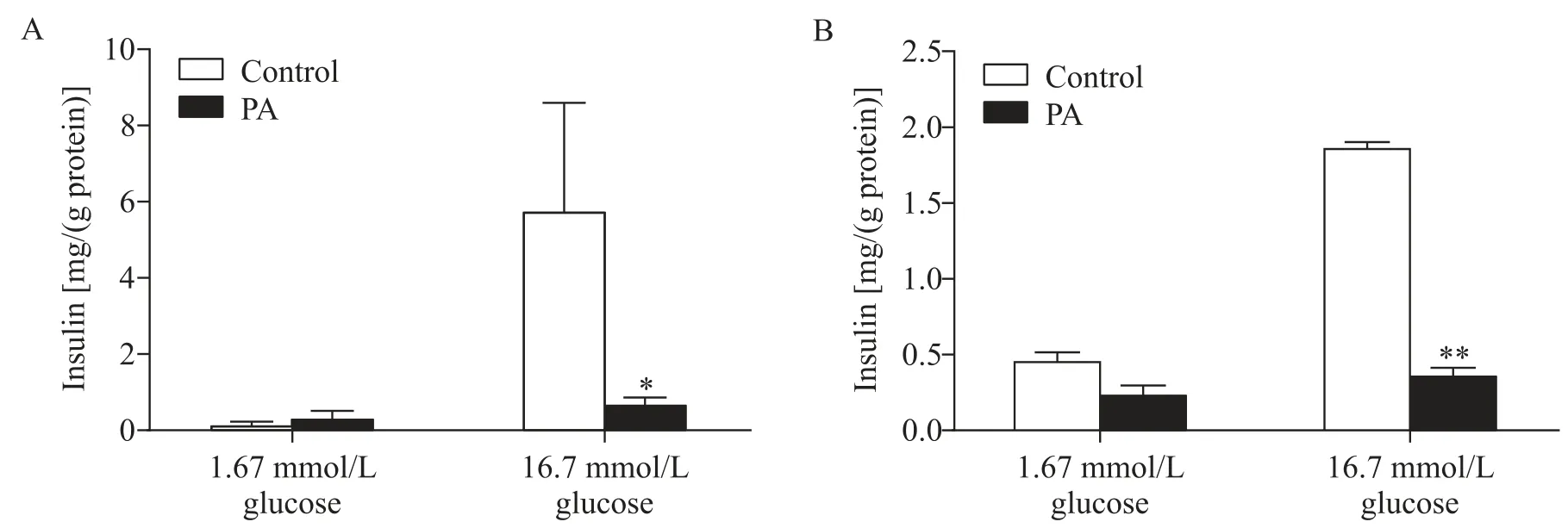
Figure 1. Palmitic acid(PA)impaired the glucose-stimulated insulin secretion. A:absolute insulin secretion from human islets;B:absolute insulin secretion from mouse islets. Mean±SD. n=3.*P<0.05,**P<0.01 vs control group.图1 棕榈酸处理使葡萄糖刺激的胰岛素分泌受损
为了探究PA 导致β 细胞胰岛素分泌受损的机制,我们首先通过Western blot 检测了小鼠β 细胞系βTC-6 和 NIT-1 中 β 细胞关键转录因子 Pdx1 和 MafA的蛋白表达水平,结果显示PA 处理组较对照组Pdx1和MafA 的蛋白表达水平显著降低(P<0.05),见图2A、B。RT-qPCR 结果显示,PA 处理组较对照组βTC-6、NIT-1 和小鼠胰岛中β 细胞关键转录因子Pdx1、Nkx6.1 和MafA 的 mRNA 表达水平均显著降低(P<0.05或P<0.01),见图2C~E。且3例非糖尿患者胰岛细胞经PA 处理后,结果亦显示PA 处理组较对照组显著抑制了人胰岛β 细胞关键转录因子PDX1、NKX6.1 和 MAFA 的 mRNA 表达水平(P<0.05 或P<0.01),见图2F~H。
3 PA 对人胰岛 β 细胞中 NKX6.1 和 FOXO1 表达分布的影响
我们进一步通过免疫荧光染色实验检测了PA处理后的人胰岛β 细胞中NKX6.1 和FOXO1 的表达水平及分布情况。结果如图3 所示,NKX6.1 主要在人胰岛β细胞的细胞核中表达,相较于对照组,PA处理组人胰岛β 细胞表达NKX6.1 的平均荧光强度显著下调,NKX6.1 表达面积亦显著下调(P<0.05)。PA 处理组中,未观察到NKX6.1 由人胰岛β 细胞的细胞核转移到细胞质,29%的insulin 阳性细胞中NKX6.1表达丢失(见图3A白色箭头)。FOXO1则主要在人胰岛β 细胞的细胞质中表达,相较于对照组,PA 处理组人胰岛β 细胞表达FOXO1 的平均荧光强度下调,FOXO1 表达面积亦显著下调(P<0.01),但未观察到FOXO1 由细胞质向细胞核转位的现象,见图4。
4 PA对人胰岛β细胞中ALDH1A3表达的影响
β细胞去分化的关键特征是回到祖细胞样阶段,ALDH1A3 作为祖细胞的标志性分子,通常在去分化的细胞中富集表达。3 例非糖尿患者胰岛细胞的RT-qPCR 结果均显示,PA 显著抑制了人胰岛 β 细胞中ALDH1A3的 mRNA 表达水平(P<0.01),见图 5。我们通过免疫荧光染色实验检测了PA 处理后人胰岛 β 细胞中 ALDH1A3 表达,结果显示,ALDH1A3 阳性的细胞均不表达insulin,与对照组相比,PA处理组人胰岛β 细胞表达ALDH1A3 的平均荧光强度无显著差异,ALDH1A3 表达面积亦无显著差异(P>0.05),见图6。
5 PA诱导人胰岛细胞炎症反应
通过RT-qPCR 实验检测PA 处理后人胰岛细胞中炎症因子的表达水平,结果显示PA 显著上调了人胰岛细胞中 IL-1β 和 COX2 的 mRNA 表达水平(P<0.01),见图7。
讨 论
PA 是人体中最普遍的饱和脂肪酸,流行病学研究显示PA 和2 型糖尿病密切相关,且在个体饱和脂肪酸中,PA 对糖尿病的发展具有更高的风险比[13]。因此,我们通过分离非糖尿患者胰岛细胞和小鼠胰岛细胞,体外暴露于PA 培养48 h,PA 显著抑制高糖刺激的人胰岛细胞和小鼠胰岛细胞胰岛素分泌,导致β细胞功能受损。
多项机制研究表明脂肪酸主要通过激发内质网应激[14-16],诱导氧化应激反应和线粒体功能障碍[17-18],诱导 β 细胞自噬[19-21],激活 β 细胞炎症通路[22-23],进而导致β 细胞功能衰竭。我们的研究显示,PA 处理抑制了β 细胞系中关键转录因子Pdx1 和MafA的蛋白表达水平,且抑制了β细胞系,小鼠及人胰岛细胞中β 细胞关键转录因子包括Pdx1、Nkx6.1和MafA 的mRNA 表达水平。免疫荧光染色实验进一步证实了PA 处理引起非糖尿患者胰岛β 细胞中NKX6.1 和FOXO1 蛋白水平表达降低。研究报道显示2 型糖尿病β 细胞去分化程度随着病程的发展而推移,表现为FOXO1 由细胞质转位至细胞核至表达丢失,NKX6.1 由细胞核转位至细胞质[5],我们已发表的研究也报导了中国2 型糖尿患者胰岛β 细胞中NKX6.1 的异常表达,包括NKX6.1 在细胞核质中均表达,NKX6.1 仅在细胞质中表达以及β 细胞NKX6.1 表 达 缺 失[24]。 本 研 究 中 PA 处 理 前 后NKX6.1均在人胰岛β细胞细胞核中表达,FOXO1均在人胰岛β 细胞细胞质中表达,暂未观察到NKX6.1和FOXO1 的细胞转位,但29%的insulin 阳性细胞NKX6.1 表达缺失。成熟β 细胞的身份特征由β 细胞核心转录因子和胰岛素决定[25],因此,我们认为PA诱导非糖尿患者胰岛β细胞发生了去特征化。
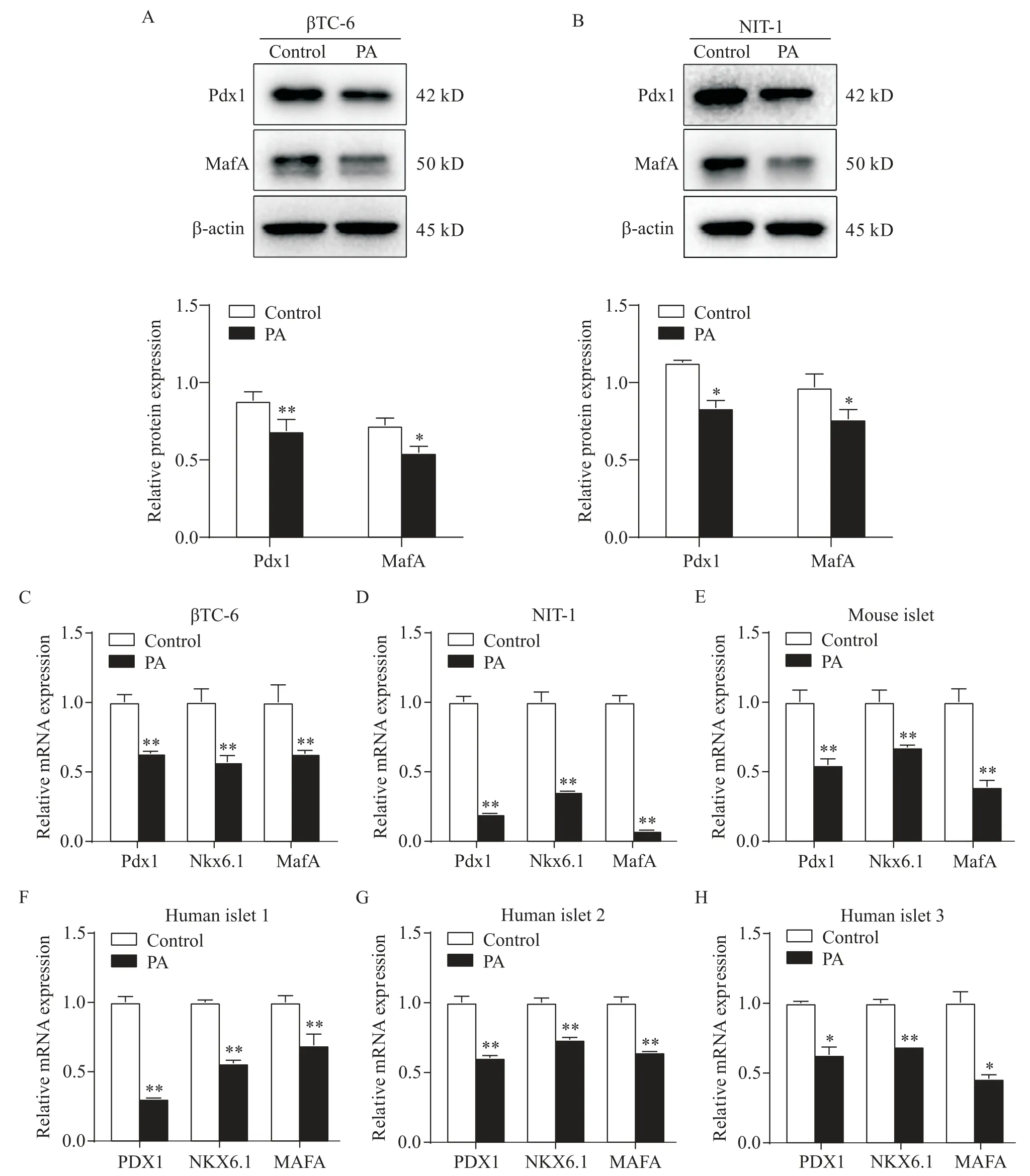
Figure 2. Palmitic acid(PA)inhibited the expression of β-cell key transcription factors. A and B:effect of PA treatment on the protein expression of Pdx1 and MafA in βTC-6 cells and NIT-1 cells;C~H:relative mRNA expression in βTC-6 cells,NIT-1 cells,mouse islets and human islets with or without PA for 48 h. Mean±SD. n=3.*P<0.05,**P<0.01 vs control group.图2 棕榈酸抑制β细胞关键转录因子的表达水平
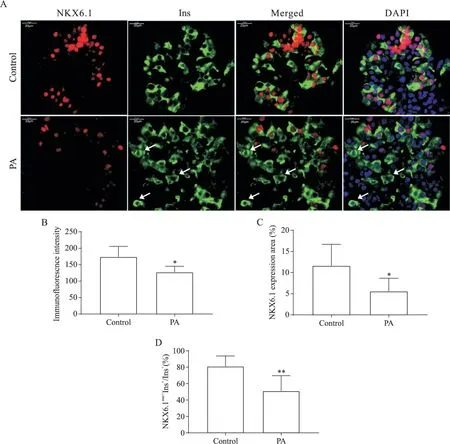
Figure 3. Immunofluorescence staining of NKX6.1 in human islets with or without palmitic acid(PA)treatment. A:PA inhibited NKX6.1 expression in human islet β cells[immunofluorescence staining of NKX6.1(red),insulin(Ins,green)and DAPI(blue)in human islets with or without PA treatment;arrows indicated the β cells without NKX6.1 expression;scale bar=20 μm];B,C and D:quantification of NKX6.1 expression and β cells with nuclear expression of NKX6.1(NKX6.1nuc+Ins+cells). Mean±SD. n=10.*P<0.05,**P<0.01 vs control group.图3 棕榈酸对人胰岛β细胞中NKX6.1表达分布的影响
ALDH1A3是成熟 β 细胞非允许基因,其在 β 细胞中的异位表达是β 细胞去分化特征之一[26]。为了研究PA 处理是否通过诱导β 细胞去分化,从而使β细胞功能受损,我们检测了ALDH1A3 在人胰岛β 细胞中的表达情况。结果显示PA 处理后,但并未导致ALDH1A3 表达的升高,即未发生向祖细胞方向的去分化。Nordmann 等[27]用硬质酸盐处理小鼠胰岛细胞,同样是仅仅观察到β 细胞特有的转录因子和功能基因的变化,但并未观察到ALDH1A3 的变化,即未发生去分化,这与我们的研究结果一致。
我们已发表的研究证实了中国2 型糖尿患者群胰岛β 细胞中炎症水平上调,且IL-1β/COX2/PGE2信号通路在 β 细胞功能损伤中发挥重要作用[12,28]。我们的研究发现PA 促进了胰岛细胞中IL-1β 和COX2 mRNA 表达水平的上调,推测PA 可能通过诱导胰岛内炎症水平升高,从而导致β 细胞功能损伤。以往的研究中也已经证实了炎症信号在诱导β 细胞去分化中发挥重要作用[27]。然而,尽管脂肪酸急性处理增强了胰岛内的炎症信号,但是仅仅导致β 细胞功能方面的“去特征化”,并未导致ALDH1A3表达的升高,发生向祖细胞方向的转化。可见脂肪酸对β细胞的毒性作用机制较为复杂,所引起的炎症水平升高只是其中的一部分改变,可能并非主导的信号通路。
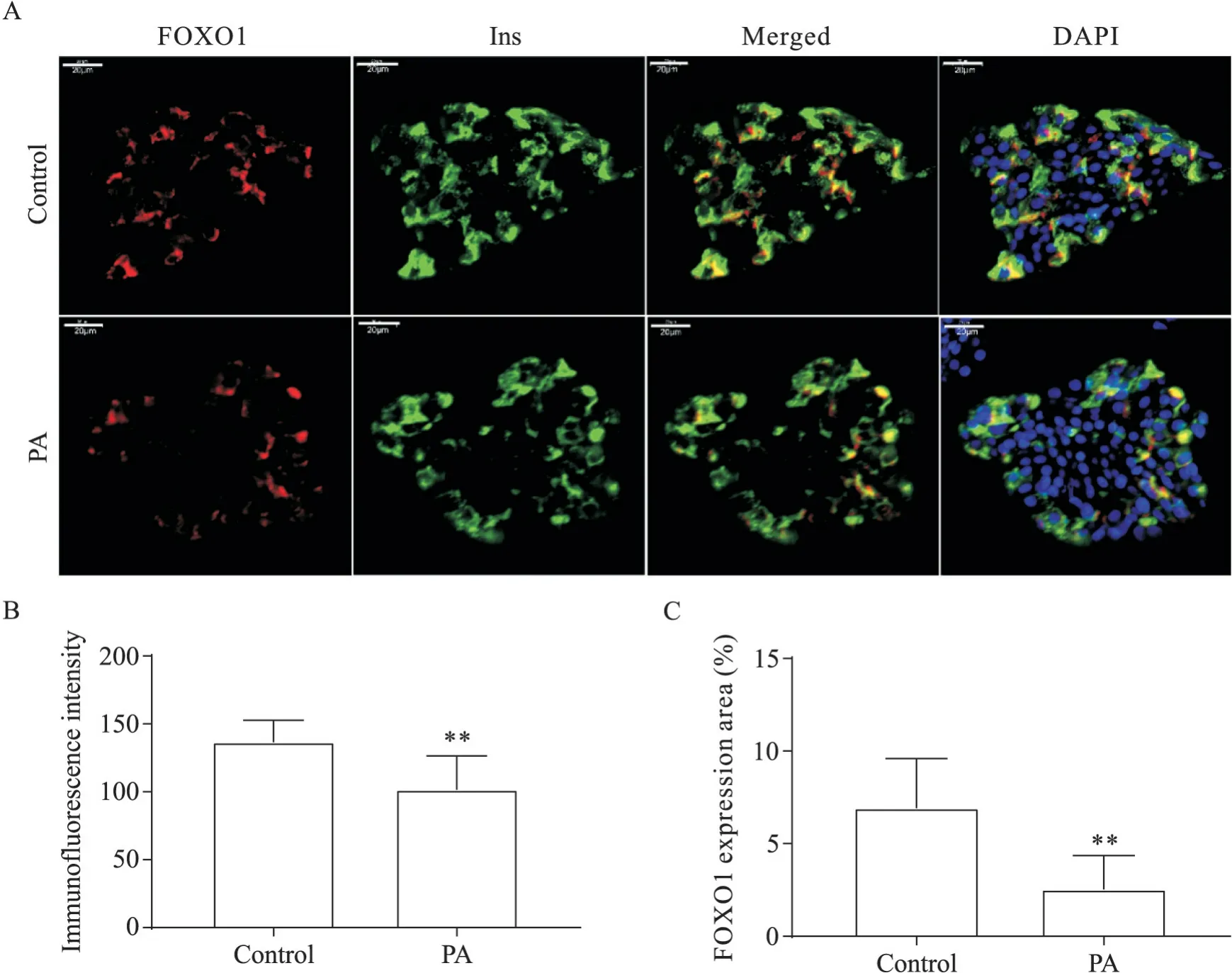
Figure 4. Immunofluorescence staining of FOXO1 in human islets with or without palmitic acid(PA)treatment. A:PA inhibited FOXO1 expression in human islet β cells[immunofluorescence staining of FOXO1(red),insulin(Ins,green)and DAPI(blue)in human islets with or without PA treatment;scale bar=20 μm];B and C:quantification of FOXO1 expression.Mean±SD. n=10.**P<0.01 vs control group.图4 棕榈酸对人胰岛β细胞中FOXO1表达分布的影响
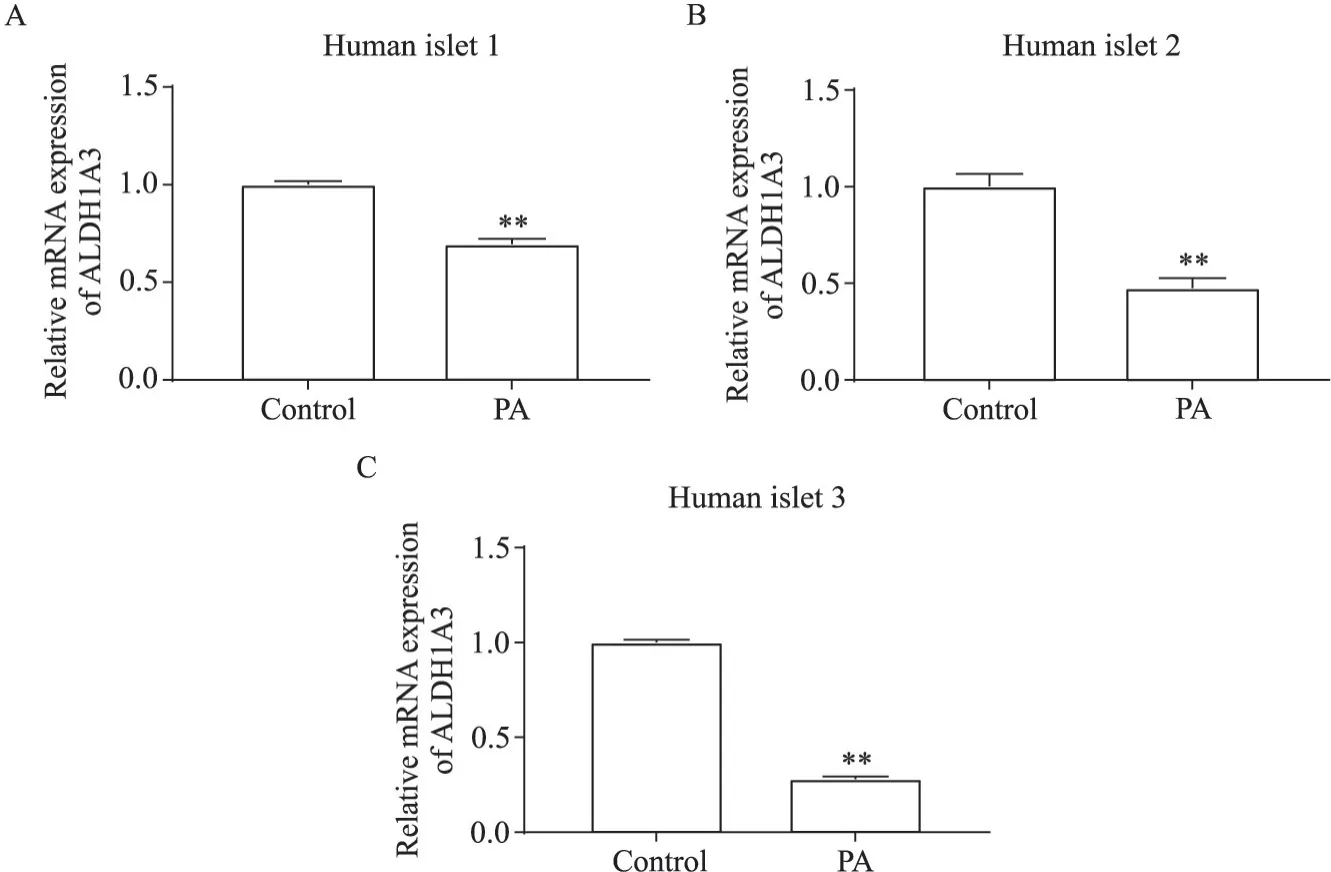
Figure 5. Relative mRNA expression of ALDH1A3 in human islets with or without palmitic acid(PA)treatment. Mean±SD. n=3.**P<0.01 vs control group.图5 棕榈酸处理对人胰岛β细胞中ALDH1A3 mRNA表达水平的影响
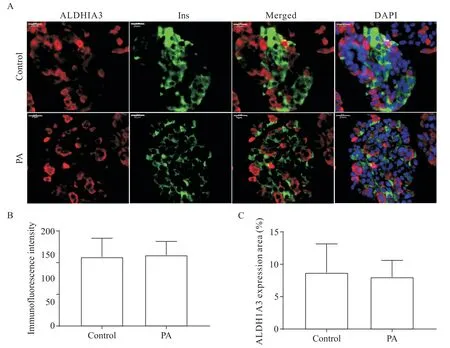
Figure 6. Immunofluorescence staining of ALDH1A3 in human islets with or without palmitic acid(PA)treatment. A:PA treatment had no effect on ALDH1A3 expression in human islets[immunofluorescence staining of ALDH1A3(red),insulin(Ins,green)and DAPI(blue)in human islets with or without PA treatment;scale bar=20 μm];B and C:quantification of ALDH1A3 expression. Mean±SD. n=10.图6 棕榈酸对人胰岛β细胞中ALDH1A3表达的影响
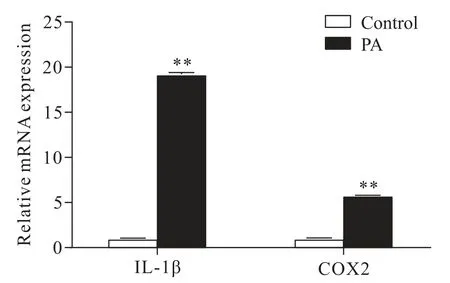
Figure 7. Relative mRNA expression of IL-1β and COX2 in human islets with or without palmitic acid(PA)treatment. Mean±SD. n=3.**P<0.01 vs control group.图7 棕榈酸对人胰岛细胞中IL-1β 和COX2 mRNA 表达水平的影响
综上所述,本研究检测PA 暴露对体外分离的原代人胰岛细胞造成的损伤。首先,我们观察到PA 处理严重损伤了胰岛细胞的葡萄糖刺激下胰岛素分泌能力;其次,进一步的分子生物学研究显示,PA 处理抑制 β 细胞关键转录因子 PDX1、NKX6.1、MAFA 和FOXO1 等的表达,但是并未造成β 细胞去分化标志基因ALDH1A3表达的升高,及 FOXO1 和 NKX6.1 的错误转位,提示PA 处理可能诱导了β 细胞发生去特征化,进而引起β 细胞功能障碍;第三,对炎症信号通路的研究显示,PA 处理激活了胰岛内IL-1β/COX2信号通路,提示PA 引起的炎症反应可能也参与调控了β细胞的去特征化。

