PPARδ调控自噬在GLP-1受体激动剂艾塞那肽改善胰岛β细胞功能中的作用*
苏燕娜, 林倍思, 陈亚兰, 刘子瑜, 甘 露, 徐 芬, 许 雯
(中山大学附属第三医院内分泌与代谢病学科,广东省糖尿病防治重点实验室,广东 广州 510630)
胰岛β 细胞数量下降及功能受损是2 型糖尿病(type 2 diabetes mellitus,T2DM)发生发展的重要病理生理过程[1],相关机制研究一直受到人们关注。近年来有证据提示细胞自噬受损可能在胰岛功能衰退的进展中发挥重要作用[2]。细胞自噬是细胞维持稳态的一种重要机制,可通过清除功能异常的细胞成分及产物来维持细胞能量水平、成分和代谢物平衡,减少细胞损伤。在T2DM 患者中,自噬受损导致线粒体质量下降,损伤的线粒体堆积,加重高血糖的恶化;而通过诱导自噬清除损伤的线粒体后,患者胰岛功能明显改善,血糖可得到进一步控制[3],以上结果提示细胞自噬与胰岛功能间存在联系。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是调节目标基因表达的核内受体转录因子超家族,包括PPARα、PPARγ及PPARδ,在代谢疾病,如高脂血症及糖尿病中 发挥 重 要作 用[4]。相 对 于 PPARα 及 PPARγ,PPARδ 在体内表达更为广泛,同时涉及脂肪酸代谢及糖代谢[5]。已有研究发现PPARδ 在胰岛素瘤细胞及大鼠胰腺组织中表达水平最高[6]。PPARδ 不仅在改善糖脂代谢作用中扮演着重要角色,也有研究提示其可能在自噬通路中起着重要的正向调控的作用[7]。
胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)受体激动剂艾塞那肽(exenatide/exendin-4,Exe)是一种重要的降糖药物,可通过多种作用机制降低血糖[8]。而除了降糖以外,GLP-1 受体激动剂Exe 还可改善胰岛功能,但具体机制尚未完全阐明。近年来有研究提示,GLP-1 受体激动剂可以减少RINm5F 大鼠胰岛β 细胞因高糖高脂所致自噬受损[9]。而另一项研究发现GLP-1 受体激动剂可以促进 PPARδ 表达,改善心肌纤维化[10]。但在胰岛 β 细胞中,GLP-1 受体激动剂是否能通过PPARδ 改变自噬过程进而改善胰岛功能,尚未有相关研究探索。因此,本研究拟利用高脂诱导构建的T2DM 小鼠模型、原代胰岛及小鼠胰岛素瘤细胞株NIT-1,在动物及细胞层面探讨自噬在GLP-1 受体激动剂艾塞那肽对胰岛功能影响中的作用,并初步探索PPARδ 是否介导这一作用。
材料和方法
1 材料
1.2 主要仪器 荧光倒置显微镜及体视显微镜(Leica);双色红外成像系统(奥德赛);全自动酶标仪(Thermo);血糖仪及血糖试纸(强生稳豪)。
2 方法
2.1 动物实验分组造模及干预方法 4 周龄C57BL/6J 雄性小鼠购于南京动物模式研究所[生产许可证号:SCXK(苏)2015-0001],适应性喂养1 周后,根据空腹血糖(fasting plasma glucose,FPG)和体重随机分为正常饮食对照(normal diet control,NC)组和高脂饮食(high-fat diet,HFD)组,分别给予普通饲料(脂肪13%、蛋白质28%、碳水化合物59%)和高脂饲料(脂肪60%、蛋白质20%),饲养12周。HFD组小鼠FPG≥11.1 mmol/L 且糖耐量受损提示T2DM 小鼠模型成功构建。T2DM 小鼠随机分为2 组:HFD+Exe 组及HFD+生理盐水(saline)组,2 组小鼠分别予腹腔内注射 Exe(24 nmol·kg-1·d-1)和生理盐水 8 周,NC 组小鼠腹腔内注射等量生理盐水作为对照,每组10 只。每周称量小鼠体重,每4 周测FPG。在高脂12周时和药物干预结束时进行糖耐量实验。干预结束后,麻醉后颈椎脱臼处死小鼠,每组3 只小鼠留取胰腺组织,置于4%多聚甲醛中固定后包埋,行石蜡组织切片,其余小鼠胰腺组织用于提取原代胰岛。以上动物实验已通过中山大学实验动物委员会批准,批文号为:SYSU-IACUC-2018-000234。
2.2 腹腔注射葡萄糖耐量实验(intraperitoneal glucose tolerance test,IPGTT) 小鼠隔夜禁食,腹腔内注射葡萄糖(2 g/kg),于注射前(0 min)及注射后15、30、60、90和120 min时测定血糖水平,并计算曲线下面积(area under curve,AUC)。
2.3 腹腔注射胰岛素耐量实验(intraperitoneal insulin tolerance test,IPITT) 小鼠禁食6 h,腹腔内注射胰岛素(0.65 U/kg),于注射前(0 min)及注射后15、30、60、90和120 min时测定血糖水平,并计算AUC。
2.4 小鼠原代胰岛的提取 小鼠麻醉取血后处死。打开腹腔,充分暴露十二指肠大乳头和胆总管。在靠近肝脏处夹闭胆总管后,于十二指肠大乳头处穿刺,注入胶原酶(0.5 g/L,2 mL)后取出胰腺,于37 ℃水浴,消化至细沙状。用含10%FBS的HBSS缓冲液终止消化后4 ℃、1 000 r/min 离心1 min,弃上清。加入HBSS 缓冲液10 mL 重悬后离心,弃上清。加入梯度离心液5 mL,充分吹打后缓慢加入HBSS 缓冲液5 mL,4 ℃、1 500 r/min 梯度离心 20 min 后,再收集上清,离心沉淀胰岛。于体式显微镜下挑取包膜完整的胰岛,用于提取胰岛总蛋白。
2.5 胰腺组织免疫荧光 石蜡切片脱蜡后,抗原修复及封闭,滴加Ⅰ抗于湿盒内4 ℃孵育过夜。用磷酸盐缓冲液清洗3 遍后滴加Ⅱ抗室温孵育1 h,清洗3遍后滴加DAPI 染液室温孵育10 min 染核,再次清洗3 遍后,于荧光倒置显微镜下观察并采集图像,使用Image-Pro Plus 6.0软件分析荧光强度。
2.6 细胞培养与干预方法 NIT-1 细胞株购于美国模式培养物集存库(American Type Culture Collection,ATCC)。(1)NIT-1 细胞培养于含10%FBS 和 1%双抗的F-12K 培养基中;(2)细胞实验分为两部分,一部分将 NIT-1 细胞分为 BSA(10%)组、PA(400 μmol/L)组、PA+Exe(20 nmol/L)组和PA+GW501516(10 μmol/L)组,另一部分将NIT-1 细胞分为BSA 组、PA 组、PA+Exe 组、PA+GSK0660(1 μmol/L)组和 PA+Exe+GSK0660 组,共干预24 h;(3)利用CRISPR/Cas9基因编辑技术,使用插入sgRNA 片段的lentiCRISPRv2 载体在 NIT-1 细胞中靶向敲除PPARδ基因,以空白lentiCRISPRv2 载体作为阴性对照,并使用嘌呤霉素(2 mg/L)筛选稳定敲除PPARδ基因的细胞(PPARδknockout,PPARδ-KO)和对照细胞(PPARδwild type,PPARδ-WT),分别采用BSA、PA及PA+Exe干预PPARδ-KO和PPARδ-WT细胞24 h。
2.7 葡萄糖刺激胰岛素释放实验(glucose-stimulated insulin secretion,GSIS) 干预结束后,将细胞分别在 含 2.8 mmol/L 和 16.7 mmol/L 葡 萄 糖 的 KRBH 缓冲液中,37 ℃各孵育1 h 后收集上清,按照小鼠胰岛素ELISA 试剂盒说明书检测上清液中胰岛素含量。收集细胞,测量细胞总蛋白浓度作为数据校正。
2.8 蛋白提取及Western blot 用RIPA 裂解提取各组蛋白,用BCA 试剂盒进行蛋白浓度测定后配平。电泳后转于PVDF 膜上,5%脱脂牛奶室温封闭1 h,按1∶1 000稀释加入Ⅰ抗(PPARδ、LC3B、P62和β-actin 抗体)4 ℃孵育过夜,用Ⅱ抗(1∶10 000)室温避光孵育1 h后,双色红外成像系统扫描。
安装成功后,首先要进行项目参数设置,如图5所示;其次是确定审核范围,以便正确的读取需要审核的图层信息,然后分别进行框架梁、柱的施工图信息读取并按照步骤分别进行审查。
3 统计学处理
采用SPSS 20.0 软件进行分析,并采用Graph-Pad Prism 8 绘图。所有数据均进行正态性及方差齐性检验,正态分布的连续变量以均数±标准误(mean±SEM)表示。两组间比较用t检验;多组间比较采用单因素方差分析,并用LSD-t检验进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 Exe 降低T2DM 小鼠体重和FPG,并改善胰岛功能
HFD12周时,HFD组小鼠的体重和FPG与NC组相比明显升高(P<0.05)。HFD 组小鼠 FPG≥11.1 mmol/L,葡萄糖及胰岛素耐量结果提示HFD 后小鼠胰岛功能受损(P<0.05),见图1。结果提示,HFD12周时T2DM小鼠模型构建成功。

Figure 1. Comparison of body weight(A),FPG(B),IPGTT(C)and IPITT(D)between NC group and HFD group at 12 weeks of HFD. Mean±SEM. n=10.*P<0.05 vs NC group.图1 高脂饮食12周时NC组与HFD组小鼠体重、FPG、IPGTT和IPITT的比较
由图2 可见,与HFD+saline 组相比,在给予Exe治疗后的小鼠体重和FPG 明显下降,葡萄糖耐量受损情况有明显改善(P<0.05)。结果提示,Exe 可以降低T2DM小鼠体重和FPG,改善糖耐量受损情况。
2 Exe 对 T2DM 小鼠胰岛细胞自噬和 PPARδ 表达的影响
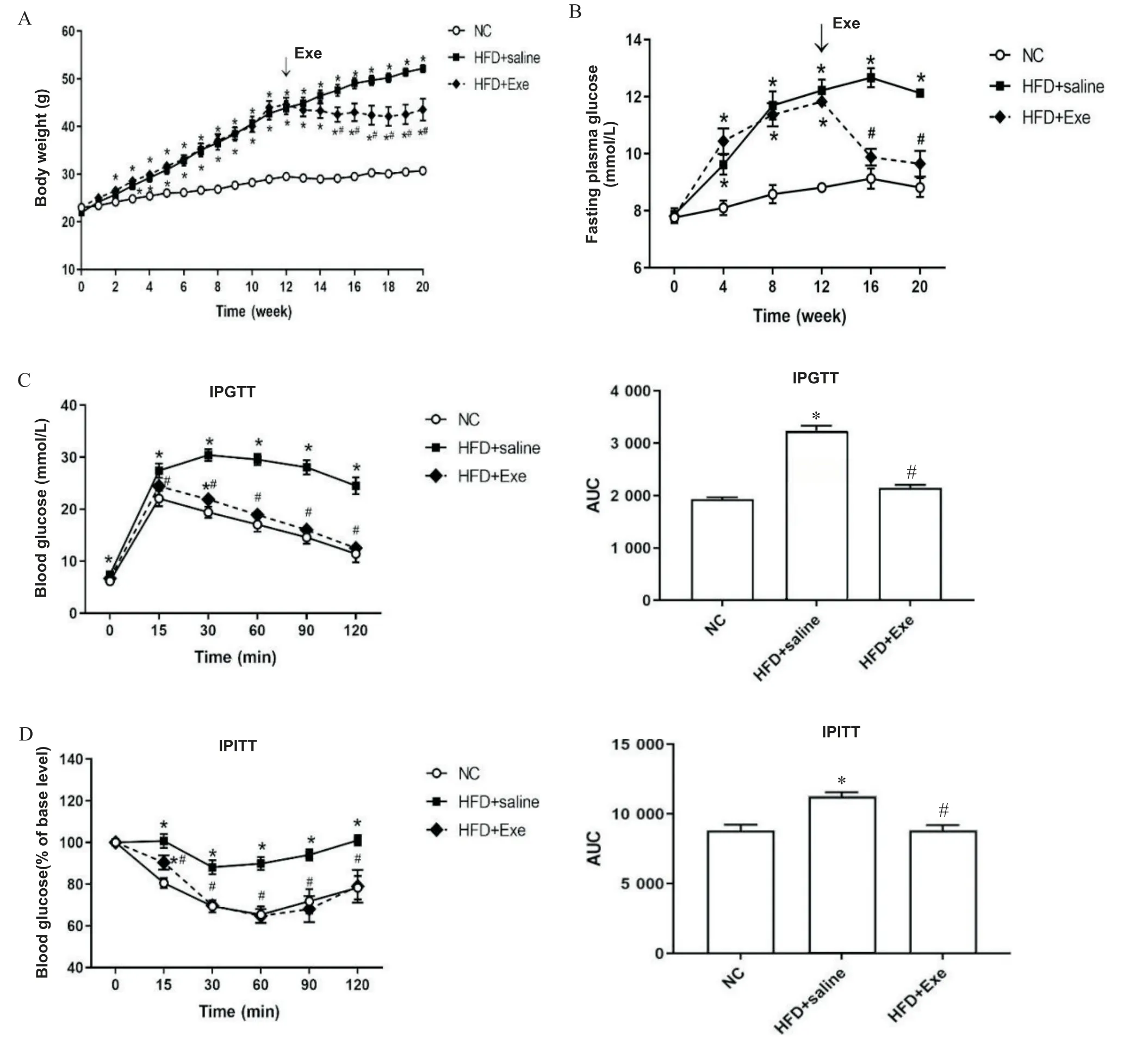
Figure 2. Changes of body weight(A),FPG(B),IPGTT(C)and IPITT(D)of mice in each group after exenatide(Exe)intervention for 8 weeks. Mean±SEM. n=10.*P<0.05 vs NC group;#P<0.05 vs HFD+saline group.图2 艾塞那肽干预8周时各组小鼠体重、FPG、IPGTT和IPITT的变化
由图3 免疫荧光结果可见,与NC 组相比,HFD+saline 组小鼠胰岛LC3B 表达明显下降(P<0.05);与HFD+saline 组相比,在 Exe 治疗后小鼠胰岛 LC3B 表达升高(P<0.05)。为了进一步探索Exe 对胰岛细胞自噬水平和PPARδ 表达的影响,我们提取了药物干预后小鼠原代胰岛细胞的总蛋白,Western blot 检测蛋白也得到了一致的结果:与NC 组对比,HFD+saline 组小鼠胰岛细胞LC3B-II 蛋白表达降低、P62 蛋白表达升高、PPARδ 蛋白表达降低;而Exe 治疗后可以明显升高LC3B-II 蛋白的表达量,降低P62 蛋白的表达量,同时可显著上调PPARδ 蛋白的表达量(P<0.05),见图4。以上结果提示,T2DM 小鼠胰岛细胞自噬受损、PPARδ 蛋白表达量下降,而GLP-1 受体激动剂Exe可促进胰岛自噬及PPARδ蛋白的表达。
3 Exe及GW501516对NIT-1细胞功能的影响
GSIS 结果显示,NIT-1 细胞在低糖(2.8 mmol/L)环境下,BSA 组、PA 组、PA+Exe 组和 PA+GW501516组各组间基础胰岛素分泌量无统计学差异。在高浓度葡萄糖(16.7 mmol/L)刺激下,与BSA 组对比,PA干预后NIT-1 细胞胰岛素分泌量明显减少(P<0.05);与 PA 组 相 比 ,Exe 和 PPARδ 激 动 剂GW501516 干预组NIT-1 细胞在高糖刺激下胰岛素的分泌量显著增加(P<0.05),见图5A。说明GLP-1受体激动剂 Exe 和 PPARδ 激动剂 GW501516 均有助于改善高脂环境下损伤的胰岛β细胞功能。

Figure 3. LC3B immunofluorescence staining and quantitative analysis in pancreatic tissues. Mean±SEM. n=5.*P<0.05 vs NC group;#P<0.05 vs HFD+saline group.图3 胰腺组织LC3B免疫荧光染色及定量分析

Figure 4. Effect of Exe on the protein expression of PPARδ,LC3B-II and P62 in islet. Mean±SEM. n=3.*P<0.05 vs NC group;#P<0.05 vs HFD+saline group.图4 艾塞那肽对胰岛细胞PPARδ、LC3B-II和P62蛋白表达的影响
4 Exe及GW501516对NIT-1细胞自噬的影响
与 BSA 组相比,PA 干预后 NIT-1 细胞 PPARδ 和LC3B-II 蛋白表达降低、P62 蛋白表达升高;与 PA 组相比,Exe 及GW501516 干预后可以明显升高PPARδ和LC3B-II 蛋白表达,降低P62 蛋白表达(P<0.05),见图5B。以上结果提示GLP-1 受体激动剂Exe 和PPARδ 激动剂 GW501516 均可以减轻 NIT-1 细胞因高脂所致自噬损伤。
5 Exe通过上调PPARδ促进胰岛β细胞自噬
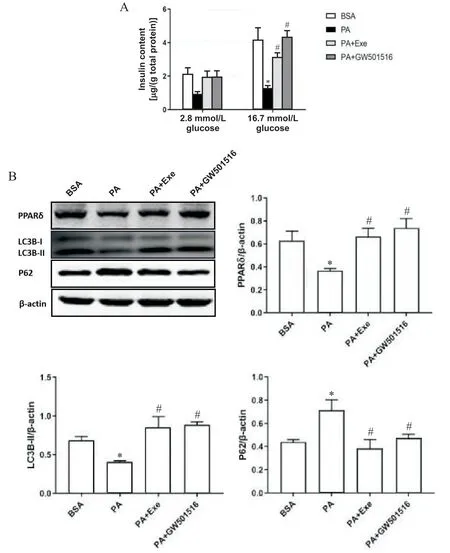
Figure 5. Effect of Exe and GW501516 on the GSIS(A)and protein expression of PPARδ,LC3B-II and P62(B)in NIT-1 cells.Mean±SEM. n=4.*P<0.05 vs BSA group;#P<0.05 vs PA group.图5 Exe及GW501516对NIT-1细胞GSIS及PPARδ、LC3B-II和P62蛋白表达的影响
与 PA 组相比,Exe 干预 NIT-1 细胞后 LC3B-II 蛋白表达升高,P62 蛋白表达降低,而 PPARδ 拮抗剂GSK0660 干预组 LC3B-II 蛋白表达下调,P62 蛋白表达上调;与 PA+Exe 组对比,PA+Exe+GSK0660 干预组NIT-1 细胞LC3B-II 蛋白表达减少,P62 蛋白表达增加(P<0.05),见图6。为进一步验证PPARδ在Exe调控β细胞自噬中的作用,通过CRISPR/Cas9技术构建PPARδ基因敲除模型,结果显示,与PPARδ-WT 细胞对比,PPARδ基因敲除后LC3B-II 蛋白表达降低,P62蛋白表达增多;而在PPARδ-KO细胞中,Exe干预后LC3B-II 及P62 蛋白表达与PA 组对比均无明显改变,见图7。以上结果说明,GLP-1受体激动剂Exe可能通过上调PPARδ促进胰岛β细胞自噬作用。
讨 论
GLP-1 是由胃肠道分泌的一类参与血糖调节的激素,通过中枢性抑制食欲、葡萄糖浓度依赖性促进胰岛素释放及抑制胰高糖素分泌、延缓胃排空等作用从而降低血糖,并具有较明显的减重作用,在能量代谢中发挥重要作用[11]。更令人关注的是,GLP-1促进胰岛β 细胞增殖和抑制凋亡的作用已在多项动物研究中得到证实[12-13]。与GLP-1 有53%同源性的GLP-1受体激动剂艾塞那肽可高度亲和GLP-1受体,因此可模拟天然GLP-1 的生理效应。既往多项临床研究均已证实GLP-1 受体激动剂对糖代谢、胰岛功能及胰岛素抵抗的改善作用[14-16]。本研究在高脂诱导的T2DM小鼠中同样证实了GLP-1受体激动剂Exe干预8 周后可以显著降低T2DM 小鼠体重及FPG,并改善小鼠葡萄糖耐量受损情况。
细胞自噬是蛋白质在膜包囊泡中降解的生物学过程,通过对受损细胞器和老化蛋白质等大分子物质进行降解进而维持细胞内环境稳定及细胞的完整性[17]。越来越多的证据显示,自噬在T2DM 的病理生理过程中发挥重要作用,但其对胰岛功能的作用仍存在争议。有研究发现,PA 干预后可以增加胰岛β 细胞系 INS-1 细胞自噬[18]。在糖尿病小鼠中发现胰岛自噬上调[19]。另一方面,也有研究发现自噬受损导致了 β 细胞功能障碍及 T2DM 发展[20]。Liu 等[3]研究发现,糖尿病小鼠胰岛中β 细胞自噬通量受损。在胰岛β细胞中抑制自噬后,β细胞功能受损且凋亡增加[21]。很多学者认为,自噬的提高抑制了脂毒性对胰岛β 细胞的损害,从而保护了胰岛β 细胞功能[22]。

Figure 6. Effect of Exe and GSK0660 on autophagy in NIT-1 cells. Mean±SEM. n=3.*P<0.05 vs BSA group;#P<0.05 vs PA group;△P<0.05 vs PA+Exe group;▲P<0.05 vs PA+GSK0660 group.图6 Exe及GSK0660对NIT-1细胞自噬的影响
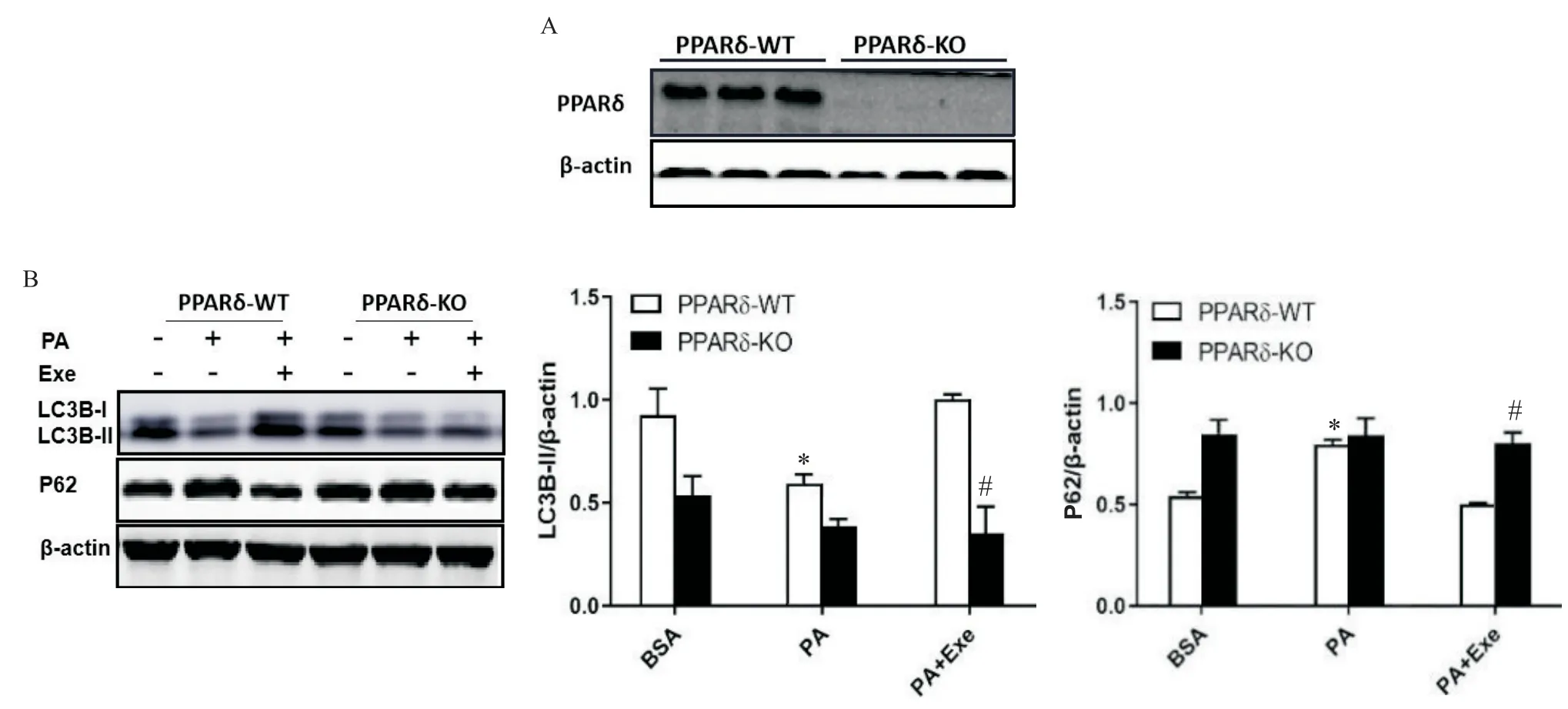
Figure 7. Effect of Exe on autophagy of PPARδ-KO NIT-1 cells. A:representative immunoblot bands of PPARδ in PPARδ-KO NIT-1 cells;B:representative immunoblot band and quantitative analysis of LC3B-II and P62 in PPARδ-KO NIT-1 cells,which were incubated with Exe for 24 h. PPARδ-WT:NIT-1 cells with wlid-type PPARδ gene. Mean±SEM. n=3.*P<0.05 vs BSA group;#P<0.05 vs PPARδ-WT group.图7 Exe对PPARδ-KO NIT-1细胞自噬的影响
目前有关GLP-1 受体激动剂通过自噬影响胰岛功能的机制研究相对较少。Chen 等[23]学者发现,GLP-1 受体激动剂可以促进MIN6 细胞自噬,通过抑制胰淀粉样多肽形成保护β 细胞功能。在本研究中发现,T2DM 小鼠胰岛自噬标志物LC3B 荧光表达降低,T2DM 小鼠胰岛和PA 诱导的NIT-1 细胞中发现LC3B-II 蛋白表达降低,P62 蛋白表达升高。LC3 家族蛋白包括LC3A、LC3B 及LC3C,目前研究最多和了解较深入的LC3 家族蛋白是LC3B。LC3B 对于自噬的执行是必不可少的[24]。LC3 存在两种形式,LC3-Ⅰ和LC3-II。LC3-II 与自噬小体特异性结合,含量与自噬小体形成的程度相关,是研究自噬的一个很好的标记物[25]。另外,当自噬活性减弱或自噬系统受损时,P62 蛋白会在细胞质中不断积累,因而P62也是反映自噬活性的重要标记蛋白之一,其蛋白含量间接反映自噬小体清除水平,与自噬流呈负相关[26]。因此,以上结果说明在T2DM 小鼠胰岛及PA诱导的NIT-1 细胞中自噬减弱,但在GLP-1 受体激动剂Exe 干预后,T2DM 小鼠胰岛LC3B 荧光表达升高,小鼠胰岛及NIT-1 细胞LC3B-II 蛋白表达升高,P62蛋白表达降低,说明GLP-1受体激动剂Exe可促进胰岛自噬作用。
PPARs 是调节目标基因表达的核内受体转录因子超家族,成员包括PPARα、PPARγ 及PPARδ。在2003 年发现了PPARδ 的特异性选择性激动剂GW501516 后,PPARδ 的生物学功能研究逐渐受到关注。相对于PPARα 及PPARγ,PPARδ 在体内表达更为广泛,且同时涉及脂肪酸代谢及糖代谢[27]。已有研究发现,在 PPARs 家族中,PPARδ 在胰岛 β 细胞中表达水平最高[6]。在不同的胰岛细胞株中激活PPARδ 可提高线粒体氧化能力,增强胰岛素促进糖刺激的胰岛素分泌效应,使持续暴露于脂毒性下所致的胰岛细胞糖刺激的胰岛素分泌效应受损程度减少[6,28]。使用PPARδ选择性激动剂后,脂肪甘油三脂酯酶敲除小鼠线粒体氧化过程包含的基因表达水平明显上升,糖刺激的胰岛素分泌效应恢复;但使用PPARα 选择性激动剂后,并没有发现以上结果[29]。可见,PPARδ 在胰岛功能中发挥着重要作用。我们的研究发现T2DM 小鼠胰岛及PA 诱导的NIT-1 细胞中PPARδ的表达下降,GLP-1受体激动剂Exe干预可以显著上调胰岛PPARδ 的表达;同时发现GLP-1 受体激动剂 Exe 及 PPARδ 激动剂 GW501516 明显促进葡萄糖刺激胰岛素的分泌增加,促进LC3B-II蛋白表达,抑制 P62 蛋白表达,而 Exe 联合 PPARδ 拮抗剂GSK0660 可明显降低 LC3B-II 蛋白表达,增加 P62 蛋白表达;敲除PPARδ基因后,NIT-1细胞中LC3B-II蛋白表达下降,P62 蛋白表达升高,说明自噬明显受到抑制,而同时GLP-1 受体激动剂Exe 效应明显减弱。以上结果表明 GLP-1 受体激动剂 Exe 通过 PPARδ 促进自噬作用,改善β细胞功能。
综上所述,我们的研究初步证实GLP-1 受体激动剂Exe 可通过促进自噬改善高脂损伤的胰岛β 细胞功能,并且这种作用由PPARδ 所介导。本研究在分子水平上补充了GLP-1 受体激动剂Exe 改善胰岛β 细胞功能作用的机制,其深入机制仍需进一步研究。相信随着更多有关GLP-1 受体激动剂Exe 研究的开展,我们对这类药物改善胰岛功能的作用机制也将会有更深入的了解。

